
- •Министерство образования и науки
- •Предисловие авторов
- •Содержание
- •1 Химическая термодинамика
- •1.1 Первое начало термодинамики
- •1.1.1 Основные понятия и определения
- •1.1.2 Первое начало термодинамики
- •1.1.3 Теплоемкость
- •1.1.4 Работа и теплота термодинамических процессов
- •1.1.5 Типы тепловых эффектов
- •1.1.6 Способы определения тепловых эффектов при постоянной температуре
- •1.1.7 Зависимость теплового эффекта реакции от температуры
- •1.1.8 Примеры решения задач
- •1.1.9 Вопросы для самоконтроля
- •1.2 Второе начало термодинамики
- •1.2.1 Основные понятия и определения
- •1.2.2 Математическое выражение
- •1.2.3 Изменение энтропии как критерий обратимости и необратимости процессов
- •1.2.4 Критерии направленности процессов в реальных системах
- •1.2.5 Расчет изменения энтропии в различных процессах
- •1.2.6 Фугитивность и коэффициент фугитивности реальных газов
- •1.2.7 Химический потенциал идеального и реального газа
- •1.2.8 Примеры решения задач
- •1.2.9 Вопросы для самоконтроля
- •1.3 Химическое равновесие
- •1.3.1 Закон действующих масс
- •1.3.2 Способы выражения константы равновесия
- •1.3.3 Выражение состава равновесной смеси
- •1.3.4 Влияние различных факторов на смещение равновесия (на состав равновесной смеси)
- •1.3.5 Мера химического сродства. Направление самопроизвольного протекания химической реакции
- •1.3.6 Методы определения константы равновесия при различной температуре (из справочных данных)
- •1. Из термодинамических свойств веществ:
- •4. Из логарифмов констант равновесия реакций образования некоторых веществ, lgKaf.
- •1.3.7 Примеры решения задач
- •1.3.8 Вопросы для самоконтроля
- •2 Фазовые равновесия
- •2.1 Основные понятия и определения
- •2.2 Однокомпонентные системы
- •2.3 Примеры решения задач
- •2.4 Вопросы для самоконтроля
- •2.5 Двухкомпонентные системы
- •2.5.1 Термический анализ как часть физико-химического анализа
- •2.5.2 Равновесие раствор – кристаллический компонент
- •2.5.3 Кривые охлаждения
- •2.5.4 Диаграмма плавкости двухкомпонентной системы с простой эвтектикой
- •2.6 Диаграммы состояния с образованием химического соединения
- •2.6.1 Определение состава фаз и относительного количества фаз
- •2.6.2 Диаграмма состояния системы с устойчивым химическим соединением
- •2.6.3 Диаграмма состояния системы с неустойчивым химическим соединением (с перитектическим превращением)
- •2.7 Диаграмма состояния с ограниченной растворимостью в жидком состоянии (с монотектическим превращением)
- •2.8 Твердые растворы
- •2.8.1 Диаграмма состояния с полной растворимостью в жидком и твердом состоянии
- •2.8.2 Диаграмма состояния с ограниченной растворимостью в твердом виде
- •1. Диаграммы с эвтектическим превращением
- •2. Диаграмма с перитектическим превращением
- •2.8.3 Примеры разбора диаграмм
- •2.8.4 Вопросы для самоконтроля
- •Литература
1.3.3 Выражение состава равновесной смеси
Состав равновесной смеси можно выразить, используя:
а) степень диссоциации ()
б) степень превращения ()
в) выход продукта (х)
Рассмотрим на примерах все эти случаи:
а) по степени диссоциации
Степень диссоциации () – это доля продиссоциировавших молекул от исходного числа молекул. Ее можно выразить через количество вещества
![]() , (1.20)
, (1.20)
где nдисс – число распавшихся молей исходного вещества;n исх – число молей исходного вещества до реакции.
Пусть до реакции было, например, 5 моль NO2, а α – степень диссоциации NO2.

По уравнению (1.20)
![]() ,
непрореагировавшим NO2
останется (5 – 5).
,
непрореагировавшим NO2
останется (5 – 5).
По уравнению
реакции при диссоциации 2 молей NO
2
получается 2 моля NO
и 1 моль O2,
а из 5
получается соответственно 5
молей NO
и
![]() молей
О2.
Равновесная строчка будет такой:
молей
О2.
Равновесная строчка будет такой:

б) по степени превращения
Степень превращения вещества () – это доля прореагировавших молекул данного веществa к исходному числу молекул этого вещества. Выражаем через количество вещества в молях
![]() (1.21)
(1.21)
Пусть взято 2 моля СО и 2 моля Н2, - степень превращения водорода в реакции
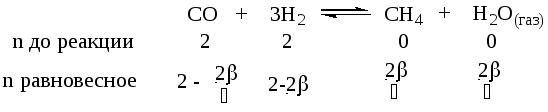
Поясним равновесную строчку. Исходим из вещества, для которого известна степень превращения, т. е. Н2. Из уравнения (1.21) получаем nреаг= nисх· = 2 .
Из стехиометрического
уравнения видно, что СО расходуется в
3 раза меньше, чем Н2,
то есть если Н2
реагирует 2,
то СО прореагирует![]() ,
а остальное останется к моменту равновесия
не прореагировавшим. Также рассуждаем
в отношении продуктов, используя
стехиометрическое уравнение.
,
а остальное останется к моменту равновесия
не прореагировавшим. Также рассуждаем
в отношении продуктов, используя
стехиометрическое уравнение.
в) по выходу продукта.
Выход продукта (х) – количество конечного вещества в молях. Пусть "х" выход метанола в реакции

в

 о
всех трех случаях рассуждения аналогичны
и исходят из вещества, для которого
что-либо известно (в примерах эта величина
подчеркнута).
о
всех трех случаях рассуждения аналогичны
и исходят из вещества, для которого
что-либо известно (в примерах эта величина
подчеркнута).
Зная состав равновесной смеси, можно выразить константу равновесия. Так, для случая "в"
![]() а из уравнения
(1.19)
а из уравнения
(1.19)
![]()
![]()
Выход вещества в долях (или %) – отношение количества образовавшегося продукта к общему количеству вещества в равновесной смеси:
![]()
В данном примере:
![]()
1.3.4 Влияние различных факторов на смещение равновесия (на состав равновесной смеси)
Влияние давления (или объема) при Т= const
Если система является идеальной, то константа равновесия Кр не зависит от давления (или объема). Если же реакция идет при высоких давлениях, то надо пользоваться уравнением:
 , (1.22)
, (1.22)
где f – фугитивность.
K f
не зависит
от давления, величина же Kp
от давления зависит, но по мере уменьшения
давления приближается к величине Кf,
поскольку реальная газовая смесь
приближается к идеальному состоянию,
f
p.
Так, для
реакции:
f
не зависит
от давления, величина же Kp
от давления зависит, но по мере уменьшения
давления приближается к величине Кf,
поскольку реальная газовая смесь
приближается к идеальному состоянию,
f
p.
Так, для
реакции:
![]()

при 350 атм Kf = 0,00011 KР = 0,00037
При невысоких
давлениях можно считать КР
не
зависящей от давления, то есть
![]() .
В дальнейшем будем рассматривать именно
этот случай.
.
В дальнейшем будем рассматривать именно
этот случай.
Из соотношения
(1.12) видно, что величины
![]() ,
,
![]() будут зависеть от давления, поэтому, не
влияя на константу равновесия
будут зависеть от давления, поэтому, не
влияя на константу равновесия
![]() ,
изменение давления может влиять на
состав равновесной смеси, на выход
продуктов.
,
изменение давления может влиять на
состав равновесной смеси, на выход
продуктов.
![]()

![]() (1.23)
(1.23)
Уравнение (1.23)
показывает, что влияние давления на
![]() обусловлено величинойn:
обусловлено величинойn:
n 0, реакция идет с увеличением числа молей газообразных продуктов, например:
![]()
n = 1
![]() ,
то есть при повышении общего давления
Кх
уменьшается, уменьшается и количество
продуктов в равновесной смеси, то есть
равновесие смещается влево, в сторону
образования COCl2.
,
то есть при повышении общего давления
Кх
уменьшается, уменьшается и количество
продуктов в равновесной смеси, то есть
равновесие смещается влево, в сторону
образования COCl2.
 n
0
n
0
n = 0-2-1= -3
![]() ,
то есть с увеличением давления Kx
(и выход продукта) увеличивается.
,
то есть с увеличением давления Kx
(и выход продукта) увеличивается.
n = 0
![]()
K![]() =
K
=
K![]() = const.
В данном случае состав равновесной
смеси не зависит от давления.
= const.
В данном случае состав равновесной
смеси не зависит от давления.
Добавление инертного газа при Р = const влияет на смещение равновесия аналогично уменьшению давления. Инертным газом в химическом равновесии считаются газы, не взаимодействующие с реагентами или продуктами реакции.
Увеличение объема при постоянном давлении влияет на смещение равновесия аналогично уменьшению давления.
Влияние соотношения между компонентами
На состав равновесной смеси оказывает влияние и соотношение взятых для реакции реагентов.
Наибольший выход продуктов будет при стехиометрическом соотношении. Так для реакции
![]()
соотношение водорода и азота 3:1 даст наибольший выход аммиака.
В ряде случаев необходима высокая степень превращения одного из реагентов даже в ущерб выходу продукта.
Например, при образовании хлористого водорода по реакции
![]()
необходимо более полное превращение хлора, чтобы в равновесной смеси было как можно меньше Cl2. Равновесная смесь растворяется в воде и таким образом получается соляная кислота. При этом водород почти не растворяется в воде и не содержится в кислоте, в то время как свободный хлор растворяется и ухудшается качество соляной кислоты.
Для достижения максимальной степени превращения Cl2 берут второй реагент, Н2, в большом избытке.
Увеличение степени превращения обоих компонентов можно добиться, если выводить из реакционной зоны продукты реакции, связывая их в малодиссоциирующие, труднорастворимые или нелетучие вещества.
Влияние температуры на равновесие
Опыт показывает, что температура оказывает большое влияние на состав равновесной смеси, в одних реакциях увеличивая содержание продуктов реакции, в других - уменьшая. Количественно эта зависимость отражается уравнениями изобары (1.24) и изохоры (1.25) Вант-Гоффа:
![]() (1.24)
(1.24) ![]() (1.25)
(1.25)
Из этих уравнений видно, что изменение константы равновесия при увеличении температуры (а значит и изменение выхода продукта реакции) определяется знаком теплового эффекта H и U:
H0 или U0 - реакция эндотермическая (с поглощением тепла). Правые части уравнений больше нуля, это означает, что и производные больше нуля:
![]() > 0;
> 0;
![]() > 0
> 0
Таким образом, функции lnKp и lnKc (а также Kp и Kc) увеличиваются с ростом температуры.
|
|
|
H0 или U0 - реакция экзотермическая (с выделением тепла).
![]() < 0;
< 0;
![]() < 0
< 0
Константа равновесия убывает с ростом температуры, т.е. убывает содержание продуктов реакции в равновесной смеси, а увеличивается содержание исходных веществ.
Таким образом, повышение температуры способствует более полному протеканию эндотермических процессов. Проинтегрируем уравнение изобары.
Пусть Hf(Т) разделим переменные и интегрируем,
![]()
![]()
![]() ;
;
![]()
![]() (1.26)
(1.26)
Как видим, константа
равновесия зависит от температуры по
экспоненциальному закону:
![]() ,
а в координатах ln
K
= f(
,
а в координатах ln
K
= f(![]() )
зависимость линейная (уравнение 1.26,
рисунок 1.7)
)
зависимость линейная (уравнение 1.26,
рисунок 1.7)
|
|
|
Рисунок 1.7 – Температурная зависимость константы равновесия
Определенное интегрирование уравнения изобары дает:
![]() (1.27)
(1.27)
Зная величину константы равновесия при одной какой-либо температуре, можно найти Кр при любой другой при известном значении H.


