
- •Министерство образования и науки
- •Предисловие авторов
- •Содержание
- •1 Химическая термодинамика
- •1.1 Первое начало термодинамики
- •1.1.1 Основные понятия и определения
- •1.1.2 Первое начало термодинамики
- •1.1.3 Теплоемкость
- •1.1.4 Работа и теплота термодинамических процессов
- •1.1.5 Типы тепловых эффектов
- •1.1.6 Способы определения тепловых эффектов при постоянной температуре
- •1.1.7 Зависимость теплового эффекта реакции от температуры
- •1.1.8 Примеры решения задач
- •1.1.9 Вопросы для самоконтроля
- •1.2 Второе начало термодинамики
- •1.2.1 Основные понятия и определения
- •1.2.2 Математическое выражение
- •1.2.3 Изменение энтропии как критерий обратимости и необратимости процессов
- •1.2.4 Критерии направленности процессов в реальных системах
- •1.2.5 Расчет изменения энтропии в различных процессах
- •1.2.6 Фугитивность и коэффициент фугитивности реальных газов
- •1.2.7 Химический потенциал идеального и реального газа
- •1.2.8 Примеры решения задач
- •1.2.9 Вопросы для самоконтроля
- •1.3 Химическое равновесие
- •1.3.1 Закон действующих масс
- •1.3.2 Способы выражения константы равновесия
- •1.3.3 Выражение состава равновесной смеси
- •1.3.4 Влияние различных факторов на смещение равновесия (на состав равновесной смеси)
- •1.3.5 Мера химического сродства. Направление самопроизвольного протекания химической реакции
- •1.3.6 Методы определения константы равновесия при различной температуре (из справочных данных)
- •1. Из термодинамических свойств веществ:
- •4. Из логарифмов констант равновесия реакций образования некоторых веществ, lgKaf.
- •1.3.7 Примеры решения задач
- •1.3.8 Вопросы для самоконтроля
- •2 Фазовые равновесия
- •2.1 Основные понятия и определения
- •2.2 Однокомпонентные системы
- •2.3 Примеры решения задач
- •2.4 Вопросы для самоконтроля
- •2.5 Двухкомпонентные системы
- •2.5.1 Термический анализ как часть физико-химического анализа
- •2.5.2 Равновесие раствор – кристаллический компонент
- •2.5.3 Кривые охлаждения
- •2.5.4 Диаграмма плавкости двухкомпонентной системы с простой эвтектикой
- •2.6 Диаграммы состояния с образованием химического соединения
- •2.6.1 Определение состава фаз и относительного количества фаз
- •2.6.2 Диаграмма состояния системы с устойчивым химическим соединением
- •2.6.3 Диаграмма состояния системы с неустойчивым химическим соединением (с перитектическим превращением)
- •2.7 Диаграмма состояния с ограниченной растворимостью в жидком состоянии (с монотектическим превращением)
- •2.8 Твердые растворы
- •2.8.1 Диаграмма состояния с полной растворимостью в жидком и твердом состоянии
- •2.8.2 Диаграмма состояния с ограниченной растворимостью в твердом виде
- •1. Диаграммы с эвтектическим превращением
- •2. Диаграмма с перитектическим превращением
- •2.8.3 Примеры разбора диаграмм
- •2.8.4 Вопросы для самоконтроля
- •Литература
1.3 Химическое равновесие
1.3.1 Закон действующих масс
Все химические реакции в той или иной мере обратимы, то есть не идут до конца, до полного превращения исходных веществ, в продукты. В реакционной смеси всегда происходит как прямая, так и обратная реакции. По мере расходования исходных веществ, скорость прямой реакции уменьшается; по мере накопления продуктов возрастает скорость обратной реакции. Когда обе скорости сравняются, установится динамическое равновесие, постоянно происходит образование продуктов и исходных веществ, при этом концентрации и исходных веществ и продуктов при данных условиях не меняются со временем. Подобное равновесие называется химическим равновесием.
Рассмотрим газофазную реакцию
![]()
Химическое равновесие этой реакции наступает тогда, когда соотношение
 (1.16)
(1.16)
достигает определенной величины, характерной для данной реакции при данной температуре. Эта величина называется константой химического равновесия, а выражение (1.16) – законом действующих масс.
Константа равновесия связывает количества всех веществ, участвующих в реакции, и нельзя изменить количество ни одного из них, чтобы это не повлекло за собой соответствующего изменения количества веществ, других участников реакции, что непременно приведет к прежнему численному значению константы равновесия. Таково содержание закона действия масс.
Численное значение константы равновесия при данной температуре не меняется с изменением исходных давлений или концентраций реагирующих веществ. Величина константы равновесия не зависит от того, какие из веществ, участвующих в реакции, взяты в качестве исходных веществ, и в каких соотношениях они введены в реакцию.
Если в реакции участвуют жидкие или твердые вещества, не образующие растворов друг с другом, то при данной температуре парциальные давления этих конденсированных участников реакции являются постоянными. Эти постоянные величины вводятся в константу равновесия. Таким образом, при записи константы равновесия учитываются только газообразные участники реакции. Так, в реакции термической диссоциации карбоната кальция по уравнению
![]()
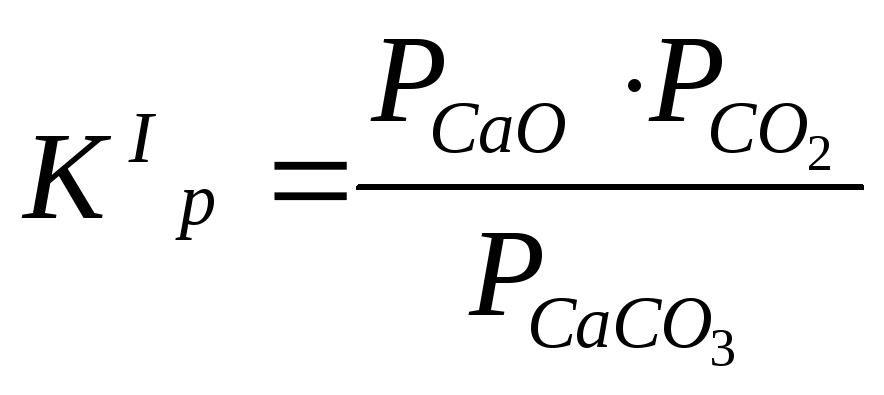
Но, поскольку
![]() ,
,![]() ,
то
,
то![]()
1.3.2 Способы выражения константы равновесия
Константа равновесия
может быть выражена не только через
равновесные парциальные давления
(1.16), но и через равновесные концентрации
![]() ,
через количество вещества (ni,
моль), через
молярные доли
,
через количество вещества (ni,
моль), через
молярные доли![]() :
:



Все эти константы равновесия не равны, а пропорциональны друг другу. Покажем, как они связаны между собой. Из уравнения состояния идеального газа РV = nRТ
![]() (1.17)
(1.17)
Подставим значения Рi из уравнения (1.17) в соотношение (1.16):


Выражая значения парциальных давлений через общее, получаем
![]() (1.18)
(1.18)
Подставляя выражение (1.18) в соотношение (1.16), находим
![]()
Таким образом
![]() (1.19)
(1.19)
Если газофазная реакция идет без изменения числа молей, то n=0,тогда Kp=Kc=Kn=KХ=К
В случае реальных газов вместо давления используется фугитивность, f, и

Приведенные выше константы равновесия, полученные из экспериментальных значений Р, С, Х, n, f в момент равновесия, могут быть названы эмпирическими. Они имеют соответствующую размерность:
КР и Кf [давлениеΔn]; Кn [мольΔn] и т.д.
где Δn = nкон. – nнач. – разность числа молей газообразных конечных и исходных веществ в реакции.
В закон действующих масс может быть подставлена активность.
Активность газа – отношение фугитивности в данном состоянии к стандартной фугитивности при одной и той же температуре:
![]()

Эта величина называется термодинамической константой равновесия и является безразмерной величиной.
Если реакция протекает в растворе (без участия газообразных или твердых веществ), то закон действия масс выражается через концентрации (если раствор идеален) или через активности (для реального раствора): КС и Ка.
