
диссертации / 17
.pdf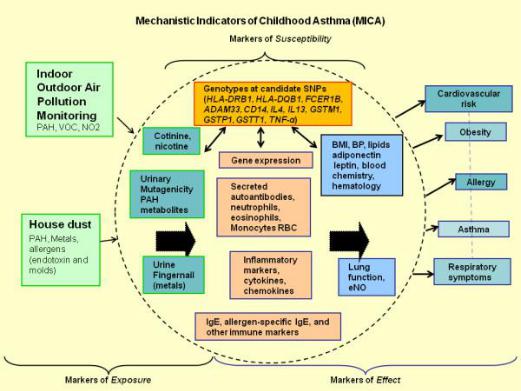
61
БА пока не ясны. Тем не менее анализ ген-средовых взаимоотношений показыва-
ет, что один и тот же полиморфизм может обладать как протективным эффектом,
так и быть фактором риска в отношении развития БА и родственных фенотипов под влиянием факторов внешней среды [105]. К внешним факторам риска разви-
тия БА относят воздействие аллергенов, ОРВИ, характер питания, курение, про-
мышленные химические вещества, социально-экономический статус семьи (рис.
3) [79, 80, 188].
Для моделирования ген-средовых взаимодействий используют в основном метод логистической регрессии.
Рис. 3. Схема ген-средовых взаимодействий в развитии бронхиальной астмы (по
Gallagher J., Hudgens E., Williams A. et al., 2011) [188].
По данным исследования трендов ISAAC показано увеличение распростра-
ненности астмы в последние десятилетия в странах с высоким социально-
экономическим уровнем, которое не может быть объяснено изменением генетиче-
ской составляющей за такой короткий промежуток времени с эволюционной точ-
ки зрения; в Европе и Северной Америке указывают на ключевую роль окружаю-
62
щей среды. Замечено, что дети и взрослые на животноводческих фермах имели более низкую распространённость астмы, поллиноза и повышенных уровней спе-
цифических IgE к местным аллергенам, чем городские жители [183, 325, 326, 377]. Известно, что воздействие высоких уровней микробных агентов, таких как эндотоксина в сельской местности (на ферме) снижает риск развития атопической астма, поллиноза и атопической сенсибилизации у детей школьного возраста
[151]. Генетическая изменчивость генов врожденного иммунитета может модули-
ровать ответ на микробные агенты и таким образом влиять на предрасположен-
ность к астме и атопии.
В ходе изучения связи между SNP гена CD14, Toll-подобного рецептора 2
(TLR2) и TLR4 генов, атопии и дебюта астмы у молодых датских фермеров, кото-
рые родились и выросли на ферме, было показано, что CD14 (-260T) аллель обла-
дал протективным эффектом к развитию атопии (ОШ=0,39; 95%ДИ [0,2-0,7]), то-
гда как аллель CD14 (-651T) ассоциировался с повышенным риском развития ато-
пии (ОШ=2,53; 95%ДИ [1,3-4,8]). Не выявлено взаимодействий генов CD14 х TLR2 х TLR4 и развития астмы [349].
Толл-подобные рецепторы (TLR) представляют собой эволюционно консер-
вативные семейства рецепторов врожденного иммунитета микробной молекулы и играют роль лигандов. Австрийские и немецкие дети фермеров с аллелем Т гена
TLR2 (-16934), по сравнению с детьми, имеющими генотип АА, реже болели БА
(3% против 13%; p=0,012), имели симптомы текущей астмы (3% против 16%; p=0,004), атопической сенсибилизации (14% против 27%; p=0,023), а также теку-
щие симптомы поллиноза (3% против 14%; p=0,01). Связь между TLR2 (-16934) и
астмой среди детей фермеров не зависела от атопии. Исследователи показали, что генетическое изменение в гене TLR2 является основным фактором, определяю-
щим предрасположенность к астме и аллергии у детей фермеров [179].
Проведено проспективное исследование в течение 12 месяцев у детей пас-
сивных курильщиков в домашних условиях. Оценено воздействие окружающей среды (воздействие табака, бытовых аллергенов, твердых частиц в воздухе) на по-
лиморфизм генов NOS1 и NOS3 (G894T) и уровень оксида азота (FeNO). Не уста-
63
новлено ассоциации NOS1 и NOS3 полиморфизмов, а также экологических воз-
действий с уровнем FeNO. Определено взаимодействие NOS3 и концентрации ни-
котина с уровнями FeNO (р=0,01). Среди детей с гомозиготным генотипом GG
никотин не влиял на уровень FeNO, однако среди лиц с аллелем Т гена NOS3, при повышении никотина уровень FeNO снижался [350].
Типичным примером ген-средового взаимодействия, лежащего в основе мультифакториального заболевания, является влияние пассивного курения. В
группе детей, больных БА, имеющих контакт с табачным дымом, мутантный ге-
нотип 139RR гена EPHX1, был ассоциирован более чем с 9-кратным увеличением риска развития астмы (ОШ=9,09; 95%ДИ [1,1–72,8], p=0,03). Кроме того, в этой же группе выявлена ассоциация гетерозиготного генотипа 105IV гена GSTP1 с
повышенным риском развития БА (ОШ=2,10; 95%ДИ [1,1–4,0], p=0,02) [47].
По данным Wu H., Romieu I., Sienra-Monge J.J. и соавт. (2007) у мексикан-
ских детей определена ассоциация минорного аллеля А TNFA (-308G>A) с риском развития заболевания (ОР=1,54; 95%ДИ [1,0-2,3]), в том числе у некурящих боль-
ных с аллелем А и гетерозиготным генотипом GA TNFA (-308G>A) относитель-
ный риск развития БА составил ОР=2,1; 95%ДИ [1,2-3,6], у подверженных пас-
сивному курению не установлено ассоциации с риском развития заболевания
[394].
У курящих больных БА из Бельгии и Китая не выявлено ассоциации гена
TNFA (-308G>A) с развитием БА [271, 276].
Ляхович В.В. и соавт. (2002) показали ассоциацию GSTM1*0/0 с ранним развитием БА у пассивных курильщиков ОШ=9,0 [1,1-409,9] [64]. У детей, пас-
сивных курильщиков, с генотипов GSTM1*0/0 также выявлена ассоциация с раз-
витием БА (ОШ=5,5; 95%ДИ [1,6-18,6]), симптомами астмы в течение жизни
(ОШ=2,8; 95%ДИ [1,3-6,0]), текущими свистящими хрипами (ОШ=4,7; 95%ДИ
[1,8-12,6]) и одышкой (ОШ=8,9, 95%ДИ [2,1-38,4]). У детей из Калифорнии
(n=2950) генотип GSTM1*0/0 был ассоциирован с внутриутробным воздействием табака и ранним началом астмы (ОШ=1,6; 95%ДИ [1,0-2,5]); текущими симпто-
мами астмы (ОШ=1,7; 95%ДИ [1,1-2,8]), персистирующей астмой (ОШ=1,6;
64
95%ДИ [1,1-2,4]), одышкой при физической нагрузке (ОШ=2,1; 95%ДИ [1,3-3,3]),
свистящим дыханием, требующим назначения лекарств (ОШ=2,2; 95%ДИ [1,4- 3,4]) и неотложной терапии за прошедшие 12 месяцев (ОШ=3,7; 95%ДИ [1,9-7,3]) [195]. В тоже время не получено ассоциации GSTM1*0/0 у тайваньских школьни-
ков пассивных курильщиков со свистящим дыханием [263]. Выявлена взаимо-
связь GSTM1*0/0 с риском возникновения БА у взрослых (ОШ=1,56; 95%ДИ [1,3- 1,9]) и у некурящих (ОШ=1,95; 95%ДИ [1,2-3,1]). В то же время по данным мета-
анализа Saadat M., Ansari-Lari M. (2007) ассоциации GSTM1*0/0 с курением не установлено [335].
Длительное курение приводит к подавлению β2-АР и снижению их плотно-
сти на поверхности лимфоцитов, уменьшению образования цАМФ и нарушению ответа на катехоламины. При прекращении курения через 8 недель плотность ад-
ренорецепторов восстанавливается и достигает уровня у некурящих [251].
Ежедневное курение у гомозигот (Arg-16) ассоциировано с повышенным риском БА у китайских больных (ОШ=57,81; 95%ДИ [2,1-29,5]). Ассоциации
(Gln27Glu) гена ADRB2 с курением не установлено [383].
В когортном исследовании у детей пассивных курильщиков гомозигот
Arg16Arg, подверженных табакокурению внутриутробно, в 3 раза чаще отмеча-
лось свистящее дыхание; ночные симптомы и текущие хрипы. Ассоциации гено-
типов Glu27Gln и Gly16Arg гена ADRB2 с пассивным курением не найдено [379].
Среди детей, подверженных воздействию табачного дыма, с аллелем Arg16
и гомозигот Arg16/Arg16 показатели ОФВ1 (2,19 против 2,38 л) и ФЖЕЛ (2,43
против 2,64 л) были ниже, чем у Gly16 гомозигот. Лица с аллелем Gln27 и гомо-
зиготы Gln27/Gln27 также имели более низкий ОФВ1 по отношению к гомозиго-
там Glu2/Glu27 (2,24 против 2,39 л). Неэкспонированные к табаку дети с Arg16
или Gln27 демонстрировали более низкий уровень NO по сравнению с Gly16 го-
мозиготами (15,4 ppm по сравнению 30,9 ppm) и Glu27 гомозиготами (18,0 ppm
по сравнению с 49,7 ppm) [409].
Показана взаимосвязь пассивного курения у больных БА c rs2305480 гена
GSDMB [148, 185], в том числе внутриутробно и в раннем возрасте [375].
65
Таким образом, несмотря на многочисленные генетические исследования,
проведенные в различных этнических группах, сведения носят весьма противоре-
чивый характер. Это явилось обоснованием для изучения роли в формировании БА, связи с клинико-лабораторными показателями, полиморфных вариантов ге-
нов-кандидатов БА (FCER2 (T2206C), TNFA (-308G>A), GSTM1 del, NOS2А
(CCTTT)n, NOS3 (VNTR), ADRB2 (Arg16Gly) и ADRB2 (Gln27Glu), rs7216389 и rs2305480 GSDMB) и генов-кандидатов никотиновой зависимости (THOI (STR), rs16969968 CHRNA5), их межгенных и ген-средовых взаимодействий в различных этнических группах.
66
ГЛАВА 2. ХАРАКТЕРИСТИКА НАБЛЮДАЕМЫХ ПОДРОСТКОВ,
ОБЪЁМ И МЕТОДЫ ИССЛЕДОВАНИЯ
Решение поставленных задач по набору материала осуществлялось на базе ЛПУ АБО Забайкальского края: ГУЗ «Могойтуйская ЦРБ» (гл. врач - Базаржапова Т.Р.), ГУЗ «Агинская окружная больница» (гл. врач - Цыренов Ц.Б.), ГУЗ «Дульдургинская ЦРБ» (гл. врач - Жамсаранов Ц.Д.); отделения пульмонологии ГУЗ «Краевая детская клиническая больница №2» г. Читы (гл. врач - Коновалов Н.Н.); клинической лаборатории ГУЗ «Краевой детский консультативно-
диагностический центр» г. Читы (зав. лаб. - Огнева Е.Ю.); и в лаборатории генетической эпидемиологии (рук. – д.м.н., профессор Зинченко Р.А.) ФГБУ «Меди- ко-генетический научный центр» РАМН (директор - академик РАМН, д.б.н., профессор Гинтер Е.К.).
Исследования выполнены под эгидой и непосредственной курацией Детского научно-практического пульмонологического центра Минздрава РФ (рук. – д.м.н., проф. Ю.Л.Мизерницкий) и с одобрения Этического комитета.
2.1 Этническая характеристика Агинского бурятского округа
Забайкальского края
Забайкальский край расположен в Восточной Сибири, граничит с Амурской и Иркутской областями, республиками Бурятия и Якутия, имеет внешнюю границу с Китаем и Монголией. Агинский Бурятский округ (АБО) Забайкальского края, состоит из трех административных районов (Могойтуйского, Агинского, Дульдургинского). Площадь территории округа 19,6 тыс. м2. Численность населения округа — 76,4 тыс. человек, из которых около 22 тыс. детей и подростков. Население представлено в основном бурятами (63%) и русскими (35%). В округе располагается 50 общеобразовательных средних школ.
Буряты - коренное население Республики Бурятия, Усть-Ордынского Бурятского округа Иркутской области и Агинского Бурятского округа Забайкальского края. Антропологически буряты - типичные представители центрально-азиатского типа монголоидов, у бурятов северных районов Бурятии заметна примесь байкальского типа сибирской, или североазиатской, монголоидной расы [28]. Буряты
67
делятся на западных (прибайкальских), и восточных (забайкальских). Среди бурят выделяются следующие субэтнические группы, имеющие отличие по антрополо-
гическим и этногенетическим признакам: хоринцы, эхириты, булагаты, тункинцы,
хонгодоры, селенгинские буряты [1, 28]. АБО охватывает земли исторически сложившегося расселения одной из ветвей Забайкальских (хоринских) бурят в Агинских степях.
Первое упоминание о селении связано с тем временем, когда представители восьми родов хоринских бурят из Прибайкалья в XVII веке отделились и переко-
чевали в Агинскую степь, в долины рек Ингода, Ага, Онон. Постепенно большая часть их сосредоточилась в долине реки Ага, богатой пастбищами. История окру-
га с XVII века связана с Россией. В 1648 году агинские буряты приняли россий-
ское подданство — с этого времени началось интенсивное заселение региона рус-
скими, главным образом казаками Забайкальского казачьего войска. Сложилось комплексное скотоводческо-земледельческое хозяйство, при этом традиции ско-
товодческого хозяйства и кочевого быта, несмотря на увеличение роли земледе-
лия, оставили в культуре бурят значительный след. Бурятский язык относится к монгольской группе алтайской языковой семьи. Основной религией бурят являет-
ся ламаизм - ветвь буддизма, проникшая к бурятам через Монголию в XVII веке.
2.2. Организация эпидемиологического исследования («ISAAC») и та-
бакокурения среди подростков, общая характеристика обследованных групп подростков, клинико-функциональных и лабораторных методов исследова-
ния
Эпидемиологические исследования выполнены в сельской местности Агин-
ского Бурятского округа (АБО) Забайкальского края. Даные об этнической при-
надлежности подростков выясняли путем опроса, включая указания на нацио-
нальную принадлежность предков до III-V поколения, проживающих в данном регионе.
Для изучения распространенности симптомов бронхиальной астмы у под-
ростков использован протокол программы стандартизированных эпидемиологи-
68
ческих исследований аллергических заболеваний у детей - International Study of Asthma and Allergy in Children («ISAAC» в России) [222], включавший 3 фазы:
I фаза - анкетирование репрезентативных групп детского населения (см.
прил.1),
II фаза - уточнение диагноза на основе углубленного обследования лиц, по-
дозрительных на наличие заболевания по результатам анкетирования в I фазе.
III фаза предусматривает повторение I-II фаз после 3-летнего перерыва для определения тренда распространенности заболевания и отдельных его симптомов.
По регламенту исследования ISAAC анкетирование детей проводится в возрасте
13–14 лет, считающимся периодом окончания детства [Стандартизированные эпидемиологические исследования аллергических заболеваний у детей. Адапта-
ция программы "Международное исследование астмы и аллергии у детей
("ISAAC")" в России, 1998] [100, 222].
Исследование проведено у подростков в возрасте 12-18 лет в общеобразова-
тельных средних школах АБО Забайкальского края в 2005 г. (n=2104) и в 2008 г.
(n=2288). Из исследования исключено незначительное число подростков других национальностей. Распределение по национальному составу проанкетированных подростков представлено в таблице 8. Соотношение буряты / русские в представ-
ленной выборке составило 2,7:1.
Таблица 8. Национальный состав проанкетированных подростков (n=4092)
Нацио- |
|
|
|
Учебный год |
|
|
|
|
наль- |
|
2005-2006 гг. |
|
2008-2009 гг. |
||||
ность |
Всего |
|
Юноши |
Девушки |
Всего |
|
Юноши |
Девушки |
Буряты |
1511 |
|
726 |
785 |
1482 |
|
729 |
753 |
|
(73,9%) |
|
(48,4%) |
(51,6%) |
(72,4%) |
|
(49,2%) |
(50,8%) |
Русские |
533 |
|
268 |
265 |
566 |
|
269 |
297 |
|
(26,1%) |
|
(50,3%) |
(49,7%) |
(27,6%) |
|
(47,5%) |
(52,5%) |
Итого |
2044 |
|
994 |
1050 |
2048 |
|
998 |
1050 |
|
(100%) |
|
(48,6%) |
(51,4%) |
(100%) |
|
(48,7%) |
(51,3%) |
69
Использованы также статистические материалы областного комитета здра-
воохранения с 2005-2008 годы, данные МЗСР РФ о заболеваемости населения России в 2005 и в 2008 году.
Первый этап обследования включал анкетный скрининг с использованием вопросника ISAAC (исследования выполнены с участием Сабуровой Т.В.).
Для второго этапа (клинико-функционального и аллергологического обсле-
дования) были отобраны 130 подростков, у которых в анкете было отмечено наличие астмоподобных симптомов за последние 12 мес.
Общая характеристика обследованных групп подростков, клинико-
функциональных и лабораторных методов исследования
Диагноз БА установлен у 62 подростков (40 бурят и 22 русских) в 2005 г.
Бронхиальная астма легкой степени тяжести диагностирована у 46 (74,2%) (32 бу-
рят и 14 русских), средней степени тяжести - у 13 (21%) (7 бурят и 6 русских), тя-
желая - у 3 (4,8%) (1 бурятки и 2 русских). У половины подростков (у 31, т.е. 50%)
БА сочеталась с аллергическим ринитом, у 3 - с атопическим дерматитом, у 8 -
отмечено сочетание БА, аллергического ринита и атопического дерматита.
На третьем этапе через 3 года (в 2008 г.) для сравнения в динамике 2 первых этапа исследования были полностью повторены. Диагноз БА был подтверждён у
119 подростков (79 бурят и 40 русских). В 2008 г бронхиальная астма легкой сте-
пени тяжести была установлена у 110 (92,4%) (74 бурят и 36 русских), средней степени тяжести - у 9 (6,9%) (4 русских, 5 бурят). У 58 (у 49,1%) подростков БА сочеталась с аллергическим ринитом, у 4 - отмечено сочетание БА, аллергическо-
го ринита и атопического дерматита.
Клиническая верификация диагноза и купирование обострений БА проводились в соответствии с положениями Национальной программы
«Бронхиальная астма у детей. Стратегия лечения и профилактика» (2008) и
Классификацией клинических форм бронхолегочных заболеваний у детей (2009).
Диагноз ОРИ устанавливался в соответствии с положениями Научно-
практических программ «ОРЗ у детей: лечение и профилактика» (2002) [78].
70
Оценка влияния табакокурения на течение бронхиальной астмы. Ди-
зайн сравнительного эпидемиологического исследования основывался на принци-
пе опыт-контроль (по отношению к курению). Контрольную группу составили -
некурящие больные БА (56), а опытную – курящие подростки с БА (63).
Критерием включения были подростки, проживающие в сельской местности, больные БА, с установленным в ходе эпидемиологического исследования в 2008-2009 году диагнозом (119).
Для оценки распространенности табакокурения и респираторных симпто-
мов и выявления наиболее значимых факторов риска среди больных БА, прожи-
вающих в сельской местности АБО Забайкальского края в 2008 году применили модифицированный нами анкетный скрининг на основе: глобального опросника подростков по табакокурению [5], Burden of major Respiratory diseases who survey (ВОЗ) [84], ISSAC [100] (см. прил.2). Оценка статуса курения проводилась в соот-
ветствии с методическими рекомендациями «Практического руководства по ле-
чению табачной зависимости» и включала: оценку курения как фактора риска развития заболевания, степени никотиновой зависимости с помощью теста Фа-
герстрема, степени мотивации бросить курить, мотивации курения [109]. Индекс курящего человека (ИКЧ) вычисляется по формуле: количество выкуренных в день сигарет × 12 (число месяцев в году, которые человек курил). Степень нико-
тиновой зависимости оценивалась по тесту Фагерстрема (0-2 балла – очень слабая зависимость, 3-4 –слабая зависимость, 5 баллов – средняя зависимость, 6-7 баллов высокая зависимость, 8-10 баллов – очень высокая зависимость). Степень мотива-
ции бросить курить оценивали по сумме баллов (более 6 – высокая мотивация к отказу от курения, от 4 до 6 - слабая мотивация, ниже 3 баллов - отсутствие моти-
вации); аналогично оценивали мотивацию к курению (слабая мотивация – до 7
баллов, средняя мотивация -7-11 баллов, сильная мотивация – выше 11 баллов) (см. прил.3).
Оценивали возраст начала вовлечения в курение, стаж курения, количество выкуриваемых сигарет. Показатель «пачка/лет» у ежедневных курильщиков рассчитывали по формуле: число сигарет, выкуриваемых в день × количество лет
