
Борман Физическая кинетика атомных процессов в наноструктурах 2011
.pdf3.Robert M. Mazo Brownian Motion:Fluctuations, Dynamics, and Applications, Oxford, 2008.
4.Hess W., Phys J. A: Math. Gen, v.14, (1981) pp. 145−150.
5.B.U. Felderhof J.Phys,A: Math.Gen,v11,(1978) pp. 929−937.
6.Tough R.J., Pusey P.N. Molecular Phys, 1986, v. 59, pp. 595−619.
7.Балеску Р., Равновесная и неравновесная статистическая механика.
Ч1,Ч 2, М.: Мир, 1978.
8.Климонтович Ю.Л., Статистическая физика, М.: Наука, 1982.
9.Rex M., Lowen H. Phys. Rev. Lett, v. 101, p. 148302(2008).
10.Hopkins P., Fortini A. at.al. J. Chem Phys, v. 133, p. 224505(2010).
11.Ходель В.Л., Шагинян В.Р.//Ядерная физика. 1987. Т. 46. С. 2032, Ходель В.А., Шагинян В.Р. //Ядерная физика. 1989. Т. 49. С. 52.
12.Девятко Ю.Н., Тронин В.Н. // ЖЭТФ, 98, 1570 (1990).
13.Caroli C., Roulet B., Saint-James D. Phys Rev, v. 10, N 2, p. 545(1978).
14.Ландау Л.Д., Лифшиц Е.М., Статистическая физика. Ч. 1, М.: Нау-
ка, 1980.
15.Voskresensky D.N. // Physica Scripta. 1984. V. 29. P. 259.
16.Фейнман Р. Статистическая механика, М.: Мир, 1975.
191
Глава 7
Кинетика образования нанослойного оксида SiO2 на поверхности кристалла кремния
Введение
Известно [1−8], что взаимодействие кислорода с поверхностями большинства металлов и полупроводников в субмонослойных покрытиях состоит из двух стадий. Первая стадия связана с адсорбцией кислорода. На второй стадии, по достижении критического
покрытия кислородом θca , происходит образование зародыша и
рост кластеров оксида и формирование монослоя оксида. Критическое покрытие связано с существованием критического давления
( pс) кислорода. Если p < pс , то критическое покрытие θca не достигается и окисления не происходит. При p < pс имеет место про-
тивоположный случай, приводящий к окислению поверхности. Критическое давление зависит от температуры поверхности, поэтому можно говорить о существовании критической температуры поверхности, выше которой начинается ее окисление в условиях постоянного давления кислорода над окисляемой поверхностью. Экспериментальные результаты [5, 8, 10−12] по кинетике началь-
ного роста оксида вдали от критического точки (θ > θca, p > pc, T <Tc) описаны в рамках феноменологических теорий фа-
зовых переходов первого рода [9, 10, 13, 14]. Однако в рамках теории зародышеобразования, вблизи критической концентрации ада-
томов кислорода θca , критический радиус Rс стремится к бесконечности, а скорость образования зародышей, которая зависит от Rс как Rc−1, стремится к нулю, блокируя формирование оксида. Несмотря на попытки [6, 15−17] понять, почему окисление поверхности начинается только по достижении θ = θca , микроскопический
механизм перехода от адсорбции к образованию оксида долгое время оставался неясным. В настоящем разделе предложен меха-
192
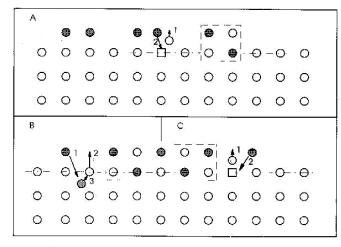
низм формирования оксида как результат возникновения неустойчивости поверхности кристалла из-за адсорбции кислорода, приводящей к увеличению числа вакансий, которые, взаимодействуя с адатомами, приводят к формированию оксида. Показано, что энергия активации формирования вакансий падает до величин близких к температуре поверхности, когда степень покрытия поверхности
кислородом достигает критического значения θca . Следовательно,
при θ → θca происходит спонтанное образование поверхностных вакансий. Это приводит к образованию оксида путем реакции рекомбинации вакансия-адатом. При приближении к θca критический
радиус зародышеобразования оксида не стремится к бесконечности, а становится очень малым, и в результате происходит образование кластеров оксида одновременно с ростом числа вакансий. Такое значительное увеличение покрытия поверхности кислородом в составе оксида действительно наблюдалось при окислении кремния вблизи порога зародышеобразования [18].
O2
Si
Рис. 7.1. Модель, изображающая механизм формирования оксида около критической точки (А) и за критической точкой (В и С). Черные кружки – атомы кислорода, белые – атомы кристалла. Числа показывают последовательность процесса окисления. Пунктирная линия очерчивает растущую оксидную фазу
193
Образование поверхностного оксида (рис. 7.1, точка А) рассматривается как результат заполнения поверхностных вакансий адатомами кислорода. Подобный процесс согласуется с обычным рассмотрением начала окисления как процесса замещения [1−4, 10] при условии, что замещение происходит через образование вакансии с одновременным заполнением их кислородом. Образование вакансий происходит как обычный процесс термоактивации, энергетика которого зависит от взаимодействия вакансия-вакансия (v−v) и адатом-вакансия (a−v).
Проведенные исследования показали [1, 3, 6, 17, 18, 19], что общая картина процессов на поверхности кремния при взаимодействии с кислородом вблизи порога зародышеобразования может быть достаточно сложной. Так, наблюдения с помощью метода сканирующей туннельной микроскопии показали, что при малой экспозиции (θхс ≈ 10−2) кремния в кислороде при комнатной температуре на поверхности Si возникают дефекты, которые выглядят как вакансии, их кластеры и адсорбированные атомы кристалла [17, 18]. При повышенных температурах (Т = 800−950 К) и низких давлениях кислорода Р = 10−7−10−8 Тор поверхность террас становится шероховатой [1, 3, 19]. Известно, что в этих условиях на поверхности кремния образуется лишь десорбирующийся летучий оксид SiO [6]. Поэтому в области высоких температур и низких давлений на поверхности имеет место переход огрубления. В связи с этим возникает проблема описания окисления и перехода огрубления в рамках единой модели. Это сделано в главах 7 и 8. Такое описание, в частности, позволяет ответить на вопрос, является ли порог зародышеобразования лишь границей области Р, Т, где образуется твердый оксид, или же это граница между областями, где наблюдаются фазовый переход первого рода – окисление, и переход огрубления поверхности.
В настоящей главе в рамках единого подхода, основанного на разработанном в главе 6 методе функционала плотности, построена единая физическая модель, позволяющая описать как окисление поверхности кремния, так и переход огрубления, возникающий в результате конденсации вакансий, образование которых индуцировано адсорбцией кислорода.
194
7.1. Микроскопическая модель образования оксида вблизи порога зародышеобразования
Для построения модели образования оксида вблизи порога зародышеобразования необходимо записать уравнения, определяющие кинетику релаксации системы различных частиц (вакансий, адатомов и оксида), которые можно называть точечными дефектами кристаллической структуры поверхности. Такие дефекты, будучи нарушениями регулярной кристаллической структуры поверхности, определяются своим окружением. Дефект представляет собой образование, состоящее из частицы-затравки и «шубы», образованной деформацией регулярной структуры вокруг частицы. Для адатомов и оксида (вакансии с атомом кислорода) затравкой является атом кислорода, а для вакансии − отсутствие атома в узле кристаллической решетки («дырка»). «Шуба» представляет собой совокупность искаженных вокруг затравки кристаллических плоскостей. Размер шубы L составляет, как правило, одну или несколько постоянных решетки кристалла a. Под действием случайных сил возможно переползание шубы на расстояние порядка a. Конечно, перемещение вакансии есть результат перемещения соседнего атома кристалла в вакантный узел решетки и, следовательно, образования вакансии в соседнем узле. При описании кинетики системы вакансий они рассматриваются как частицы, что позволяет ввести функцию распределения таких частиц. Время, за которое происходит перемещение частицы и «шубы», есть характерное время диф-
фузионного скачка τc ~ a2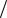 D ; D − коэффициент диффузии дефекта. Это время велико по сравнению с характерным временем
D ; D − коэффициент диффузии дефекта. Это время велико по сравнению с характерным временем
ω−1 |
~ 10−13 |
с |
колебания затравки ω τ |
d |
~ exp |
|
E |
>>1 (Т − темпе- |
0 |
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
ратура кристалла, Е − энергия активации диффузии дефекта). Характерное время действия случайных сил определяется величиной
ω0−1, что позволяет усреднить движение затравки по временам tср ,
ω−1 |
<< t |
ср |
<< τ |
c |
. Поэтому на временах t ≥ τ |
c |
движение дефекта |
0 |
|
|
|
|
сводится к его движению под действием δ − коррелированных
195
(τкорр ~ ω0−1) случайных сил, что позволяет рассматривать его как атомную частицу в среде и написать для него уравнение Ланжевена и соответствующее ему уравнение Фоккера−Планка. На временах t ≥ τc функция распределения, соответствующая решению этого
уравнения, |
определяется |
плотностью |
атомных |
частиц |
||||
f (α) = n |
α |
(rG, t) f α, |
f α |
− равновесная фукнция распределения де- |
||||
1 |
|
0 |
0 |
|
|
|
|
|
фекта сорта α (v – вакансия, а – адатом, oк – оксид).
Динамика накопления на поверхности адатомов кислорода (a), вакансий (v) и поверхностного оксида (ок) при экспозиции в кислороде описывается в среднеполевом приближении следующей системой уравнений для степеней покрытия θi = ni 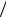 n0 , i = a, v, ок, ni −
n0 , i = a, v, ок, ni −
поверхностные плотности адатомов кислорода, вакансий и поверхностного оксида:
θ |
a |
= D Δθ |
a |
−αθ |
θ |
a |
+ Βθ |
ок |
− κθ |
a |
|
+Q, |
|
||||||||||||||||
θ |
|
|
|
a |
|
|
|
|
|
v |
|
|
|
|
|
|
|
−θ |
|
|
|
||||||||
v |
= D |
Δθ |
v |
−αθ |
|
θ |
a |
+ Βθ |
ок |
− γ(θ |
v |
v |
), |
(7.1) |
|||||||||||||||
|
|
θ |
v |
|
|
|
|
v |
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
ок |
= D |
|
Δθ |
ок |
+ αθ |
θ |
a |
−Βθ |
ок |
, |
|
|
|
||||||||||||
|
|
|
|
|
|
|
ок |
|
|
|
v |
|
|
|
|
|
|
|
|
||||||||||
где Di – коэффициент диффузии; αθvθa и Βθок соответствуют
реакции образования и распада оксида, соответственно, т.е. v + a ок; Q = p(2πmT)(−1/2) – поток кислорода из газовой фазы; κ – константа скорости десорбции с поверхности и/или диффузии в объем; γ(θv −θv) соответствует скорости образования вакансий;
θv − равновесная концентрация вакансий, вычисленная с учетом их взаимодействия друг с другом и с адатомами кислорода.
Выражение для θv можно получить, если воспользоваться со-
отношениями (6.154), (6.155) главы 6, которые определяют эффективную энергию образования вакансий с учетом их взаимодействия друг с другом и с адатомами кислорода. Поскольку химический потенциал вакансий равен нулю (глава 6), то из равенства μv = 0 в
приближении среднего поля следует стационарное значение степени покрытия вакансиями в системе адсорбат – поверхность:
196
θv = exp[−(Ev0 − Eaθa) / T]exp(Evθv / T). |
(7.2) |
Здесь Ev0 – энергия образования невзаимодействующих вакансий;
эффективные энергии Ea =T(exp(εav /T) −1) и Ev =T(exp(εvv /T) −1) выражены через энергии взаимодействия a−v (εav) и v−v (εvv) , где
εiv – энергия взаимодействия частицы сорта i = v, a с вакансией.
Покажем, что в системе (7.1) при определенных условиях возникает неустойчивость, которая ведет к образованию оксида. Положим для простоты Di = 0 . Решение (7.1) следуя [20] будем
искать |
в |
форме малого |
отклонения δθi от квазистационарного |
||||||||||
значения θs , т.е. θ |
i |
= θs + δθ |
i |
. Тогда |
|
|
|
||||||
|
|
|
|
i |
|
i |
|
|
|
|
|
||
|
|
|
|
|
δθa = −αθvsδθa −αθas δθv + Βδθок − κδθa, |
|
|||||||
|
|
|
δθv = −αθvsδθa −αθas δθv + Βδθок − γ(1−∂θv / ∂θv)δθv |
+ |
|||||||||
|
|
|
|
|
|
|
|
+γ(∂θv / ∂θa)δθa, |
|
|
(7.3) |
||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
δθок = αθvsδθa + αθas δθv − Βδθок. |
|
|
|
|||||
|
Здесь |
и |
далее |
|
все отклонения взяты при θ |
i |
= θs. |
Полагая |
|||||
|
|
|
|
|
|
|
|
|
|
|
i |
|
|
δθ |
i |
= δθ(0) |
exp(λt) , |
|
получим систему однородных уравнений для |
||||||||
|
|
i |
|
|
|
|
|
|
|
|
|
|
|
определения величин δθ(0) : |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
i |
|
|
|
|
|
|
|
|
|
[λi + κ + γ(∂θv/∂θa)]δθa −[λi + γ(1−∂θv/∂θv)]δθv = 0, |
||||||||||
|
|
|
|
|
|
|
(λi |
+ κ)δθa + λiδθок = 0, |
|
|
(7.4) |
||
αθvsδθa + αθas δθv −(λi +Β)δθок = 0.
Приравнивая к нулю определитель, отвечающией этой системе уравнений, получим уравнение для определения параметров λi ,
при которых система уравнений для δθi(0) имеет отличное от нуля решение. Из (7.4) следует, что параметры λi определяются квази-
стационарными решениями θis системы (7.1) и меняются при изменении давления кислорода и температуры поверхности. Из соот-
197

ношения δθi ~ exp(λt) следует, что собственные значения при λi ≥ 0 соответствуют неустойчивым модам. При этом неустойчивость возникает при переходе параметра λi через ноль
при изменении давления кислорода и температуры поверхности. Условие λi → 0 отвечает возникновению в системе медленно (за
время τ ~ 1/λi) меняющейся во времени моды, которая в соответ-
ствии с разделом 6.10 главы 6 является параметром порядка рассматриваемой системы. Уравнения, определяющие решение уравнений (7.4) вблизи точки неустойчивости λ = 0 , имеют вид:
δθa = 0, |
(1−∂θv /∂θv)δθv = 0, δθок = αθas δθv /Β. |
(7.5) |
Уравнение δθa = 0 |
отражает ситуацию, когда каждый |
атом |
кислорода в условии неустойчивости граничит непосредственно с вакансией, что приводит к образованию оксида. Как следует из (7.2), (7.5), неустойчивость возникает когда
1−∂θv / ∂θv =1− ETv exp[−(Ev0 − Eaθas ) / T]exp(Evθvs / T) = 0. (7.6)
Имея в виду (7.4), собственный вектор, отвечающий неустой-
чивой моде (λ → 0, |
λ > 0) можно записать в виде: |
|
|||||||
G |
|
|
|
|
|
|
0 |
|
|
s |
/ Β) |
2 |
] |
−1/2 |
|
1 |
|
(7.7) |
|
g |
=[1+ (αθa |
|
|
|
. |
||||
|
|
|
|
|
|
|
s |
|
|
|
|
|
|
|
|
|
αθa |
/ Β |
|
Физическая природа неустойчивости состоит в следующем. Накопление кислорода на стадии адсорбции приводит к уменьшению активационной энергии образования вакансий
Ev0 − Eaθa , как можно видеть из (7.2). При θa(Ev0 − Ea) ~ T , проис-
ходит спонтанное образование вакансий в системе. Впоследствии вакансии рекомбинируют с адатомами кислорода, одновременно
вызывая образование оксида θок ~ αθaθv (7.1), δθок ~ δθv (7.5).
Самоподдержание реакции обеспечивается взаимодействием вакансий εvv (7.2).
198
Исследуем неустойчивое решение на основе развитого выше формализма функционала плотности. Во-первых вычислим собственное значение λ системы уравнений (7.4) вблизи критиче-
ских значениях степеней заполнения θic , определяемыми уравнением (7.6). Решая (7.4) при λ → 0 и (7.2), получим:
|
λ(θs , |
θs ) = |
|
Βκγ(1−∂θv / ∂θv) |
= |
|
|
|
||||||
|
αθas[κ + γ(∂θv / ∂θa)] |
|
|
|
||||||||||
|
a v |
|
|
|
|
(7.8) |
||||||||
|
ΒκγE2[E |
|
/ E |
(θs |
−θc ) |
+ θs |
−θc |
] |
|
|
E0 |
|
||
|
a |
|
|
|||||||||||
= |
v |
v |
|
a |
a |
v |
v |
|
×exp |
v |
. |
|
||
c |
|
2 |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
T |
|
|
||
|
αθaT |
[κ + γ(∂θv / ∂θa)] |
|
|
|
|
|
|
||||||
Как следует из (7.2), отношение ∂θv / ∂θv положительно. Поэтому
собственное значение отрицательно в соответствии с (7.8), если θas < θca и θvs < θcv и положительно при θas > θca , θvs > θcv .
Проведенный анализ показывает, что неустойчивость в рассматриваемой системе возникает на всей поверхности при таких давлении кислорода и температуре, при которых степени покрытия достигают значений, определяемых соотношением (7.6). Из этого следует, что в рассматриваемой системе может происходить фазовый переход в соответствии с терминологиейG раздела 6.10 главы 6
в однородное конденсатное состояние (kс = 0, ωс =0). В этом слу-
чае |
|
функционал, определенный в главе 6, может быть записан в |
|||||||||
виде: |
|
|
= 12 ∫ |
|
|
|
|
|
|
||
|
|
|
|
∑ dωβij−1(ω)δθi(ω)δθ* j (ω) + |
|
|
|||||
|
|
|
|
|
|
i, j=a,v,ок |
|
|
|
||
|
|
|
1 |
∑ |
|
|
∂ |
|
|
(7.9) |
|
|
|
+ |
|
dω |
|
|
βij−1(ω) δθi(ω)δθ* j (ω)δθk |
(ω) + |
|||
|
|
|
∂θk |
||||||||
|
|
|
3 ∫i, j,k=a,v,ок |
|
|
|
|
||||
+ 1 |
∫ |
|
∑ |
dω |
|
∂2 |
|
βij−1(ω) δθi(ω)δθ* j(ω)δθk (ω)δθ*l (ω) +… |
|
||
|
|
|
|
|
|||||||
4 |
|
i, j,k,l=a,v,ок |
∂θk∂θl |
|
|
|
|||||
В соответствии с развитым формализмом функционала плотности, функция отклика βij−1 определяется по изменению плотности системы, вызванному включением бесконечно малого внешнего
199
поля. Однако это определение может быть обобщено. Действи-
тельно, функционал |
e |
, определенный соотношением (6.63) гла- |
|
g |
|
вы 6, при малом изменении параметров системы δQ(x, t) , можно записать в виде
e |
= limτ |
−1 |
τ |
F |
e |
τ |
G |
τ |
G |
|
|
|
∫ |
|
dt −μ∫ ndrdt + ∫ |
δQndrdt . |
|||||
g |
τ→∞ |
|
0 |
g |
0 |
|
0 |
|
|
|
Тогда становится очевидным, что функцию отклика в общем случае можно определить по изменению плотности системы, вызван-
ному бесконечно малым изменением параметров системы δQ(x,t) :
δn(rG,t) = ∫β(rG, rG′t,t′)δQ(rG′,t′)drG′dt′.
Определим функцию отклика βij−1 из (7.1) как отклик системы на добавление бесконечно малого внешнего источника δQi в
правую сторону уравнения (7.1). Отталкивание дефектов на малых расстояниях, что делает невозможным сжатие системы до поверхностных плотностей менее θ0 (θ0 − число атомов на единицу по-
верхности кристалла), в рассматриваемом приближении среднего
поля учтем, |
заменив |
в |
выражении для |
|
β−1 плотность θ |
0 |
на |
|||||||||
θ0 (1−(θas + θvs + θокs )). |
|
|
|
|
|
|
ij |
|
|
|
|
|
||||
Для вычисления |
|
функции |
отклика |
|
|
при |
||||||||||
kG |
= 0 , ω = 0 в уравнениях (7.1) достаточно положить |
|
∂2 |
|
|
|
= 0 . |
|||||||||
|
G |
2 |
|
|||||||||||||
с |
с |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
(∂r) |
|
|
|
|
В этом случае из (7.1) находим: |
|
1 |
|
|
|
|
|
|
|
|
|
|||||
|
|
β−1 |
= |
|
|
|
× |
|
|
|
|
|
|
|
||
|
|
θs |
+ θs |
+ θs − |
|
|
|
|
|
|
|
|
||||
|
|
|
ij |
|
1 |
|
|
|
|
|
|
|
||||
|
|
|
|
|
a |
v |
ox |
|
|
|
|
|
|
|
|
|
|
|
αθs + κ |
|
|
|
αθs |
−Β |
|
|
(7.10) |
||||||
|
|
v |
|
|
|
|
a |
|
|
|
|
|
|
|
||
|
× |
αθvs − γ(∂θv / ∂θa) αθas |
+ γ(1−∂θv / ∂θv) |
−Β . |
|
|
|
|
||||||||
|
|
αθs |
|
|
|
|
αθs |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
−Β |
|
|
|
|
|
|
||||
|
|
v |
|
|
|
|
a |
|
|
|
|
|
|
|
||
|
Удобно переписать значения δθi как вектор δθ = gGξ. |
Вектор g |
||||||||||||||
(7.7) описывает структуру неустойчивой моды, а ξ(r, t) является амплитудой этой моды, т.е. параметром порядка системы [20].
200
