
- •Химия воды и микробиология Учебно-методическое пособие к практическим занятиям
- •Введение
- •Химия воды
- •Понятие о растворах. Процесс растворения. Растворимость веществ
- •Решение типовых задач
- •Задачи для самостоятельной работы
- •Количественная характеристика состава раствора
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.3. Электролитическая диссоциация. Степень и константа диссоциации
- •Задачи для самостоятельного решения
- •1.4. Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации
- •Задачи для самостоятельного решения
- •1.5. Диссоциация воды. Водородный показатель
- •Задачи для самостоятельного решения
- •1.6. Гидролиз солей
- •I. Соли, образованные сильным основанием и слабой кислотой
- •II. Соли, образованные слабым основанием и сильной кислотой
- •III. Соли, образованные слабым основанием и слабой кислотой
- •Задачи для самостоятельного решения
- •1.7. Коллоидные растворы
- •Контрольные вопросы
- •1.8. Окислительно-восстановительные реакции
- •Задачи для самостоятельного решения
- •2. Физические и химические свойства технологических процессов водоподготовки
- •2.1. Физико-химическая характеристика природных вод
- •2.2. Физические, химические, биологические показатели качества воды
- •Физико-химические основы коагулирования примесей воды
- •2.4. Коагулянты и флокулянты применяемые для осветления воды
- •2.5. Обеззараживание воды
- •Хлорирование воды.
- •2.5.2. Озонирование воды
- •2.5.3. Применение сильных окислителей и сорбентов. Осаждение
- •2.6. Характеристика бытовых и производственных сточных вод
- •Тест №1
- •3. Микробиология
- •3.1. Основы общей микробиологии
- •3.2. Морфологическая характеристика отдельных групп микроорганизмов
- •1) Меноидный слой с выступами и бугорками; 2) ликополисахаридный слой; 3) каналы; 4) молекулы белка; 5) плотный гликопептидный слой; 6) цитоплазматическая мембрана
- •8) Капсула; 9) мембрана протопласта.
- •3.3. Питание бактерий
- •3.4. Ферменты
- •3.5. Химический состав бактерий
- •3.6. Участие микроорганизмов в круговороте веществ в природе
- •3.7. Водоросли, грибы, простейшие, коловратки, черви и микробактерии
- •5) Surirella saxonica (образование ауксоспор); 6) Asterionella gracillima; 7) Pleurosigma attenuatum; 8) Didymosphenia geminata
- •3.8. Влияние внешних факторов на микробов
- •Тест №2
- •4. Санитарная микробиология
- •4.1. Санитарно-бактериологические методы анализа воды
- •4.2 Физические и физико-химические показатели состава воды
- •4.3. Химические и биохимические показатели
- •Примеси в коллоидном и твердом состояниях
- •Общая минерализация и общая загрязненность воды
- •Примеси в растворенном и коллоидном состояниях
- •Щелочность. Углекислотное равновесие воды
- •Тест №3
- •4.4. Индикаторная роль бактерий группы кишечной палочки
- •5. Биологические факторы самоочищения водоемов
- •6. Вредная деятельность микроорганизмов в системах водоснабжения
- •Тест №4
- •7. Сточные воды и методы их очистки
- •7.1. Очистные сооружения
- •11) Песчаные фильтры; 12) хлораторная; 13) контактный резервуар.
- •7.2. Сооружения механической очистки
- •7.3. Сооружения для биологической очистки.
- •7.4. Аэробные процессы очистки сточных вод
- •7.5. Анаэробные процессы очистки сточных вод
- •7.6. Биологические пруды
- •Тест № 5
- •Заключение
- •Библиографический список
- •Химия воды и микробиология Учебно-методическое пособие к практическим занятиям
2.4. Коагулянты и флокулянты применяемые для осветления воды
Чаще
всего в качестве коагулянта применяют
неочищенный сернокислый алюминий
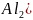 ,
а также железный купорос
,
а также железный купорос
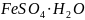 .
.
Существует технология выработки высококонцентрированного коагулянта основного хлорида алюминия. Такой коагулянт способен образовывать более прочный осадок.
Железный купорос в воде образует гидроксид железа (II) Fe(OH)2, который под действием растворенного кислорода или специально вводимого хлора, окисляется в гидроксид железа (III). Скорость осаждения хлопьев гидроксида железа в 1,5 раза больше скорости осаждения хлопьев гидроксида алюминия. Но для быстрого окисления необходимо, чтобы pH воды было больше 8. Это может быть достигнуто путем подщелачивания воды.
Иногда в качестве коагулянта применят хлорное железо FeCl3, оно хорошо растворяется в воде и образует крупные быстро оседающие хлопья гидроксида Fe(OH)3. Наибольшую эффективность дает использование хлорного железа FeCl3 при совместном применении его с сернокислым алюминием и известью.
Обработка воды минеральными коагулянтами не всегда обеспечивает нужный эффект кондиционирования воды. Поэтому появилась необходимость изменения веществ, которые активировали процесс коагуляции. Такие вещества называются – флокулянты. В качестве флокулянтов используют активированную кремнекислоту, полиакриламид К-4 и К-6 и др. Есть флокулянты анионного типа (ВА-2, ВА-3, ВА-102 и тд.), катионного и нейтрального.
2.5. Обеззараживание воды
При осветлении и обесцвечивании воды коагулированием из нее удаляется значительная часть (90…95 %) бактерий. В составе оставшейся части воды могут оказаться болезнетворные микробы и вирусы. Поэтому воду после фильтрования необходимо обеззараживать.
Известно много методов обеззараживания воды, которые можно классифицировать на четыре основные группы: термическая; при помощи сильных окислителей; олигодинамия – воздействие ионов благородных металлов; физическая – с помощью ультразвуков, радиоактивного излучения, ультрафиолетовых лучей.
На практике предпочтение отдают хлору, озону, гипохлориту натрия.
Хлорирование воды.
Под действием хлора или его производных бактерий, находящиеся в воде, погибают.
При введении хлора в воду он гидролизуется по уравнению
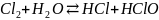 .
.
Образовавшаяся хлорноватистая кислота диссоциирует:
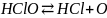 .
.
Образующийся атомарный кислород обладает сильными окислительными
свойствами.
Если используется хлорная известь, реакция идет следующим образом:
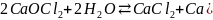 .
.
Даже хлорноватистая кислота диссоциирует по вышеприведенной схеме, с образованием атомарного кислорода.
В зависимости от дозы введенного хлора, эффект хлорирования разный. Небольшая доза введенного хлора идет на окисление микроорганизмов, большая часть его идет на реакции с органическими и минеральными примесями, содержащимися в воде.
2.5.2. Озонирование воды
Озон является одним из наиболее сильных окислителей, которые уничтожает бактерии, споры и вирусы. При использовании метода озонирования одновременно с обеззараживанием происходит обесцвечивание воды, также устраняются запахи и привкусы воды и вообще улучшаются ее вкусовые качества. Озон О3 получают из атмосферного воздуха в аппаратах-озонаторах путем воздействия на воздух электрического заряда. Озон нестоек и распадается:
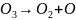 .
.
Озон подают в воду либо через эжекторы (эмульгаторы), либо через сеть пористых труб или распределительных каналов, укладываемых по дну контактного резервуара. Доза озона зависит от назначения озонирования воды.
Если вводится только для обеззараживания в предварительно отфильтрованную воду (после ее предварительного коагулирования), то доза озона не превышает 1 мг/л. При введении озона для обесцвечивания и обеззараживания воды до 4 мг/л, продолжительность контакта воды с озоном 5…10 мин.
