
- •Глава 1.
- •1.1. Тенденции и проблемы вэжх
- •1.2. Физико-химические критерии совместимости компонентов системы
- •1.3. Хроматографические свойства сорбатов
- •1.3.1. Полярность и гидрофобность
- •1.3.2. Строение сорбата и растворимость
- •1.3.3. Оптические свойства
- •1.3.4. Рефракционные свойства
- •1.4 Сорбенты для вэжх
- •1.4.1 Сорбенты для нормально-фазовой хроматографии
- •1.4.2. Привитые сорбенты для нормально-фазовой хроматографии
- •1.4.3. Сорбенты для обращенно-фазовой хроматографии
- •1.4.4. Сорбенты для эксклюзионной хроматографии
- •1.4.5. Количественная оценка полярных свойств сорбентов
- •1.5. Хроматографические свойства индивидуальных растворителей
- •1.5.1. Оптические свойства
- •1.5.2. Полярность и элюирующая сила
- •1.5.3. Смешиваемость. Миксотропный ряд
- •1.5.4. Обобщенные критерии полярности растворителей
- •1.5.5. Обобщенные критерии элюирующей силы растворителей
- •Глава 2
- •2.1. Плотность и объемные свойства
- •2.2. Вязкость
- •2.3. Показатель преломления
- •2.4. Оптические свойства
- •2.5. Элюирующая сила
- •2.5.1. Элюирующая сила в нормально-фазовой хроматографии
- •2.5.2. Элюирующая сила в обращенно-фазовой хроматографии
- •Глава 3. Изобары температуры кипения бинарных
- •3.1. Азеотропные составы бинарных растворителей, перспективы применения в вэжх
- •3.2. Инвариантное описание изобар температур кипения бинарных
- •Глава 4. Общие закономерности удерживания сорбатов
- •4.1. Нормально-фазовая система сорбат – элюент – сорбент
- •4.2. Нормально-фазовая хроматография гидрофобных сорбатов
- •4.3. Разделение и идентификация таутомерных форм гидрофобных
- •4.4. Обращенно-фазовая система сорбат – элюент – сорбент
- •4.5. Обращенно-фазовая хроматография некоторых гликозидов
- •Глава 5. Хемометрические приемы оптимизации методик вэжх
- •5.1. Принципы построения поисково-аналитических систем для вэжх
- •5.3. Оценка оптимальности состава бинарной подвижной фазы
- •Список литературы
- •394006 Воронеж, ул. 20-летия Октября,84
3.2. Инвариантное описание изобар температур кипения бинарных
растворителей
Известны различные методы описания межмолекулярного взаимодействия компонентов гомогенных систем. Последовательные ab initio методы описания этих явлений весьма сложны, позволяя описать лишь простейшие модельные системы. Нейросетевые модели описания даже простейших бинарных гомогенных систем требуют значительного и часто недоступного объема информации, вследствие чего к настоящему времени они не получили достаточного распространения. Поэтому на практике учет эффектов межмолекулярного взаимодействия даже для простейших бинарных жидких систем, не говоря уже о многокомпонентных смесях, обычно строится на базе регрессионной аппроксимации эмпирических зависимостей. В этом подходе определение класса функций, на которых строится регрессия, является ключевым в процедуре построения модели. Наиболее фундаментальные свойства систем отражает их симметрия [34], учет которой в регрессионном базисе позволяет даже на ограниченном массиве эмпирических данных построить описание, автоматически учитывающее базисные свойства исследуемых систем. Учет свойств геометрической симметрии (инверсионной, трансляционной, ротационной и др.) нашел широкое применение в химии. Поскольку полная симметрия системы не сводится только к ее инвариантности относительно пространственных преобразований, необходим учет и других ее видов. В многокомпонентных смесях возникает дополнительная симметрия, связанная с перестановкой свойств и концентраций компонентов. Так, в частности, плодотворность подхода, основанного на учете перестановочной симметрии, к описанию физико-химических свойств отдельных компонентов продемонстрирована в работе [34].
При этом учет свойств термодинамической симметрии делает возможным определение класса функций, позволяющих построить наиболее «экономичное» описание и аналитически выделить вклад межмолекулярного взаимодействия во внутреннюю энергию системы. Ранее этот алгоритм использован в работе [34] для описания изотерм ряда физико-химических свойств бинарных жидких систем. Однако в этой работе не был исследован механизм установления равновесия между жидкостью и паром, позволяющий с одной стороны выявить механизмы межмолекулярного взаимодействия компонентов смеси и, с другой стороны имеющий и существенное практическое значение. Это явление, в частности, является основой оптимизации многих технологических процессов, базирующихся на использовании межфазных переходов в растворах, таких как дистилляция и ректификация.
Рассмотрим свойства симметрии многокомпонентных гомогенных систем, построение регрессионного базиса, инвариантного относительно преобразований симметрии и описание на этой основе эмпирических изобар температур кипения. Для гетерогенных систем, расслаивающихся при смешивании, построение изобар выполним для гомогенных областей концентраций. Помимо собственных экспериментальных результатов обсудим согласованные между собой данные из справочных изданий [38-40].
Постановка задачи инвариантного описания изобар физико-химических свойств.Отдельный компонент гомогенной системы, находящейся в состоянии термодинамического равновесия, описывается набором ее физико-химических характеристик
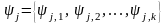 .
(84)
.
(84)
Здесь индекс j нумерует компонент, (в частности, для бинарных систем j=1,2); второй индекс нумерует свойства компонента.
Как показано в работе [34], с достаточной для большинства практических приложений точностью при описании свойств реальных многокомпонентных систем нет необходимости учитывать полный набор характеристик (84). Физико-химические свойства бинарных растворов (плотность, динамическая вязкость, коэффициент преломления, коэффициент поверхностного натяжения) адекватно, с точностью лимитирующейся только погрешностями эмпирических данных, описываются как максимум двумя параметрами отдельных компонентов. Один из них совпадает с исследуемой характеристикой системы, а второй определяется механизмом сольватации молекул компонента с меньшей полярностью. Если эффектами отличия локального состава сольватной оболочки от средневзвешенного состава системы можно пренебречь (как например, при описании плотности бинарного раствора), достаточной является точность регрессии, базис которой включает лишь одну характеристику каждого компонента.
Сформулируем
свойства перестановочной симметрии
равновесных систем и соответствующие
свойства регрессионного базиса.
Во-первых, одновременная перестановка
векторов свойств бинарных систем
 и мольных концентраций компонентов
и мольных концентраций компонентов
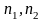
 и
и
 (85)
(85)
не приводит к изменению состава смеси. Вследствие этого и функции, описывающие зависимость свойств смеси от концентрации компонентов, должны быть инвариантны относительно этой перестановки. В частности, этой симметрией обладает аддитивное по компонентам выражение
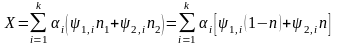 , (86)
, (86)
в
котором преобразование (85) приводит к
перемене мест слагаемых. В уравнении
(86) учтено условие нормировки концентраций
 и опущен индекс, нумерующий характеристики
отдельного компонента.
и опущен индекс, нумерующий характеристики
отдельного компонента.
При выборе в качестве первого приближения регрессионной функции (86), содержащей лишь одно слагаемое, содержащее температуры кипения компонентов, мы получаем аппроксимацию эмпирических изобар температуры кипения для идеальной системы, подчиняющейся закону Рауля, вида
 . (87)
. (87)
Физически это приближение соответствуют пренебрежению вкладом межмолекулярного взаимодействия различных компонентов. Однако, как показывает анализ эмпирических данных, для водных растворов отклонения от закона Рауля весьма велики [38-40], что требует создания методов количественного описания неаддитивных поправок к уравнениям равновесия жидкой и газовой фаз.
Классический
метод описания эффектов межмолекулярного
взаимодействия основан на регрессионном
описании зависимостей логарифмов
коэффициентов активности компонентов
от состава смеси. Разными авторами
предложены различные классы регрессионных
функций – полиномиальные, различные
рациональные, разрывные и др. Однако
все эти методы либо достаточно сложны,
либо имеют ограниченную область
применимости. Наибольшее распространение
при описании различных свойств
многокомпонентных систем в настоящее
время получил полиномиальный базис
Редлича – Кистера (Redlich-Kister
expansion) [41].
Однако этот базис не учитывает свойств
исследуемых систем, вследствие чего
он не является оптимальным. Для
отображения поведения даже бинарных
систем в этом базисе необходимо
использовать до десяти параметров. Эти
недостатки классических методов привели
к необходимости использования алгоритмов
прямого описания условий равновесия,
без применения коэффициентов активности
компонентов. Так, например, в работе
[42] предложено двухпараметрическое
рациональное представление изобар
температур кипения бинарных растворителей
через объемную долю модификатора
 вида (83), которое, однако, не обладает
необходимой симметрией и требует
использования различных параметров
для реально совпадающих систем. Кроме
того, эта аппроксимация хорошо описывает
либо восходящие, либо нисходящие ветви
неаддитивных поправок к изобарам
температур кипения и не позволяет
адекватно описать искомую зависимость
во всей области относительных концентраций
[42]. В то же время, многочисленные расчеты
изотерм физико-химических свойств
свидетельствуют о том, что рациональный
(и даже более простой – полиномиальный)
базис регрессии позволяет адекватно
описать эмпирические зависимости во
всем диапазоне концентраций [34].
вида (83), которое, однако, не обладает
необходимой симметрией и требует
использования различных параметров
для реально совпадающих систем. Кроме
того, эта аппроксимация хорошо описывает
либо восходящие, либо нисходящие ветви
неаддитивных поправок к изобарам
температур кипения и не позволяет
адекватно описать искомую зависимость
во всей области относительных концентраций
[42]. В то же время, многочисленные расчеты
изотерм физико-химических свойств
свидетельствуют о том, что рациональный
(и даже более простой – полиномиальный)
базис регрессии позволяет адекватно
описать эмпирические зависимости во
всем диапазоне концентраций [34].
Общий подход к построению регрессионных моделей, основанный на учете свойств термодинамической симметрии равновесных систем, позволяет решить задачу описания не только эмпирических изотерм, но и изобар, и построить трехпараметрическое описание гомогенных растворов свободное от недостатков, присущих представлению (83) и других неинвариантных относительно преобразований симметрии представлений.
Выделим
из эмпирических результатов аддитивное
по компонентам слагаемое (87). Поправка
на неаддитивность
 ,
количественно описывающая отклонение
от закона Рауля имеет вид:
,
количественно описывающая отклонение
от закона Рауля имеет вид:
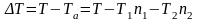 (88)
(88)
Выделение
неаддитивной части температуры кипения
значительно сужает класс регрессионных
функций. Поскольку на границах интервала
концентрации [0;1] значения аддитивного
слагаемого
 совпадают с параметрами компонент
смеси, поправка
принимает на границах нулевое значение.
Функция, обладающая этим свойством,
имеет внутри интервала концентраций
[0;1], по меньшей мере, один экстремум.
Типичный пример зависимости неаддитивной
поправки к изобаре температуры кипения
приведен на рис.35, из которого видно,
что экстремум существенно смещен от
эквимолярного состава смеси. На обеих
границах интервала относительных
концентраций [0;1] производные
совпадают с параметрами компонент
смеси, поправка
принимает на границах нулевое значение.
Функция, обладающая этим свойством,
имеет внутри интервала концентраций
[0;1], по меньшей мере, один экстремум.
Типичный пример зависимости неаддитивной
поправки к изобаре температуры кипения
приведен на рис.35, из которого видно,
что экстремум существенно смещен от
эквимолярного состава смеси. На обеих
границах интервала относительных
концентраций [0;1] производные
 практически стационарны и принимают
конечные, отличные от нуля значения
разных знаков. Применение полиномиальных
зависимостей требует для описания этих
особенностей большого числа параметров.
практически стационарны и принимают
конечные, отличные от нуля значения
разных знаков. Применение полиномиальных
зависимостей требует для описания этих
особенностей большого числа параметров.

Рис. 35. Зависимость неаддитивной части изобары температуры кипения системы «метанол ̶ вода» от мольной доли метанола
Более эффективной является гармоническая трехпараметрическая зависимость вида
 , (89)
, (89)
где
 – величина экстремума функции
– величина экстремума функции
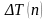 .
В уравнении (89) введены обозначения
.
В уравнении (89) введены обозначения
 и
и
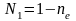 и
и
 – ступенчатая функция
– ступенчатая функция
 (90)
(90)
при
произвольных больших значениях параметра
А (в
данной работе принято А
=1000).
Функция
 в узком интервале [-A-1;A-1]
быстро меняется от 0 до 1.
в узком интервале [-A-1;A-1]
быстро меняется от 0 до 1.
Параметры регрессии , α, nе, определяются из условия минимизации интегральной по эмпирическому массиву ошибки аппроксимации. При этом параметр , рассчитывается независимо от остальных и равен экстремальному значению неаддитивной поправки. В противоположность этому значения параметров α, nе, определяющих положение экстремума и значения производных на границах интервала концентраций, связаны между собой. Вследствие этой взаимосвязи алгоритм определения параметров α, nе является итерационным.
Функция (89) удовлетворяет всем сформулированным требованиям. Во-первых, аргумент гармонической функции в выражении (1.7) на интервале концентраций [0,1] монотонно растет от 0 до π, что автоматически обеспечивает нулевые значения на границах интервала и наличие экстремума при значении аргумента, равном π/2. Во-вторых, значение этого экстремума равно . При этом увеличение параметра α сдвигает положение экстремума в область резко неэквимолярного состава смеси. И, в-третьих, производные функции в окрестностях граничных точек принимают конечные и различные по знаку значения.
Минимизация ошибки регрессии, кроме равенства значений эмпирического и расчетного экстремумов, требует совмещения их положений, что приводит к уравнению
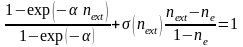 , (91)
, (91)
где
next
– положение
эмпирического экстремума. Равенство
(91) выполняется при условиях α-1>>
next
и n~next.
В этом случае функция
 в точке n=next
практически достигает насыщения, а
второе слагаемое в уравнении (91) равно
нулю. Дальнейшее увеличение концентрации
n
не приводит к изменению первого слагаемого
в аргументе функции (89) вследствие чего
рост аргумента (91) до максимального
значения, равного π,
целиком определяется вторым слагаемым.
Таким образом, слагаемые выражения
(91) практически независимо определяют
нисходящую и восходящую ветви функции
,
что в совокупности с ограничениями,
накладываемыми на значения параметров
α, nе,
позволяет построить эффективный алгоритм
построения базиса регрессии. Для
расчета параметров базиса на первом
этапе определяется экспериментальное
положение экстремума
в точке n=next
практически достигает насыщения, а
второе слагаемое в уравнении (91) равно
нулю. Дальнейшее увеличение концентрации
n
не приводит к изменению первого слагаемого
в аргументе функции (89) вследствие чего
рост аргумента (91) до максимального
значения, равного π,
целиком определяется вторым слагаемым.
Таким образом, слагаемые выражения
(91) практически независимо определяют
нисходящую и восходящую ветви функции
,
что в совокупности с ограничениями,
накладываемыми на значения параметров
α, nе,
позволяет построить эффективный алгоритм
построения базиса регрессии. Для
расчета параметров базиса на первом
этапе определяется экспериментальное
положение экстремума
 .
На втором этапе из необходимого условия
экстремума
.
На втором этапе из необходимого условия
экстремума
 получаем уравнение
получаем уравнение
 (92)
(92)
решая которое относительно переменной n при фиксированных значениях параметров α, nе можно получить двумерный массив значений n(α, nе). Эта часть алгоритма не зависит от конкретной равновесной системы.
Дальнейшая
часть алгоритма носит итерационный
характер и определяется эмпирическим
положением экстремума неаддитивной
поправки исследуемого раствора. Из
полного массива решений уравнения (92)
находится набор значений параметра
 ,
для которых имеются корни уравнения,
попадающие в окрестность эмпирического
значения
бинарной системы. Линейная интерполяция
параметра α
позволяет для каждого значения
j=1,2,…,k
определить
соответствующие значения параметра
αj.
И, наконец, на последнем этапе из всех
наборов параметров
,
для которых имеются корни уравнения,
попадающие в окрестность эмпирического
значения
бинарной системы. Линейная интерполяция
параметра α
позволяет для каждого значения
j=1,2,…,k
определить
соответствующие значения параметра
αj.
И, наконец, на последнем этапе из всех
наборов параметров
 выбирается
набор, реализующий минимальное
среднеквадратичное отклонение по
полному массиву эмпирических данных.
выбирается
набор, реализующий минимальное
среднеквадратичное отклонение по
полному массиву эмпирических данных.
Таблица 59. Параметры аппроксимации (89) , α, nе для неаддитивных частей изобар температуры кипения ряда гомогенных водно-органических растворов. В двух последних столбцах приведены абсолютная и нормированная на модуль максимума неаддитивной поправки среднеквадратичные отклонения от эмпирических массивов.
Растворитель |
- |
α |
ne |
σ |
σn |
Этиленгликоль |
51.96 |
16.43 |
0.080 |
0.087 |
0.0017 |
Фурфурол |
48.76 |
8.98 |
0.030 |
2.065 |
0.0423 |
Масляная кислота |
34.72 |
14.24 |
0.150 |
0.122 |
0.0035 |
Пропионовая кислота |
28.92 |
8.51 |
0.020 |
0.565 |
0.0195 |
Этилацетат |
28.40 |
59.73 |
0.030 |
0.397 |
0.0140 |
Ацетон |
23.37 |
10.50 |
0.010 |
0.402 |
0.0170 |
Метилэтилкетон |
22.97 |
58.07 |
0.010 |
0.317 |
0.0138 |
Циклопентанол |
22.26 |
5.04 |
0.130 |
0.621 |
0.0280 |
ИПС |
16.40 |
21.99 |
0.060 |
0.116 |
0.0071 |
Метилвинилкетон |
16.07 |
15.79 |
0.190 |
0.330 |
0.0205 |
1-Бутанол |
15.79 |
6.95 |
0.210 |
0.669 |
0.0424 |
Ацетонитрил |
14.77 |
25.05 |
0.180 |
0.038 |
0.0025 |
Изобутанол |
14.53 |
6.16 |
0.300 |
1.103 |
0.0759 |
Диметилформамид |
14.50 |
8.20 |
0.210 |
0.176 |
0.0120 |
1,4-Диоксан |
12.81 |
6.79 |
0.390 |
0.739 |
0.0577 |
Этанол |
12.43 |
12.69 |
0.150 |
0.064 |
0.0051 |
Метанол |
11.57 |
7.98 |
0.090 |
0.031 |
0.0027 |
1-Пропанол |
11.36 |
22.30 |
0.190 |
0.386 |
0.0340 |
Аллиловый спирт |
10.37 |
16.66 |
0.220 |
0.254 |
0.0245 |
Уксусная кислота |
5.08 |
4.78 |
0.030 |
0.031 |
0.0062 |
Муравьиная кислота |
-7.09 |
3.85 |
0.210 |
0.133 |
0.0190 |
Изложенный алгоритм реализован авторами работы [41] в оболочке пакета математических программ Maple V Power Edition.
Описание эмпирических изобар уравнением (89), аргументом которого является концентрация одного из компонентов, не является полностью перестановочно инвариантным. Однако, выражая концентрацию n через инвариантный мультипликативный аргумент Ф=n1n2=n(1-n) в виде
 (92)
(92)
можно получить полностью инвариантное представление.
Результаты расчетов параметров аппроксимации (89) приведены в табл. 59. Растворители в ней упорядочены по величине максимального неаддитивного вклада в температуру кипения . Эмпирические данные взяты из работ [38-42]. В последних столбцах представлены абсолютная и нормированная на максимум поправки среднеквадратичные ошибки аппроксимации (σ и σ1 соответственно). Как видно из табл. 59 для большинства водно-органических растворов интегральная по полному эмпирическому множеству относительная погрешность регрессии (89) на эмпирических массивах меньше чем 10-2 и достаточна для большинства практических приложений.

Рис. 36. Зависимость неаддитивной части изобары температуры кипения системы «этанол ̶ вода» от мольной доли этанола.
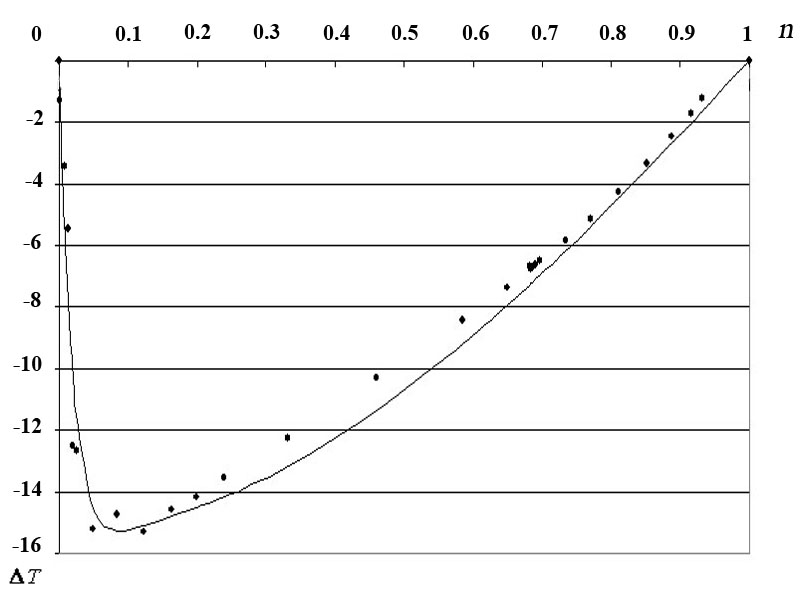
Рис. 37. Зависимость неаддитивной части изобары температуры кипения системы «ИПС ̶ вода» от мольной доли ИПС.

Рис.
38. Зависимость разности
 экспериментального значения неаддитивной
часть изобары температуры кипения
системы «метанол
– вода»
экспериментального значения неаддитивной
часть изобары температуры кипения
системы «метанол
– вода»
 и ее аппроксимации
и ее аппроксимации
 от мольной доли метанола.
от мольной доли метанола.
Для небольшого числа систем (вода – фурфурол, вода ̶ изобутанол, вода –1,4-диоксан) относительная ошибка аппроксимации неаддитивной поправки находится в диапазоне 4×10-2 ‒ 8×10-2. При этом, поскольку поправка на неаддитивность для всех гомогенных систем на порядок меньше значений температур кипения, относительная точность регрессионного описания изобар на предложенном нами инвариантном базисе даже и для этих систем не хуже, чем 2×10-3. Только в тех случаях, когда эта точность недостаточна, а точность эксперимента превышает величину 2×10-3 , необходимо расширение или модификация регрессионного базиса. Приведенные в табл. 59 результаты расчета среднеквадратичных отклонений не отражают локального распределения погрешностей регрессионного описания эмпирических изобар. Эта информация отражена на рис. 1.1 –1.4. Графически результаты сравнения аппроксимации (1.7) (сплошная кривая) с эмпирическими данными работы [14] (экспериментальные точки) для трех систем приведены на рис. 36-37.
Пример непосредственного распределения ошибок аппроксимации эмпирических данных для системы «метанол ̶ вода» приведен на рис. 38. Как видно из графиков, не только интегральная, но и локальная точность регрессии (как правило, лучше 0.3 К), что достаточно для большинства приложений. Анализ этого распределения свидетельствует о значительном вкладе стохастических процессов, связанных с погрешностями эмпирических данных, в ошибку регрессионного описания. Это требует разработки методов выделения стохастического и детерминированных вкладов в эмпирические массивы и формулирования алгоритмов регрессионного описания детерминированной компоненты.
Таким образом, сформулированный в работе [34] алгоритм описания изотерм физико-химических свойств равновесных гомогенных систем, основанный на учете свойств перестановочной симметрии отдельных компонентов, показал свою эффективность и при регрессионном описании изобар температур кипения. Однако специфика зависимости изобар от относительной концентрации компонентов требует использования трехпараметрического гармонического базиса регрессии. В этом базисе точность инвариантного описания изобар температур кипения водно-органических смесей в большинстве случаев определяется стохастическим вкладом в эмпирические данные и достаточна для большинства применений. Дальнейшее уменьшение погрешности регрессии возможно как за счет модификации базиса, так, в большинстве случаев, и путем уменьшения экспериментальных ошибок.
Изобары температур кипения бинарных растворов на основе тетрахлорметана. Выше были рассмотрены водно-органические системы. На примере бинарных систем «тетрахлорметан – органический растворитель» рассмотрим подход в разработке алгоритма построения регрессионного базиса, инвариантного относительно преобразований симметрии, для эмпирических изобар температуры кипения бинарных гомогенных систем, пригодных для НФХ. Тетрахлорметан (СCl4) выбран объектом исследования в связи с тем, что он часто применяется в качестве индивидуального растворителя или в составе смешанных растворителей гидрофобных веществ (жиров, смол, каучука и др.), он пригоден в качестве компонента ПФ для ВЭЖХ, совмещенного с ИК-спектроскопическим детектором.
Результаты
компьютерной оптимизации параметров
регрессии (89), выполненной в оболочке
Maple
V
Power
Edition,
для ряда растворов на основе СCl4
приведены в табл. 60. Для примера на рис.
39 показаны экспериментальные точки и
кривая, полученная с применением
регрессионной модели. Найденные параметры
аппроксимации (89)
 в табл. 60
ранжированы по критерию гидрофобности
2-го компонента системы «СCl4
‒ органический
растворитель» (СlogP).
Все экспериментальные данные взяты из
справочника [38], а показатель гидрофобности
растворителей СlogP
рассчитан по алгоритму BioBite®
[15]. Во втором столбце табл. 60 приведены
области относительных массовых
концентраций (mA)
органического растворителя, в которых
наблюдается азеотропия. Поскольку
экспериментальные данные по азеотропным
составам нередко различаются, в таблице
приведены их минимальные и максимальные
значения. Результаты расчетов
свидетельствуют о значимой линейной
корреляции параметра регрессии
с величиной критерия гидрофобности
СlogP
(рис. 61):
в табл. 60
ранжированы по критерию гидрофобности
2-го компонента системы «СCl4
‒ органический
растворитель» (СlogP).
Все экспериментальные данные взяты из
справочника [38], а показатель гидрофобности
растворителей СlogP
рассчитан по алгоритму BioBite®
[15]. Во втором столбце табл. 60 приведены
области относительных массовых
концентраций (mA)
органического растворителя, в которых
наблюдается азеотропия. Поскольку
экспериментальные данные по азеотропным
составам нередко различаются, в таблице
приведены их минимальные и максимальные
значения. Результаты расчетов
свидетельствуют о значимой линейной
корреляции параметра регрессии
с величиной критерия гидрофобности
СlogP
(рис. 61):
 (93)
(93)
Коэффициент
парной корреляции для уравнения (3)
R=0.85.
В соответствии с уравнением (93) уменьшение
гидрофобности, и соответственно,
увеличение полярности растворителя,
приводит в уменьшению параметра
неаддитивности
.
При этом наблюдается тенденция к
образованию азеотропных систем этого
растворителя с СCl4.
Так, для малополярных гидрофобных
растворителей (ClogP
>1) азеотропия с СCl4
не характерна,
и отклонения от закона Рауля
незначительны ( К). В противоположность этому для
смесей, например, со спиртами (СlogP<0.75),
образующими между гидроксильными
группами водородные связи и дающими
значительное, в максимуме достигающее
величины порядка 10 К, отклонение от
закона Рауля, азеотропия наблюдается.
Таким образом, корреляция критерия
гидрофобности СlogP
и параметра регрессии
позволяет использовать эти величины
в качестве прогнозных параметров,
указывающих на возможность образования
азеотропных составов.
К). В противоположность этому для
смесей, например, со спиртами (СlogP<0.75),
образующими между гидроксильными
группами водородные связи и дающими
значительное, в максимуме достигающее
величины порядка 10 К, отклонение от
закона Рауля, азеотропия наблюдается.
Таким образом, корреляция критерия
гидрофобности СlogP
и параметра регрессии
позволяет использовать эти величины
в качестве прогнозных параметров,
указывающих на возможность образования
азеотропных составов.

Рис. 60. Зависимость взятого с обратным знаком значения неаддитивной поправки для раствора «СCl4 – метанол» от относительной концентрации метанола n в сравнении с экспериментальными данными

Рис. 61. Корреляция параметра и критерия гидрофобности для систем «СCl4 – органический растворитель»

Рис. 62. Зависимость экспериментального значения неаддитивной поправки для системы «СCl4 – 1,1,2-трихлорэтилен» от мольной доли 1,1,2-трихлорэтилена.
Таблица 60. Результаты расчетов параметров гармонической трехпараметрической аппроксимации неаддитивной поправки для гомогенных растворов «СCl4 – органический растворитель» и критерия гидрофобности органического растворителя СlogP [43].
Растворитель |
СlogP |
mА |
- |
α |
ne |
σ |
σn |
Метанол |
-0,87 |
0,20-0,23 |
18,26 |
33,85 |
0,11 |
0,36 |
0,019 |
Этанол |
-0,24 |
0,10-0,16 |
12,92 |
1,31 |
0,31 |
0,27 |
0,021 |
Ацетон |
-0,21 |
НА* |
9,37 |
7,93 |
0,16 |
0,099 |
0,011 |
Аллиловый спирт |
-0,10 |
0,12-0,21 |
15,15 |
4,77 |
0,2 |
0,41 |
0,027 |
Изопропанол |
0,07 |
0,18 |
12,25 |
7,71 |
0,85 |
1,01 |
0,082 |
1-Пропанол |
0,29 |
0,08-0,12 |
12,76 |
6,67 |
0,19 |
0,81 |
0,063 |
Этилацетат |
0,71 |
0,21-0,43 |
2,69 |
1,77 |
0,47 |
0,23 |
0,085 |
1-Бутанол |
0,82 |
НА |
10,62 |
3,16 |
0,07 |
0,23 |
0,022 |
Метиленхлорид |
1,25 |
НА |
9,88 |
4,47 |
0,06 |
0,44 |
0,044 |
1,1-Дихлорэтан |
1,78 |
НА |
4,37 |
2,31 |
0,1 |
0,047 |
0,011 |
Хлороформ |
1,95 |
НА |
1,90 |
1,1 |
0,5 |
0,021 |
0,011 |
1,1,2-Трихлорэтан |
2,05 |
НА |
9,61 |
6,36 |
0,11 |
0,11 |
0,011 |
Бензол |
2,14 |
НА |
0,76 |
3,99 |
0,22 |
0,022 |
0,029 |
Трихлорэтилен |
2,63 |
НА |
0,64 |
3,47 |
0,31 |
0,19 |
0,29 |
Циклогексан |
3,35 |
НА |
0,09 |
2,85 |
0,31 |
0,037 |
0,41 |
*) НА – неазеотропные системы
Как видно из табл. 60, неаддитивная поправка для всех исследованных систем принимает только отрицательные значения. Наличие отклонения от закона Рауля порядка 10 К может оказывать значительное влияние на процессы, происходящие с бинарными растворителями, Столь заметное отклонение может свидетельствовать о значительном нарушении пространственной однородности раствора на наноуровне при сохранении глобальной гомогенности.
В последних колонках табл. 60 приведены абсолютные и нормированные на максимум значения среднеквадратичного отклонения аппроксимации от экспериментального массива. Анализ этих данных свидетельствуют о том, что даже максимальная относительная погрешность аппроксимации (1.7) экспериментальных массивов равномерно меньше 8.5%, а для большинства растворов не превышает 5%. Это свидетельствует об адекватности регрессионной модели описываемой системе, тем более что в значительной мере величины погрешностей определяются не регрессионным описанием, а экспериментальными погрешностями. Этот факт наглядно виден из рис. 62, на котором продемонстрировано нерегулярное поведение зависимости поправки от относительной концентрации компонентов. Эти нерегулярности свидетельствуют о заметном вкладе стохастических процессов в экспериментальные данные. Отсюда следует вывод о необходимости совершенствования техники и методики экспериментальных исследований фазового равновесия таких систем. С другой стороны необходимы и теоретические исследования, направленные на выделение детерминированной части эмпирических данных.
Таким образом, можно заключить, что регрессионные модели, в которых использовано выделение слагаемого, билинейного по концентрациям и температурам кипения компонентов, позволяет адекватно описать изобары «состав – температура кипения» с достаточной точностью не только для гомогенных водно-органических бинарных систем [41], но и для органических бинарных систем, как показано на примере систем тетрахлорметан – органический растворитель [43]. Параметр неаддитивности в предложенной регрессионной модели коррелирует с величиной гидрофобности 2-го компонента, а его абсолютные высокие значения указывают на возможность образования гомогенных азеотропных составов.
