
Тимин биохимия
.pdf
Аминокислоты ибелк |
и |
|
|
|
|
|
20 |
||
|
|
|
|
|
|
|
|||
3П. охимическомусо |
ставу |
|
|
|
|
|
|||
Простые – содержтольковсоставе |
аминокислоты (альбум,глобули, ,стоныны |
|
|
|
|||||
протамины) |
.Подробноэтибелкихарактеризуютсяниже. |
|
|
|
|
|
|||
Сложные – кромеаминокисимеютсянебелковыекомпонот нты |
|
|
(нуклеопротеины, |
||||||
фосфопротеины,мета,липопротеинылоп,х мопр,глик)П. протеины |
|
|
|
|
о- |
||||
дробноэтибелки |
характеризуютсяниже. |
|
|
|
|
|
|||
|
|
|
К Л А С СП И Ф И К А Ц И Я Р О С Т Ы Х Б Е Л К О В |
|
|
|
|||
Структура простыхбелков |
представлтолькополипептиднойц альбуминнапью( , |
|
|
|
н- |
||||
сулин)Од. необходимоакоп ,ниматьчтомногиепрбелкистыенапример( ,альбумин)не |
|
|
|
|
|
|
|||
существуютчистом„ "виде, |
|
онивсегдасв |
язаныскакими |
-либонебелковымивещест |
|
вами. |
|||
Ихотносяткпростымбелкам,.. |
|
связинебелковгруппойслабые. |
|
|
|
|
|||
|
|
|
|
АЛ Ь Б У М И Н Ы |
|
|
|
|
|
Группа глобулярных белков плазмыкрови |
смолекулярной массой 69 кДа,имеютки |
с- |
|||||||
лыесвойстваиотрицательныйзарядприф зиологических |
|
|
рН,т.к.содержатмногоглутам |
|
|
и- |
|||
новойкислоты.Легкоадсполярбинеполрныеуютмолекулы,являрные |
|
билирубина и жирныхкислот |
ютсявкровип |
|
е- |
||||
реносчикоммногихвеществ |
|
,впервуюочередь |
. |
|
|
||||
Вприродеальбумины |
|
входятсостав |
нетолькоплазмы |
кровисывороточные( |
альбу- |
||||
мины), |
нои |
яичногобелкаовальбумин( ),молокалактальбумин( |
|
), являются запасными бел- |
|||||
ками семянвысшихрастений.
|
ГЛ О Б У Л И Н Ы |
|
|
|
|
|
Группаразнообразныхбелков |
плазмыкрови |
смолекулярноймассойдо |
100 кДа, несут |
|||
отрицательныйзаряд, |
слабокислые илиней |
тральные.О |
ни мало гидратированы, |
посравн |
е- |
|
нию сальбуминамименьше |
устойчивы врастворе илегчеосаждаются,чтоиспользуетсяв |
|
|
|
||
клиндиагностикечев„ адочныхкой"пробах( |
|
тимоловая проба, проба Вельтмана)Ч. |
а- |
|||
стодержатуглеводныекомпон. нты |
|
|
4фракции – α1, α2, β и γ. |
|
||
При обычном электрофорезеразделяются,какми,нимум |
|
|
||||
Таккакглобулинывключаютсебяразнообразныебелки,тоих |
|
|
функции многочис- |
|
ленны. |
Часть α-глобуобладаетантипротеазнойиновак |
|
тивностью,чтозащищаетбелкикр |
о- |
виотпреждевремразрушенияного |
,например, |
α1-антитрипсин, |
α1-антихимотрипсин, |
|

biokhimija.ru ТиминО.А. Лекции по общей биохимии (2018г) 21
α2-макроглобулин. Некоторые глобулины способныксвязываниюопределенныхвеществ: |
|
), гапто- |
||||||
трансферрин (переносчик ионовжелеза |
), церулоплазмин (переносчик ионовмеди |
|||||||
глобин (переносчикгемоглобина), |
|
гемопексин (переносчиктема). |
γ-Глобуявлиныяются |
|
||||
антителами иобеспечиваютиммуннуюзащитуорганизма. |
|
|
|
|
|
|
|
|
|
|
|
ГИ С Т О Н Ы |
|
|
|
||
Гистоны – внутриядерныеб |
елкимассой |
около 24 кДа.Обладвыросноаютженными |
|
в- |
||||
нымисвойствами, |
поэтому приф зиологических |
значениях рНзаряженыположительно |
|
|
||||
связываются дезоксирибонуклеиновойкислотойДНК() |
|
,образуядезоксирибонуклеопрот |
|
е- |
||||
ины.Существуюттиповгистонов5 |
|
|
– оченьбогат |
ый лизином (29%) гистон Н1 , другие |
и- |
|||
стоны Н2а , H2b, НЗ, Н4 богаты лизиномаргининомв(суммедо25%) |
. |
Радикалыаминвсоставегистоновкислотмогутбыметилированыь, |
ацетилированы |
фосфорилирова.Этоизменяетсуммарзарядсвойстваугиеныбелков. |
|
|
Можновыдвеелить |
|
функции гистонов: |
|
|
|
|
|
||
1. Регулируютактивностьгенома |
|
,а именно препятствуюттранскрипции |
|
|
. |
|
||||
2С. труктурная – стабилизируют пространственнуюструктуру |
ДНК. |
|
|
|
||||||
|
Гистоныобразуют |
|
нуклеосомы – октаэдрические структуры, |
составленныеизгист |
о- |
|||||
нов Н2а , H2b, НЗ, |
Н4 . ГиH1стонвязансмолекул |
ойДНК,непозвейс"оскользнутьляя" |
|
|
||||||
гистоноктамера.ДНКвогобвиванукл2,5разаепослемутчегобвиваетследующую |
|
|
|
|
|
|
||||
нуклеосому. |
БлагодарятакойструктуредостигаетсяуменьшразмДНКровние |
|
|
|
|
враз7 |
. Да- |
|||
лее нитьДНКснуклеосомамискладываетсясуп |
|
ерспираль "суперсуперспираль". |
Таким |
|||||||
образом,гистоны |
|
участвуют в плотной упаковкеДНК |
при формировании хромосом. |
|
||||||
|
Благодарягистонам |
|
вконечномитоге |
размерыДНКуменьшаютсявтысячираз: |
|
|
|
|
||
|
длинаДНКдостигает6 |
–6). |
-9см(10 |
–1),аразмерыхромосом |
|
– всего несколькоми |
к- |
|||
|
рометров(10 |
|
|
|
|
|
|
|
||
|
|
|
|
|
ПР О Т А М И Н Ы |
|
|
|
|
|
|
Этоб елкимассой |
от4 кДа до 12 кДа, имеютсяв |
ядрахсперматозоидов |
многих орга- |
||||||
низмов,вспермерыбонисоставляютосновнмассбелка.Протаминыую |
|
|
|
|
являются замени- |
|||||
телями гистоновслужатдляорганизацхроматв иина |
|
спермиях. Посравнениюгистон |
а- |
|||||||
протаминыотличаютсярезкоувеличсодаерннымгининажаниемдо(80%)Также,во . |
|
|
|
|
|
т- |
||||
личотгистонов,протаминыеобладаюттолькоструктурнойфункцией,регулирующей |
|
|
|
|
|
|
||||
фууннетихкции,хром |
|
|
атинвспермнеактивен.тозоидах |
|
|
|
|
|
||
|
|
|
|
|
КО Л ЛА Г Е Н |
|
|
|
|
|
|
Фибриллярныйбелоксуникальнойструктур.Составляетосновумежклеточногой |
|
|
|
|
|
е- |
|||
ществасоединительнойтканисухожил,кости,хряща,кожи, ймеется,конечно,ивдр |
|
|
|
|
|
у- |
||||
гихтканях. |
|
|
|
|
|
|
|
|
|
|

Аминокислоты ибелк и |
|
|
|
|
|
|
22 |
|
|
|
|
|
|
|
|||
Полипептиднаяцепьколлаг |
енавключает1000амииноназваниескαслот |
|
|
|
-цепь. |
|||
Насчитываетсяоколовариантовα30 |
|
-цепиколлагена,новсеониоблоднимобщимдают |
|
|
|
|
||
признаком – вбольшейилименьшстепвключаютений |
|
повторяющийся триплетГли[ |
-Х-Y], |
|||||
где X и Y – любые,кромеглицина |
, аминокислоты.В |
положении X чащенаходится |
пролин |
|||||
или,гор,ежеаздо3 |
-оксипр,впололинжении |
Y встречаетсяпролин4 |
-оксипролин.Также |
|
|
|||
вположении Y частонаходаланин, зинтся5 |
|
-оксилизин.Н |
а другие аминокислотыпр |
и- |
||||
ходится околотретиотвсегоколичествааминокислот |
|
. Гидроксилированиепрол |
ина илизина |
|||||
осуществляют соответствующие гидроксилазы, железосодержащиефермент |
ы, для их пол- |
|||||||
ноцеработынеобходимнойвитаминСаскорбиновая( кислота). |
|
|
|
|
|
|
|
|
Структураприоксипролинаапозволяетобразовать |
|
|
|
α-спиральнструктуру, ю |
|
|
||
из-заэтогообразуется |
левозакспи,гденародученнаяальвиприходитсятокаминоки3 |
|
|
|
|
|
с- |
|
лотныхостатка. |
Коллаген |
бычносодержитмоносахаридныегалактоза( )дисахаридные |
|
|
|
|
||
(глюкоза-галактоза) молекулы,соединенныеОН |
-группаминекоостатковорых |
|
оксилизина. |
|||||
Молекула тропоколлагепостроенаиз3 |
α-цепей,сплетенныхмеждусобойвплотный |
|
|
|
||||
жгут – тропоколлагендлина( |
300 нм, диаметр 1,6нм)Поли. цепиептидрочносвязаные |
|
|
|
||||
междусобойчерез |
ε-аминогруппыостатклизина.Тропвф коллагрмируетн |
|
|
|
крупныеко |
л- |
||
лагеновыефибриллыдиаметром |
|
10-300нм.Поперисчечнаярче |
|
нностьфибрилобуслоы |
|
в- |
||
ленасмещениеммолекултропоколлагенадруготносительнодруга1/4ихдлины.
Времяполужизисчисляетсяколлагненаделямимесяцами.Ключевуюрольего |
|
|
|
||
обменеиграколл,расщепляющаят геназатропоколлагенна1/4расстоянияС |
|
-концаме |
ж- |
||
ду глицином и лейцином. |
Врезультатераспадаколл гена |
поясвободныйляется |
гидрокси- |
||
пролин. |
Припоражении |
соединиттканибол( Пе,льнойзньгиперпаратиреоидизмйджета) |
|
|
|
экскрециягидроксипролинавозрастаетимеетдиагностическоезначение.
biokhimija.ru ТиминО.А. Лекции по общей биохимии (2018г) 23
Померестаорганизмаениявтропоколлагенеобразуетсявсебольшеечислопоп ре |
|
|
ч- |
|
ныхсвяз,чтодефибриллаетй |
лыколлагенавсоединитткболжесткимихруельной |
п- |
||
кими.Этоведеткповышеннойломкостисн прозрачностижениюговицылаза |
|
|
|
|
старческомвозрасте. |
|
|
|
|
|
|
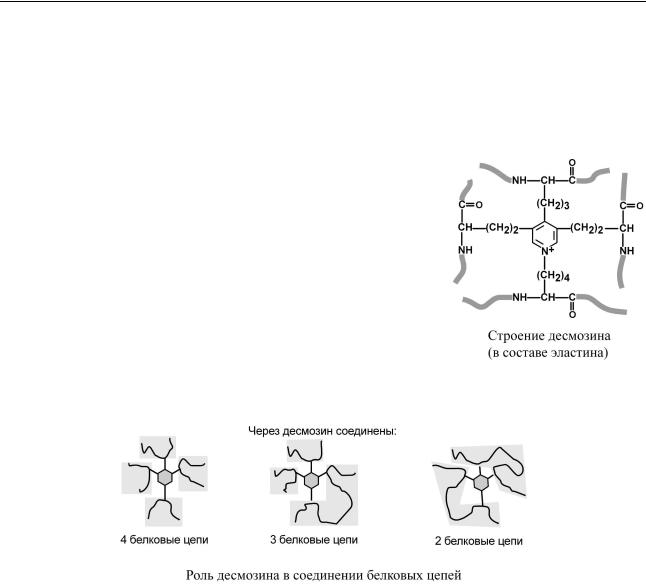
ЭЛ А С Т И Н |
|
|
Построениюв |
общихчертах |
эластин схожколлаг |
е- |
|
ном.Находитсявсвязках,эл |
астичномсло.Струесудов |
|
к- |
|
турнойединицейявляетсятропоэластин |
|
молекулярной |
||
массой 72 кДа идлиной800аминокислостатк.В овтных |
|
|
||
немгораздобольшелизина,валина, меньшенинаги |
|
|
д- |
|
роксипролина.Отсутствие |
|
обусловливаетналичие |
||
спиральныхэласт |
ичныхучастков. |
|
|
|
Характернойособенностьюэластинаявляется |
|
|
форми- |
|
рованиеизчетырмоллизинаекулх |
|
своеобразнойструктуры |
|
|
– десмозина, который своими4 |
-мягруппами |
объединяет |
||
белковыецеписи,стпособныерастягиватьсямывовсех |
|
|
|
|
направлениях. |
|
|
|
|
α-Аминогруппы α-карбоксильныегруппыдесмозина |
|
|
||
включаютсяпептидны |
е связи одной илинесколькихбе |
л- |
||
ковыхцепей . |
|
|
|
|
|
С Т Р ИОКЕЛНАИСЕС И Ф И К А |
Ц И Я С Л О Ж Н Ы Х Б Е Л К О В |
|
||||||
|
У сложных белкбелковой,кромец,имепи |
|
етсядополнительнаянебелковаягруппа. |
|
|
||||
Онаназывается |
лиганд, (лат. ligo – связываю) тоестьмолекула |
, связаннаябелком. |
|
Всл у- |
|||||
чаееслилиганднесетструкти/илифункциональнуюрагру, зываетсяку |
|
|
|
|
просте- |
||||
тическойгруппой |
. |
|
|
|
|
|
|
|
|
|
В роли лиганда могут выступать любыемол кулы |
: |
|
|
|
||||
o |
молекулы, выполняющиебелкеструктурнуюфункцию |
|
|
– липиды,углеводы, |
нукле- |
||||
|
иновыекислоты,минеральэлементы,какиеые |
|
|
|
-либодругиеорганические |
соединения: |
|||
|
гемвгемо,углвгликопротеинахеводыобине,ДНКРНК |
|
|
внуклеопротеинах,медьв |
|
||||
|
церулоплазмине, |
|
|
|
|
|
|
|
|
o |
переносимые белкамимолекулы |
: железовтрансферрине,гемоглобин |
|
вгаптоглобине, |
|||||
|
гемвгемопексине |
, |
|
|
|
|
|
|
|
o |
субстратыдляферментов |
|
– любыемолидажедругиекулыбелки. |
|
|
|
|
||
|
Узнаваниелиганда |
|
обеспечивается: |
|
|
|
|
||
o |
комплеменцентраностьюструксвязтубелкарыструктуреваниялиганда, |
|
|
|
|
иначе |
|||
|
говоря, пространственнымихимическсоответствиембелкаганда |
|
|
|
.Ониподходят |
||||
|
другкдругу |
какключ |
к замку,н апример, соответствиеф ирменсубс, трата |
|
|
||||

Аминокислоты ибелк и |
|
|
|
|
|
24 |
||
|
|
|
|
|
|
|
|
|
o |
иногдаузнавможетзависетьотниереакционнойспособностиатома,которому |
|
|
|
|
|
|
|
|
присоединяется лиганд.Например, |
связываниекислородаже |
|
лезомгемоглобина,или |
|
|||
|
жирнойкисалотыьбумином |
. |
|
|
|
|
|
|
|
Функции лиганда всосложноготавебелкаразн: образны |
|
|
|
|
|||
o |
изменяетсвойсбелковза(,растворимостьваяд,термолабильность) |
|
|
|
, например,фо |
с- |
||
|
форнаякислотавфосфопротеи |
нахилиостаткимоносахаридовгликопротеинах, |
|
|
|
|||
o |
защищает белокпротеовнеивнутриклеткииза |
|
|
|
, например, |
углеводнаячасть |
в |
|
|
гликопротеинах, |
|
|
|
|
|
|
|
o |
обеспечиваетвозможностьтранерастворспортаводесо ,напримерд ,нениймых |
|
|
|
|
|
|
|
|
перенжировс |
липопротеинами, |
|
|
|
|
|
|
o |
придаетбиологактическуювность |
|
иопределяетфункциюбелка,наприм,нуклер |
|
|
и- |
||
|
новаякислотануклеопротеинах |
, гемвгемоглобине, |
углврецепторныхводбелках, |
|
|
|||
o |
влияетнапроникновениечерезмембраны,внутр ,клесорграцтиочнуюровку |
|
|
|
|
|
||
|
секрециюбелков |
, этовыполняет,какправило,углеводныйостаток. |
|
|
|
|
||
|
|
|
ФО С Ф О П Р О Т Е И Н Ы |
|
|
|
|
|
|
Фосфопротеины – этобелки,вкоторыхприсутствуетфосфатнсвязываегрупп,она а |
|
|
|
т- |
|||
сяпептиднойцепьючерезос ирозатки,сер,треонина..(техаминокислот,кот |
|
|
|
|
|
о- |
||
рыесодержатОН |
-группу). |
|
|
|
|
|
|
|
Фосфорнаякислотаможетвыполнять: |
|
|
|
||
1Структурную. |
роль,придза,раядваястворимостьизменяясвойствабелка |
, например, |
в |
||
казеине молока, яичном альбумине. |
|
|
|||
2Функциональную. |
роль.Вклеткеприсутствуетмногобелков, связаныторыефосф |
|
а- |
||
том непо стоянно,авзависиактивностиот метаболизма.Белокможетмногократно |
|
|
|||
переходитьвфосфорилвдефосилированнуюформуилированную |
,что играетрег у- |
||||
лирующуюрольв |
|
его работе. |
Например, 1) |
ферменты гликогенсинтаза и гликогенфос- |
|
форилаза (смРегуляци" |
яактивностиферментов") |
, 2) гистоны вфосфорилированном |
о- |
стоямепрочносвязываютсяииееДНКиактигенностьозрастма |
|
ает. |
|
|
НУ К Л Е О П Р О Т Е И Н Ы |
|
|
Нуклеопротеины – этобелки,связанныенуклеинкисл.Онисоставляютвымитами |
|
|
|
существеннуючастьрибосом, |
хроматина,вирусов. |
|
|
Врибосомах рибонуклеиновая кислотаРНК()связываетсясоспецифическимириб |
о- |
||
сомальнымибелками. |
|
|
|
Вирусыявляютсяпрактическичистымирибо |
|
- идезоксирибонуклеопротеинами. |
|
В хроматине нуклеиноваякислотапредставлена |
дезоксирибонуклеиновой кислотой, |
||
связразнообразнымийбел,средикотожновырыхдосновныевеелитьгруппы |
|
|
|

biokhimija.ru |
ТиминО.А. |
Лекции по общей биохимии (2018г) |
25 |
||
|
|
|
|
|
|
– гистонынегистоновыебелки.НачальныйэтапупаковкиДНКосуществляютг ,стоныб |
|
|
|
о- |
|
леевысуровникиебеспечиваютсядругимибелками. |
|
|
|
|
|
ВначамоДНКлеокула |
бвиваетсявокруггистонов,образуянуклеосомы.Сформир |
|
о- |
||
ваннаятакимобразом |
нуклеосомнаянить |
напоминаетбусы,которыескладываются |
у- |
||
перспирхром( атиноваяль |
фибрилла) исуперсуперспираль( |
хромонемма интерфазы). |
|
||
Нуклеиновыекислотыявляютсяполимернымимолекуламисостиз ,номеровят называемых нуклеотидами.Н уклеотидсодержитфосфкисло(,рнуюдватлири ост),ариботкахар( илидезоксирибу),азотистоснованаденин( ,гуанинзу,ц ,етозин урацилли ботимин).
|
Самымраспроствприроданенным |
является нуклеотид аденозинтрифосфат, исполь- |
зуемыйкаквысокоэнергтрансмембранногочсоедляреакцин ипереносайскоев |
е- |
|
ществиреакцийсинтеза. |
|
|
|
Связываясьчерезфосфатныеостатки,нуклеотиды |
|
образуютдлинныецепочки |
– нуклеинкислоты. в е |
|
|
Выделяютвидануклеиновых |
кислот взавис и- |
мопентсти,вховихдящейзысостав |
– рибонуклеи- |
|
новаякислотаРНК()дезоксирибонуклеиноваякислота |
||
(ДНК). |
СахарофосфатныйостовДНКиРНКзаряжен |
|
отрицательно благодазарядуфосфатныхгрупп.Втоя |
||
жевремяпуриновыепиримидиновыеоснования |
гид- |
|
рофобны. |
|
|

Аминокислоты ибелк |
и |
|
|
26 |
|
|
|
|
|
||
ЦепиДНКРНКоблнадаютправл,.е.именностьюют |
3'-конеци5 |
'-конец.ВДНК |
|
||
цепиантипараллел |
ьны,т.е.напврасторонызныевлены |
.Имеетсякомп |
лементарность азо- |
||
тистых оснований, |
соответствие аденинкомплементарентимину( |
А=Т ), гуанинкомплеме |
н- |
||
таренцитозину( |
Г≡Ц) . |
|
|
|
|
|
|
|
|
ЛИ П О П Р О Т Е И Н Ы |
|
Клипоп,стговоряро,принадтеинамтолькобе,содержащиеежаткиковалентно |
|
||||
связанныелипиды. |
Однтрадклипоциопртниноадмолекулярныетеинамсятобр |
а- |
|||
зования, |
выполняющиетранспортнуюфункциюсостоящиеизбелков |
и молекулвсехкла |
с- |
||
совлипидов – транспортные липопротеины. |
|
||||
Структуру транспортных липопро- |
|
||||
теиновможносравнитьорехом, |
|
|
укот о- |
|
|
рых имеетсяскорлупаядро. |
"Скорлупа" |
|
|||
липопротеина |
являетсягидрофильной, |
|
|
||
ядро – гидроф.Ядрформируютбное |
|
|
|
||
неполярные эфирыхолестерола |
и триа- |
|
|||
цилглицеролы.Вповерхностномсл |
ое |
|
|||
("скорлупе") |
находятся |
фосфолипиды, |
|
||
свободный холестерол, белки. |
|
|
|||
Белкив |
липопротеинахназываются |
|
|
||
апобелками,ихвыдн скольколяютв |
|
и- |
|
||
дов:А,В,С |
|
и D.Вкаждомтипелип |
|
о- |
|
протеинпреобладаютсо тветс ву |
|
ю- |
|
||
щиеемуапобелки. |
|
|
|
|
|

biokhimija.ru |
|
ТиминО.А. |
Лекции по общей биохимии (2018г) |
27 |
||||||||
|
|
|
|
|
|
|
|
|
||||
|
|
Выделяютчетыре |
|
основных классалипопротеинов: |
|
|
|
|
||||
o |
хиломикроныХМ() |
|
, |
|
|
|
|
|
|
|
||
o |
липопротеины высокой плотности (ЛПВП, |
α-липопротеины, |
α-ЛП) , |
|
|
|||||||
o |
липопротеины низкой плотности (ЛПНП, |
|
β-липопротеины, |
β-ЛП) , |
|
|
||||||
o |
липоченьпротеинизкплотЛПОНП(йн,преостиы |
|
|
-β-липопротеины,пре |
-β-ЛП). |
|||||||
|
|
Липопротразличаютсясоставу,е..поинысоо ношениюриацилглицер |
|
|
|
|
|
олов,хол е- |
||||
стеролаиегоэфиров, |
фосфолипидов,белков : |
|
|
|
|
|
|
|||||
|
|
Типылипопротеинов |
|
Понаправлениюсверхувниз |
|
|
|
|
||||
|
|
|
происходитизменени е состава: |
|
|
|||||||
|
|
|
|
|
|
|
|
|
||||
|
Хиломдо(90%и)кроныпидов |
|
|
|
Увеличениеколичествабелка |
|
|
|
|
|||
|
ЛПОНП |
|
|
|
Увеличениеколичествафосфолипидов |
|
|
|
||||
|
ЛПНП |
|
|
|
Уменьшениеколичестватриацил |
|
|
- |
|
|||
|
ЛПВПдо(80%белков) |
|
|
|
глицеролов |
|
|
|
|
|||
|
|
|
|
|
|
ХР О М О П Р О Т Е И Н Ы |
|
|
|
|
||
|
|
Хромопротеиныс |
одержатокрашенныепростетичгруппы.Сюдаотносятескиемопр |
|
|
|
|
|
о- |
|||
теинысод( г),ретинальпротеинымржатсодержат( витаминА),флавсодержат( протеины |
|
|
|
|
|
|
|
|||||
витаминВ |
2),кобамисодержат( витаминпротеиныВ |
|
|
12). |
|
|
|
|
||||
|
|
|
Гемопротеины |
|
|
|
|
|
|
|||
|
|
Подрннефазделяютсярментативгемоглоби( , ные |
|
|
|
|
|
|
|
|||
миоглобин)фермецитохромы( ,каталазаты,пероксид |
|
|
|
|
а- |
|
|
|
|
|||
за)Небелковой. частьюихявляетсягем |
|
|
– |
структура, |
|
|
|
|
||||
включающаясебяпорфиринкольцосост( из4оящеевое |
|
Fe2+.Желез освязывается |
|
|
|
|
||||||
пиррольныхколец)иона |
|
|
|
|
|
|||||||
порфиринкольцдвумяовымрдинационнымидв |
|
|
у- |
|
|
|
|
|||||
мяковалентнымисвя |
зями. |
|
|
|
|
|
|
|
||||
|
|
|
|
Цитохромы |
|
|
|
|
|
|
||
|
|
Цитохромы отличаютаминсокислтавяотным |
|
|
|
|
|
|
||||
пептцепейчисдных |
|
ломцепейир |
азделяютсянатипы |
|
|
|
|
|||||
а, b,с, |
d. Всеонеспособныисвязыватькисл,кр родме |
|
|
|
|
|
|
|
||||
цитохрома 3,котсодержрыйионымед.Циитохромы |
|
|
е- |
|
|
|
|
|||||
наховсоставедятсяыхательнцмитохпиц ондрий |
|
|
|
|
|
|
|
|||||
пимикросомальногоокисления. |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
Флавопротеины |
|
|
|
|
||
|
|
Флавопротеиныя |
вляютсяферме |
н- |
|
|
|
|
|
|
||
тамиок слительно |
-восстановительных |
|
|
|
|
|
|
|||||
реакций, |
например, |
|
сукцинатдегидро- |
|
|
|
|
|
|
|||
геназа, |
глицерол-3-фосфатдегидро- |
|
|
|
|
|
|
|||||
геназа.Онивкачнествебелковойчасти |
|
|
|
|
|
|
|
|
||||
содержатпроизводныевиВамина |
|
|
2 – |
|
|
|
|
|
|
|||
флавинмононуклеотидФМН() |
|
и- |
|
|
|
|
|
|
||||
надениндинуклеотидФАД(). |
лавинаде- |
|
|
|
|
|
|
|||||
ниндинуклеотидпредставляеткомплекс |
|
|
|
|
|
|
|
|||||
издвнухклеотидов |
|
– аденозинмоно- |
|
|
|
|
|
|
||||
фосфатаи |
флавинмононуклеотида. |
|
|
|
|
|
|
|
||||
Аминокислоты ибелк |
и |
|
|
|
|
|
28 |
||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
МЕ Т А Л Л О П Р О Т Е И Н Ы |
|
|
||
|
Металлопротеины, кромебелка |
, содержати ныдногоилинесколькихметаллов. |
|
Ме- |
|||||
таллопротеины частоявляются |
ферментами.Ионыметалловсоединеныкоординационными |
функции: |
|||||||
связямифункциональнымигруппам |
|
ибелка |
и выполняследующиет |
||||||
o |
участвуюториентасубстратаактциентфевноми,рмеента |
|
|
|
|
|
|||
o |
входятвсостав |
активного центра фермента иучаствуюткатализе,например, |
лужат |
||||||
акцептэлектроновнарамипределеннойстадииферм нтативнойакции |
|
|
|
. |
|||||
|
К металлопротеинам,например,относятсябелки,содержащие: |
|
|
|
|
||||
o |
медь – цитохромоксидаза,вкомплекседругифердыхательнойентамицепи |
|
|
||||||
митохондрийучаствусинтезеАТФ, |
|
|
|
|
|
|
|
|
|
o |
железо – ферритин,депонирующийжелезовклетке |
|
|
, трансферрин,переносящий |
|||||
железовкрови |
, сукцинатдегидрогеназа (ферментЦТК), |
|
|
||||||
o |
цинк – алкогольдегидрогеназа, обеспечивающаям |
етаболизмэтаноладругспих |
р- |
||||||
тов, лактатдегидрогеназа, участвующаяметаболизмемолочнкислоты, й |
|
|
карбоан- |
||||||
гидраза,образующаяуголь |
|
нуюкислотуиз |
CO2 и H2O, щелочная фосфатаза, гидроли- |
||||||
зующаяфосэфоирные |
|
|
различныхсоединений |
. |
|
|
|||
o |
селен – тиреопероксидаза,участву |
ющаяв |
синтезегормоновщитовиднойжелезы, |
|
|||||
антиоксидантныйфермент |
глутатионпероксидаза, |
|
|
||||||
o |
кальций – α-амилаза слюныипанкреатическогосока,гидролизующаякрахма |
|
л. |
||||||
|
|
|
ГЛ И К О П Р О Т Е И Н Ы (ГЛИКОКОНЪ Ю ГАТЫ ) |
|
|||||
|
Гликопротеины – белки,содержащиеуглеводныйкомпонент,ковалентноприсоед |
|
|
и- |
|||||
ненныйкполипептиднойосн.С веуглевржанварьотдов1и85%поруетмассе. |
|
|
|
|
протеогликаны и гликопро- |
||||
|
Выделяютдваподкбе,содержащихассаковуглеводы: |
|
|
|
|
||||
теины.Междуэти |
ми подклассамиимеютсясущественныеотличия: |
|
|
|
|
||||
Гликопротеины |
|
|
|
|
Протеогликаны |
|
|||
o |
доляуглеводов |
15-20%, |
|
o |
доляуглеводов 80-85%, |
||||
o |
несодержатуроновыхкислот |
|
, |
o |
имеютсяуроновыекислоты |
, |
|||
o |
углеводцеписоднеболееыержат |
|
|
o |
углеводныецепикрайневе |
лики, |
|||
15звеньев , |
|
|
|
|
o |
углеводимр гулярноеет |
строение. |
||
o |
углеводимн етрегулярное |
|
строе- |
|
|
|
|
||
ние. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Гликопротеины |
|
|
||
|
Длясобственногликопронизкоеуглеводовхарактерсодержаниено.Углеводный |
|
|
|
|
||||
остатокявляетсяолигосахаридм,имнеетрегуля |
|
|
|
рноестроениесодержитманнозу,галакт |
о- |
||||
зу,глюкозу,иихаминопроизводные,такжеN |
|
|
-ацетилнейраминовуюкислоту. |
|
|||||
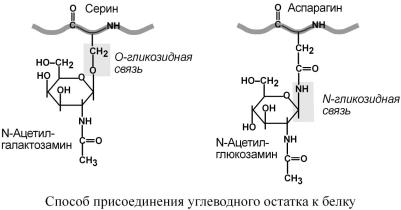
Олигосахарприсоедк иненд |
|
|
|
|
|
|
|
|
|
аминокислбелковойтам |
|
цепи |
|
|
|
|
|
||
либоN |
-гликозиднойсвязью |
– |
|
|
|
|
|
||
камидномуазотуаспарагина, |
|
|
|
|
|
|
|
|
|
либоО |
-гликозиднойсвязью |
– |
|
|
|
|
|
||
кгидроксигруппеостатк |
|
|
ов |
|
|
|
|
|
|
серина,треонина,гидрокс |
|
|
и- |
|
|
|
|
|
|
лизина. |
|
|
|
|
|
|
|
|
|
|
Функцией |
гликопроте- |
|
|
|
|
|
||
инов являются: |
|
|
|
|
|
|
|
|
|
1.Структурная – клеточная стенба,ктерийоа стный матрикс,например, коллаген,эластин .

biokhimija.ru |
|
ТиминО.А. |
Лекции по общей биохимии (2018г) |
|
29 |
|||
|
|
|
|
|||||
2. Защитная – например, антитела, |
интерферон, факторысверты |
ваниякрови |
(протромбин, |
|||||
фибриноген). |
|
|
|
|
|
|
|
|
3. Транспортная – перенос веществкровичерезмембраны |
|
|
,например, |
трансферрин, |
||||
транскортин,альбумин, N |
a+,К +-АТФаза. |
|
|
|
|
|
||
4. Гормональная – гонадотропный,адренокортикотропный |
и тиреотропныйгормоны . |
|||||||
5. Ферментативная – холинэстер,нуклеаз. аза |
|
|
|
|
|
|||
6. Рецепторная – присоединениеэффекизменениютв конформациирадит |
|
|
|
|
белка- |
|||
рецептора,чтовызываетвнутриклеточныйответ. |
|
|
|
|
|
|
|
|
|
|
|
Протеогликаны |
|
|
|
|
|
Другая группагликопротеинов |
– протеогликаны – характеризуетсяналичполиемс |
а- |
||||||
харидов,со |
стоящихизповторяющдисахаридныхостатковхся |
|
|
|
. |
|
|
|
Дисахаридывключаютсебяуроновуюкислотуаминосахар. |
|
|
|
Многократнод |
ублиру- |
|||
ясь,дисахаробразуютолигоды |
- иполисахаридныецепи |
– гликаны. Влитературе |
встреча- |
|||||
ются другие названия – кислые гетерополисахариды (т.к. |
|
имеют многокислотныхгрупп |
), |
|||||
гликозаминогликаны (содержатаминогруппы) |
. Этимолекулывходятсоставпротеогл |
|
и- |
|||||
канов – сложныхбелков,функциейкоторыхявля |
|
|
етсязаполнениемежклеточногопростра |
|
н- |
|||
стваиудержаниездесьводы,также |
|
нивыступаюткаксмазочныйиструктурныйкомпонент |
|
|
|
|||
суставовидругихтканевыхструктур. |
|
|
|
|
|
|
|
|
Углеводнаячасть,аналогичногликопротеинами,связываебелкомчерезос сяатки |
|
|
|
|
|
|
||
серинаасп. рагина |
|
структурных гликозаминогликанов являетсягиалур о- |
||||||
Основнымипредставителями |
|
|||||||
новаякислота,хондроитинсульфаты |
|
, кератансульфаты идерматансульфаты |
.Г епарин ис- |
|||||
пользуетсявантикоагулянтнойсистемекрови |
|
. |
|
|
|
|
|
|
По функции протеогликаныособенно |
|
значимыдлямежклеточногопространства, |
|
особенносоединиткани,вко ельнойорое |
|
погруженыколлагеновыеволокна. |
При по- |
мощи электронноймикроскопиивыяснено, |
|
что ни имеют древовидную структуру – в
центренаходитгиалуроноваякислот |
|
а, |
|
коточесвярезаябелкиующиеприсо |
|
|
еди- |
няетмногочисленныеветочки" "изхондр |
|
о- |
|
итинсульфатов,керата |
|
нсульфатов,дерм |
а- |
тансульфатов. |
Могликановекулывесьма |
|
|
гидрофильны,создаютсетчат |
ый желепо- |
||
добный матрикс изаполняютпространство |
|
||
междуклетками,являясь |
|
преградойдля |
|
крупныхмолекулимикроорганизмов. |
|
|
|
