
Тимин биохимия
.pdf
Обамениибелковокислот |
|
|
110 |
|
|
|
|
Дваатомауглерода |
аланина попадаютвЦТКпослетого,какбезазотистыйостаток |
|
|
аланина – пируват – окислитсявпируват |
-дегидрогеназномкомплексеобразованиемНАДН. |
|
|
Образованныйацетил |
-SКоАвходитЦТКполноокисляетсяводнтьюегобороте.Вм |
|
|
результатевдыхательнуюцепьна |
|
правлямол4 НАДНеитсякулымолекула1 ФАДН |
2. |

biokhimija.ru ТиминО.А. Лекции по общей биохимии (2018г) 111
Вслучае |
глутаматом надоучесть,что |
α-кет,оглутаратбраизглутаминовойемый |
|
||
кислоты,являетсяметабоцикКребса.Онлсразуитомпревсукцинилращается |
|
|
-SКоАи |
||
дал,порееакциямЦТК,воксалоацет |
|
ат.Дляокисленияоксалоацтребудваоборотаетатася |
|
||
ЦТКсм(выше). |
|
|
|
|
|
П Р Е ВАРМАИЩНЕОНКИИЕС Л |
О Т ПКОА Р БГОР КУ С И Л Ь Н О Й |
П П Е |
|||
Такоепревращениесвязаноудалениемкарбоксильнойгруппыаминокислоты |
|
б- |
|||
разованием биогенаминовых |
. |
|
|
||
|
|
|
|
ГИ С Т А М И Н |
|
Реакцияобразования |
гистамнаиболактивнодтучныхеклетках |
легких,кожи, |
|||
печени, |
в базофиэозиноф.Внилахгиситаминлахнтезируетсянакапливаетсясекр |
е- |
|||
торныхгранулах. |
|
|
|
|
|
Вкровьгистаминвыделяетсяприповрежткани,приуд, ареении |
|
|
|
|
при электрическом |
раздражен.Вклипрактническсекрецияг стамисвязанакеойбычноаллергиями |
|
|
|
– |
|
приповторпопаданииантигвранееомсенсибилизаоргазвиваетсязмрованный |
|
|
|
л- |
|
лергическаяреакция. |
|
|
|
|
|
Физиологическиеэффекты |
|
|
|
|
|
1Р. асширартериолкапилляровн |
|
и, каксле |
дствие, покраснениекожи, артержение |
и- |
|
альногодавления; |
|
|
|
|
|
2Повышение. проницаемостистенкикап лляров |
|
|
|
и, какследст,выходжидкостимие |
ж- |
клеточноепространство |
(о течность),снижениеартериальногодавления; |
|
|||
3Еслип. .п.1наблюдаются2 вголовноммозг |
|
|
|
е – повышениевнутричерепногодавления; |
|
4Увеличивает. тонусгладкихмышцбронхов |
|
|
, какследствие – спазмиудушье; |
|
|
5Слабо. повышаетмнус |
ышцжелудочно |
-кишечноготракта; |
|
||
6Стиму. секрециюслюнырует |
|
солянойкислоты |
желудочногосока. |
|
|
|
|
|
СЕ Р О Т О Н И Н |
|
|
Серотонинактсинтезируетсявнотучныхклеткахкожи, |
|
|
легких, |
печ,вселезенкени, |
|
ЦНС. |
|
|
|
|
|
Обамениибелковокислот |
|
|
|
|
|
|
112 |
|
|
|
|
|
|
|
|
Физиологическиеэффекты |
|
|
|
|
|
|
|
1Стимулирует. сокращениегладкихмышцжелудочно |
|
|
|
|
-кишечноготракта |
и,к акследств ие, |
|
повышениеперистальтикиЖКТ. |
|
|
|
|
|
|
|
2Выражено. стимулирусокращгладкихмышцениет |
|
|
|
кровеноссосудовтка,кроменяхых |
|
||
миоскелетныхардамышц |
|
|
, и,к акследствие,п |
овышартедавленияр. ального |
|
||
3Слабо. увеличиваеттонусг |
|
ладкихмышцбронхов. |
|
|
|
|
|
4Вцентральной. нервнойсистем |
|
|
еявляетсято |
рмозныммедиатором. |
|
||
5Впериферическокончаниях. нервных |
|
|
обусловливаетвозникновениеболизуда |
|
|||
(нап, рукуинасекомыхмер). |
|
|
|
|
|
|
|
|
|
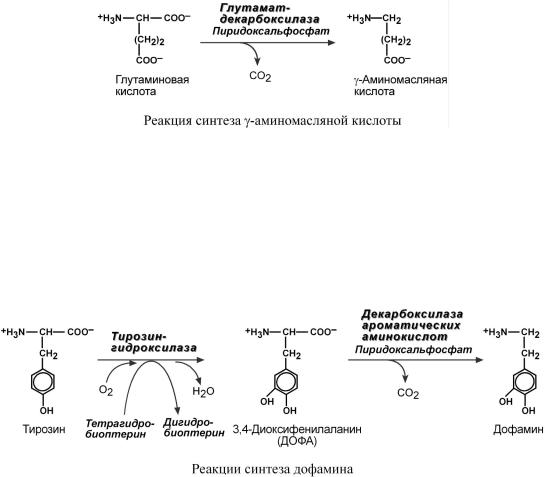
ГА М М А -А М И НКИСЛОТМ А С Л Я Н А Я |
А |
|
|||
Синтез γ-аминомаслянойкислоты |
(ГАМК) |
происходит исключительно вцентральной |
|||||
нервнойсистеме |
– в подкообрголовазоваковыхмозга. нияхого |
|
|
|
|
||
Физиологическиеэффекты |
|
|
|
|
|
Вцентральнойнервнойсистеме |
ГАМКнаряду( сглутам |
иновойкислотой |
|
) является |
|
тормознымме |
диатором. Наиболеевысрвлька |
височной и лобнойкоре |
, |
гиппокампе, |
|
миндалевидных и гипоталядрамических |
, чернойсубстанции |
,ядрах мозжечка. |
|
||
|
|
ДОФАМИН |
|
|
|
Синтездофампровисходитна |
основном нейронах промежуточногоисреднегомо |
|
з- |
||
га. |
|
|
|
|
|
Физиологическиеэффекты |
|
|
Являетсямедиаторомдофаминовыхрецепторов |
в подкорковых образованиях ЦНС,в |
|
большихдозахрасшисосердцауды,стимулиряетча тотилусердечныхусокращет |
е- |
|
ний,расширяет |
осудыпоч,увелдиурезк. чивая |
|
biokhimija.ru |
ТиминО.А. |
Лекции по общей биохимии (2018г) |
113 |
|
|
|
|
|
|
|
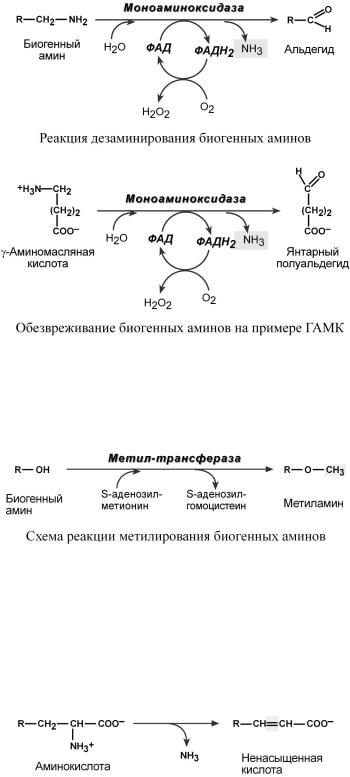
ОБ Е З ВБИОГЕНР Ж И В А Н И Е |
НЫАМХИНОВ |
|
|
Существуютдватипаре кций |
|
инактивациябиогенаминовых |
– дезаминирование |
|
метилирование. |
|
|
|
|
Дезаминирование протекаетсобразованием |
свободногоаммиака |
и сучастием ФАД. |
||
Катализируетреакцию |
моноаминоксидаза,онаобнаруженавомногихтканях, наиболее |
|
||
активнапеч,же,почкахнилуд,киш,неетканичникервной. |
|
|
|
|
Метилирование биогенамипроисходитнприаогоналичии |
унего |
гидроксильной |
||
группы (дофамин,серотонин) |
.Вреакцииприн мает |
учакстиформаметионинавная |
– |
|
S-аденозилметионин( |
SAM), образуетсяметилировформааминSанная |
|
-аденозил- |
|
гомоцистеин( |
SАГ). |
|
|
|
П Р Е ВАРМАИЩНЕОНКИИЕС Л |
О Т СУ Ч АСМТИИНЕОМГ Р У П |
П Ы |
|
Превращениеаминокислот |
сучастием NH2-группы сводитсякееотщеплению |
угле- |
|
родногоскелета |
– происходят реакции дезаминирования. |
|
|
|
|
ТИПЫДЕЗАМ ИНИРОВАНИЯ |
|
1. Внутримолекулярное – собразованненасыщеннойжирнойк емслоты |
, |
||

Обамениибелковокислот |
114 |
|
|
2. Восстановительное – собразованием насыщенной жирнойкислоты |
, |
3. Гидролитическое – собразованиемк |
арбоновойгидр |
оксикислоты, |
4. Окислительное – собразованиемкетокислот.
Окислительноедезаминированиеявляется |
основным путемкатаболизма |
большинства |
|||
аминокислот.Однакогистидин |
теряет аминогруппусиспользованием |
внутримолекулярного |
|||
дезаминирования,треонин |
исерин сразу подвергаются прямомурасщеплениюдоглицина |
|
|||
иацетальдегида (треонин)илигидроксиметиласерин( ) |
. |
|
|
||
|
|
ОК И С ЛДЕЗАМИ Т Л ЬИНО Е |
ИРОВАНИЕ |
|
|
Выделяютвариантаокислительногодезаминир: вания |
|
непрямоеи . |
|
||
|
|
Прямое окислительноедезаминирование |
|
||
Прямоедезаминированиекатализируется |
одним ферментом,врезультатеобразу тся |
||||
NH3 икетокислота. |
Прямоеокислительноедезаминирование |
анаэробное). |
можетидтивприсутствиики |
с- |
|
лорода( |
аэробное)иненуждатьсявкислороде( |
|
|
||
1. Аэробное прямоеокислительноедезаминирование |
|
атализируется |
оксидазами |
||
D-аминокислот (D-оксидазы)вкачествекоферментаиспользующимиФАД,оксидазами |
|
|
|||
L-аминокислот (L-оксидазы)скоферментомФМН. |
|
|
|
||
|
Наибольшаяактивность |
L-оксидобнвпечениаруженаз |
|
впочках,норольихне |
|
|
|
совсемясна,т.к.ихоптимумрНнаходитсяоколо10привнутрНиклеточных |
|
|
|
||
|
фермпочтинактивныенты. |
|
|
|
|
|
|
Оксидазы D-аминокислот,имею щих толькобактериальноепроисхождение,сн |
и- |
||||
|
жаютихколичествотканях |
|
. Этом дулиобнанедавнорувлияниеетженное |
|
D- |
|
|
аминокислот наактивность эндокринныхжеле |
зи |
ЦНС. |
|
||
|
2. Анаэробное прямоеокислительноедезаминирование |
|
существуеттолькодляглут |
а- |
||
миновойкислоты, |
катализируется только глутаматдегидрогеназой, превращающей глута- |
|||||
мат в α-кетоглутарат.Фермент |
глутаматдегидрогеназа имеетсявмитохондрияхвсехклеток |
|
||||
организмакроме( мышечных). |
|
|
|
|
|
|

biokhimija.ru |
ТиминО.А. |
Лекции по общей биохимии (2018г) |
115 |
|
|
||
Этипдезаминиоттеснейшимобсвязрованияазотр с минированием |
о- |
||
кислотсм(н)формиружеснимпроцетсс |
|
трансдезаминирования (смниже). |
|
Непрямоеокислительноедезаминирование |
|
|||
|
(трансдезаминирование) |
|
||
Непрямое окислительноедезаминирование |
|
включаетэт2и ктивнопаидетвовсех |
|
|
клеткорг. анизмах |
|
|
|
|
Первый этзапключаетсяв |
обратимом переносе NH2-группысаминаокислоты |
кето- |
||
кисобразовалотуновойамииновойиемкетокислоты |
|
|
– этотперенос |
называет- |
ся трансаминирование (механизмреакции |
смниже) |
. |
|
|
|
Вкачетокислотыстве |
-акцептора ("кетокислота2")ворганизмеобычноиспользуется |
|
||
α-кетоглутаровая кислота,котораяпревращается |
глутамат. |
|
|||
|
Врезультатетрансаминсвободаминокислотытеряютванияые |
|
α-NH2-группыи |
||
превсоотвращаютсякет.ствующиеокислДалееихкеткатаболизируетсктыспл тц |
|
и- |
|||
фическимипутямивовлецтрикарбоновыхклается |
|
ислоттканевоедыхание,гдесг |
о- |
||
раетдоСО |
2 иН 2О. Принеобходимонапример( ,голодание)углеродныйскелеттиглюкоге |
|
н- |
||
ныхаминиспожеткисдлясинтезаотьзоватьсяглюкозы. |
|
|
|
||
|
Второй этапсосвотщепленииоитаминогруппывообразованнойаминокислоты |
|
|
||
(всегда глутамат) |
– происходит дезаминирование,которое осуществляется глутаматдегид- |
||||
рогеназой (реакциюсмвыше) |
. |
|
|
||
|
Учитываятесвязьнуюобоихэтапов, |
|
непрямое окислительное дезаминирование назы- |
||
вают трансдезаминирование. |
|
|
|||

Обамениибелковокислот |
116 |
|
|
Ниже подробно разбираютсяреакции |
|
рансаминированиядезаминирования. |
|||
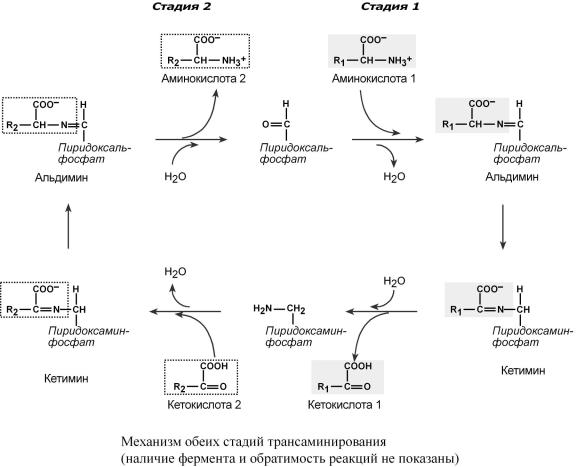
Механизмт |
рансаминирования |
|
|
|
|
Механизмреакции |
трансаминирования достаточсложе. но |
Катализируютреакцию |
|||
ферменты аминотрансферазы,Они |
являютсясложнымиферментами,качествекоферме |
н- |
|||
таониимеют |
пиридоксальфосфат (активнаяформавитаминаВ |
6). |
|||
Весьпереносаминогруппысовершается |
|
двестадии |
. К пиридоксальфосфату сначала |
||
присоединяется первая аминокислота, |
отдаетаминогруппу, |
превращается вкетокислоту |
|||
отделяется.Аминогруппа |
приэтом |
переходитнакоферментоб |
разуется пиридоксамин- |
||
фосфат.Послеэтого |
навторойстадии |
|
присоединяетсядругаякетокислота, |
забирает амино- |
|
группу,преновуюращаясьаминокислоту, |
|
пиридоксальфосфат регенерирует. |
|||
Роль ипревращение пиридоксальфосфата сводитсякобразпрованиюмежуточныхс |
о- |
||
единений – шиффоснованийых |
(альдимин и кетимин). |
Впервойреакции |
после отщепле- |
ния водыбразуетсяиминсвязьмеждуостаткомаминокислотыя |
|
1 ипиридоксальфосф а- |
|
том.Полученсоединазываетсяоеение |
альдимин.Пер емещениедвойнойсвязипркводит |
образованию кетимина,которыйгидрв полизуетсяместудойдвойнойсвязи.Отфермента |
|
отщеготовыйпляетсяродукт |
– кетокислота 1. |
biokhimija.ru |
ТиминО.А. |
Лекции по общей биохимии (2018г) |
117 |
|
|
|
|
|
Потщслекеплениято |
|
кислоты 1 ккомплексупиридоксамин |
-ферментприсоединяется |
|||
кетокислота 2,ипроцидетвобратномсспорядке:образуетсякетимин,затемальдимин,п |
|
|
|
о- |
|||
слечотделяетсягоноваяаминокислота |
|
2. |
|
|
пирови- |
||
|
Чащевсегоаминокивзаимодействуютсослотыедующкетокислотами: |
|
|
|
|||
ноградной (собраланиназоваием |
), щавелевоуксусной |
(собраспартатазованием), |
|
||||
α-кетоглутаровой (собразовглутаниеммата |
).Одналиаконинспартатвдальнейшем |
все |
|||||
равно передаютсвоюаминогруппуна |
α-кетоглутаровуюкислоту. |
|
|
||||
|
Втканяхнасчитываютоколо10аминотрансфераз,кообладаюторыегрупповой |
|
|
кроме пролина,лиз |
|
||
|
специфивовлчностьюреакцвсекаютами,нокислоты |
|
|
и- |
|||
|
на,треонина, |
которыенеподвергаютсятранс |
|
аминированию. |
|
||
|
Такимобразом,втканяхосуществляетсяпотокизбыточныхамино |
|
|
группнаодин |
общий |
||
акцептор – α-кетоглутаровуюкисл.Витогету |
|
бразуетсябольшоеколичество |
глутамино- |
||||
вой кислоты. |
|
|
|
|
|
|
|
Дезаминирование |
|
|
|
|
|
||
|
В организколлекторомвсехинокислотныхаминогрупп |
|
|
(аминногоазота) |
является |
||
глутаминоваякислота, |
|
и только онаподвергается |
окислительномудезаминированию |
с |
|||
образованием аммиака и α-кетоглутаровойкислоты.Фермент |
|
глутаматдегидрогеназа име- |
|||||
етсявмитохондрияхвсехклетокорганизмакроме( мышечных)катализируетреакциюде |
|
|
|
з- |
|||
аминированияглутамата. |
|
|
|
|
|
|
|

Обамениибелковокислот |
118 |
|
|
ТаккакНАДНиспользуетсявдыхательнойцепи |
|
|
α-кетоглутвовлреакаератся |
|
|
к- |
ции ЦТК,тореактивцпрдефицитея энрупепомощиртсягииАДФингибируется |
|
|
|
|
|
|
избыткомАТФНАДН. |
|
|
|
синтезамочев |
|
и- |
Еслиреакциявдетмитохондрияхпечени,аммиспоакльзуется |
|
|
|
|
||
ны,котораявдальнейшемудаляетсямочой. |
|
|
Вэпителииканальцевпочекреа |
иянеобх |
о- |
|
димадляудаммиакалениявпроцессе |
аммониегенеза. |
|
|
|
||
ЭН З И МСОПД И А Г Н О С Т И К А |
ОМОЩАМИНОТРАНСФЕРЬЮ |
АЗ |
|
|
||
Вмедициненашлопрактиопредческоемененактивностидвухламине ие |
|
|
|
|
|
о- |
трансфераз – аланинаминотрансферазы (АЛТ)и |
аспартатаминтрансферазы (АСТ). |
Хотя |
||||
активностьобоихферментовзначительновозрпристаетболеванияхсердечноймышцы |
|
|
|
|
|
|
печени,припоражеклетминаибольшаяокииардаактивнсывкровиобнарстьротке |
|
|
|
|
|
у- |
живаетсядляАСТ,пригепатитах |
– дляАЛТ. |
|
|
|
|
|
Вклиническойпрактиопредактивление |
|
|
ностиАЛТАСТсподдиффльзуется |
|
|
е- |
ренцдиагностболльнойпеизнеймченикиокарда |
|
|
,глубиныпоражения |
иконтроляэ |
|
ф- |
фективностиихлечения. |
|
|
Обафермента |
обратимо взаимодействуют |
α-кетоглутаркислотпереносятна вой |
нееаминогруппыот |
соответствующихаминокислот |
собразовглуткислотыанм емновой |
кетокислот. |
|
|

biokhimija.ru |
|
|
ТиминО.А. |
Лекции по общей биохимии (2018г) |
|
119 |
||||||
|
|
|
|
|
|
|
|
|
|
|||
|
ПовышеактивАСТферментавиеости |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||||
|
2-20разотмечаетсяв 95%случаеви |
|
|
|
н- |
|
|
|
|
|||
|
фарктамиокарда, прижетакихфо |
|
|
|
р- |
|
|
|
|
|||
|
махинфармио,конетардадиорые |
|
|
|
а- |
|
|
|
|
|||
|
гноспомощьютируютсяЭКГ. |
|
|
Однако |
|
|
|
|
||||
|
из-занизкойорганнойспецифичности |
|
|
|
|
|
|
|
||||
|
(высокаяактивностьферментаотмеч е |
|
|
|
т- |
|
|
|
|
|||
|
ся также вскелетныхмышцах,печени, |
|
|
|
|
|
|
|
||||
|
эритроцитах)определеактивностиие |
|
|
|
|
|
|
|
|
|||
|
АСТдлядиагнмиофаростикита |
|
|
|
р- |
|
|
|
|
|||
|
дапостепсходитна.енно |
|
|
|
|
|
|
|
|
|||
|
|
|
|
РОТРАНСЛЬ |
АМ ИНИРОВАНИЯТРАНС |
|
ДЕЗАМ ИНИРОВАНИЯ |
|
||||
|
Реакции трансаминирования: |
|
|
|
|
|
|
|||||
o |
активируются впечени,мышцахдругихорганах |
|
|
|
припоступлениивклеткуизб |
|
ы- |
|||||
|
точногоколтехичестваиныхлиаминокисло |
|
|
|
|
т – сцельюоптисоотношенияхмизации |
|
, |
||||
o |
обеспечиваютинтеззаменаминокислотмых |
|
|
|
|
вклеткеприналичииихуглеродного |
|
|
||||
|
скелетакето( ), налога |
|
|
|
|
|
|
|
|
|||
o |
необходимы после прекращения использованияаминокислнасинтезазотсотдерж |
|
а- |
|||||||||
|
щихсоединенийбелков( ,креатина,фосфол,пурипиримидиновыхновыхпидовосн |
|
|
|
|
|
о- |
|||||
|
ваний) |
– сцельюдальнейшегокатаболизмабезазотистогоостатка |
|
|
|
аминокислот ивыр |
а- |
|||||
|
боткиэнер |
|
гии, |
|
|
|
|
|
|
|
|
|
o |
необходимыпривнутриклеточномгол |
|
|
одании,нап, ргипогликемияхмерразли |
|
ч- |
||||||
|
ногогенеза |
– дляиспользовбезазотистостаминнияткав окислотго |
|
|
|
печени для кето- |
||||||
|
глюконеогенезаи |
,в |
другихорганах |
|
дляегопрямогововлеЦТКакцчен, иия |
|
|
|||||
o |
припатологияхсахарный( диабет,гиперкортицизм |
|
|
|
)обусловливаютналичиесубстр |
а- |
||||||
|
товдля |
|
глюконеогенеза испособствуютпатологическойгипергликемии. |
|
|
|
||||||
|
Продукттрансаминирования |
– |
глутаминоваякислота |
: 1) является однойизтран |
с- |
|||||||
портныхформаминногоазотавгепатоциты, способнареагировать2) свободнымам |
|
|
|
|
|
миа- |
||||||
к,омбезвреживаяегосм(Связывание" аммиака"). |
|
|
|
|
|
|
|
|
||||
|
Процесс трансдезаминирования идетв |
организме непрерывно: |
амин- |
|||||||||
o |
сопреакциияжетрансаминирдезаминированияныесоздаютп ток |
|
|
|
|
|||||||
|
ного азотаизперифклвпеченьрическихток |
|
|
|
для синтеза мочевины и в почкидляси |
н- |
||||||
|
тезааммсо.нилейных |
|
|
|
|
|
|
|
|
|||
|
Н Е ПДР ЕЯЗМАОМЕИ Н И Р О В А |
|
НАИМЕ И Н О К И С Л О Т |
ВМ Ы Ш Ц Е |
|
|||||||
|
Вмышклприечткахнтеых |
|
|
нсивнойработе |
|
,когдаидетраспадмышечныхбелков, |
|
|
||||
активируетсяальтернативныйспособдезаминированияаминокислот. |
|
|
|
|
|
|
|
|
||||
|
Образовавшийсяпри |
трансаминированииглутаматприучасА |
|
СТ реагируетсокс |
а- |
|||||||
лоацетиобраспарагиноваятомзуетки.Аспартатлота |
|
|
|
|
|
далее передаетсвоюаминогруппу |
|
|||||
наИМФ |
(инозинмонофосфат) |
собразованиемАМФ,который |
|
всвоюочередь |
подвергается |
|||||||
дезаминирсобразованию |
|
иемсвободногоаммиака |
|
|
. |
|
|
|||||
|
Процессноситзащитныйхарактер |
|
|
,т.к.пработеивыдмолочнаяляетсякислота |
|
м- |
||||||
миак,связываяионыН |
|
+,предотвращаетзакислениецитозолямиоцитов. |
|
|
|
|
|
|||||
