
- •Ответы по химии!
- •2 Химическая система (открытая, закрытая, изолированная). Внутренняя энергия.
- •5.Изобарный потенциал реакции (свободная энергия Гиббса). Критерий самопроизвольности реакций.
- •Принцип ле-шателье.Смещение химического равновесия.
- •1. Влияние температуры.
- •2. Влияние давления.
- •3. Влияние концентрации
- •10 Способы выражения концентраций растворов
- •13 Процесс электролитической диссоциации как взаимодействие веществ. Самоионизация.
- •14. Закон действующих масс в растворах электролитов. Сильные и слабые электролиты. Степень диссоциации.
- •15. Теория сильных электролитов. Активность. Коэффициент активности. Ионная сила растворов. Связь ионной силы раствора с коэффициентом активности.
- •16. Протолитическое равновесие. Кислоты, основания, амфолиты по Бренстеду.
- •17. Вода как растворитель. Дифференцирующие и нивелирующие растворители.
- •18. Автопротолиз. Ионное произведение воды. Рн
- •19. Гидролиз по катиону и аниону. Необратимый гидролиз. Константа и степень гидролиза. Расчёт pH.
- •Константа гидролиза.
- •Расчёт pH.
- •20. Буферные растворы, природные буферные системы. Расчёт pH буферных систем, буферная ёмкость.
- •21. Кислоты и основания по Льюису.
- •22. Гетерогенные равновесия. Произведение растворимости.
- •23. Химическая связь: типы связи, механизмы образования, характеристики.
- •24. Комплексные соединения (кс). Строение кс. Номенклатура кс. Классификация кс. Характер связи в кс.
- •Классификация
- •По заряду комплекса
- •По числу мест, занимаемых лигандами в координационной сфере
- •По природе лиганда
- •Химическая связь в комплексных соединениях.
- •25.Диссоциация комплексных ионов. Константа нестойкости. Комплексообразование в организме.
- •26.Изомерия кс. Комплексообразование в организме.
- •27.Строение гемма
- •28. Овр и их биологическая роль.
- •30. Коллоидные системы. Строение коллоидной частицы. Двойной электрический слой. Электрокинетические явления.
- •31. Методы очистки коллоидных растворов. Диализ, электролиз, ультрафикация.
- •32.. Получение и свойства дисперсных систем. Получение суспензий, эмульсий, коллоидных растворов.
- •33. Устойчивость дисперсных систем. Седиментационная , агрегативная и конденсационная устойчивость лиозолей. Факторы, влияющие на устойчивость лиозолей.
- •34. Коагуляция.Порог коагуляци и нго определение,правило Шульце-Гарди.Взаимная коагуляция.
- •35. Поверхностные явления и адсорбция. Адсорбционные равновесия и процессы на подвижных границах раздела фаз.Уравнение Гиббса
- •36. Поверхностно-активные и поверхностно-неактивные вещества. Изменение поверхностной активности в гомологических рядах (правило Траубе).
- •37. Поверхностное натяжение и методы его определения
- •38. Адсорбция из раствора на твёрдом адсорбенте
- •39. Адсорбционные равновесия на неподвижных границах раздела твёрдых фаз. Физическая адсорбция и хемосорбция
- •Типы адсорбционных взаимодействий
- •40.Адсорбция из растворов. Уравнение Ленгмюра. Зависимость величины адсорбции от различных факторов.
- •Зависимость величины адсорбции от:
- •41. Применения десорбциооных процессов в медицине Применение адсорбционных процессов в медицине
- •42. Хроматография
- •43. Специфические свойства вмс.
- •44. Понятие биогенности химических элементов.
- •45. Химия биогенных элементов s-блока.
- •46. Химия биогенных элементов d-блока.
- •47. Химия биогенных элементов p-блока.
- •49.Полифункциональные органические соединения
- •50 Полиамины: этилендиалин.Путресцин.Кадоверин.
- •51 Гетерофункциональные соединения
- •52 Б) Оксокислоты-адельгидо- и кетонокислоты
- •53 Гетерофункциональные производные бензольного ряда как лекарственные средства
- •54 Гетероциклическими называют циклические органические соединения, в состав цикла которых, помимо атомов углерода, входят один или несколько атомов других элементов (гетероатомов).
- •13.1.2. Номенклатура
- •13.2.1. Ароматические свойства
- •13.2.2. Кислотно-основные и нуклеофильные свойства
- •13.5.1. Гидроксипурины
- •55.Фолиевая кислота, биотин, тиамин. Понятие о строении и биологической роли. Представление об алкалоидах и антибиотиках
- •Эффекты биотина
- •Физиологические функции
- •Значение тиамина в спорте
- •Пищевые источники
- •Алкалоиды
- •Антибио́тики
- •56.Пептиды и белки
- •Свойства пептидов
- •R h2n—сн—соон
- •Биологическое значение углеводов
- •Виды углеводов
- •Гомополисахариды
- •Влияние мукополисахаридов на стабилизацию структуры коллагена дентины и эмали
- •58.Нуклеиновые кислоты
- •60.Полимеры. Понятие о полимерах медицинского назначения.
- •Полимеры медицинского назначения
14. Закон действующих масс в растворах электролитов. Сильные и слабые электролиты. Степень диссоциации.
Влияние концентрации на скорость химической реакции выражается законом действующих масс: при постоянной температуре скорость химической реакции прямо пропорциональна концентрации реагирующих веществ.
Вещества, которые растворяются в воде с образованием растворов, проводящих электрический ток, называются электролитами. Процесс распада веществ на ионы называется электролитической диссоциацией. Электролитическая диссоциация — процесс обратимый.
Степень диссоциации
Для количественной оценки процесса диссоциации важное значение имеют степень диссоциации и константа диссоциации.
Степень электролитической диссоциации α равна отношению распавшихся на ионы молекул (n) к общему числу молекул (N) электролита, введенных в раствор:
α=(n/N)*100%
Степень диссоциации электролитов зависит от концентрации растворов: с уменьшением концентрации она растет.
Процесс электролитической диссоциации удобнее характеризовать константой диссоциации .
В отличие от степени диссоциации константа диссоциации зависит только от природы электролита и температуры.
Константа и степень электролитической диссоциации количественно взаимосвязаны.
закон разбавления Оствальда даёт возможность определить степень диссоциации при различных концентрациях электролита, если известно значение К.
По степени диссоциации в не очень разбавленных растворах электролиты принято делить на сильные, слабые и средней силы. Сильные электролиты имеют α>ЗО%; слабые — α<3%, а электролиты средней силы —α в пределах от 3 до 30 %. Эти значения α относятся к 0,1 н. раствору.
Следует иметь в виду, что деление электролитов на слабые, средние и сильные носит условный характер и зависит от природы растворителя, концентрации электролита и других факторов.
Степень диссоциации и константа диссоциации связаны с концентрацией раствора: К≈α2С или α=√К/С
15. Теория сильных электролитов. Активность. Коэффициент активности. Ионная сила растворов. Связь ионной силы раствора с коэффициентом активности.
При увеличении концентрации растворов электролитов создаются условия, когда за счет электростатического взаимодействия становится возможным образование новых соединений – ассоциатов. На вероятность образования ассоциатов указал Н. Бьеррум, им определено то минимальное расстояние между ионами, при котором становится возможным образование ассоциатов. Различают несколько видов ионных пар, находящихся в растворе:
1) константная K+, An–;
2) гидратно (сольватно)-ионная пара K+(H2O)An–;
3) гидратно (сольватно)-разделенная пара K+(H2O)N An–;
4) ионные тройники K+An–K+, An–K+An–.
Образование ионных пар в растворе сказывается на величине проводимости раствора, причем появление и образование нейтральных ассоциатов снижает проводимость растворов электролитов.
Для сильных электролитов, когда степень ионизации велика, константа ионизации зависит от концентрации, так как при накоплении в растворе большого числа ионов сказывается их взаимное влияние. Когда растворитель обладает малой диэлектрической проницаемостью (величина, показывающая, во сколько раз ослабевают силы взаимодействия электрических зарядов при расположении этих зарядов в диэлектрике по сравнению с силами в вакууме), создаются условия для электростатического взаимодействия сольватированных ионов противоположного знака. При этом последние подходят друг к другу на близкое расстояние и образуют ионную пару – сложный агрегат, состоящий из двух противоположно заряженных ионов, окруженных молекулами растворителя, в котором электрические заряды взаимно компенсированы, это – ассоциация.
Ассоциация ионов – образование из противоположно заряженных ионов (в растворах электролитов) особого рода частиц-ассоциатов, в которых ионы удерживаются за счет электростатического взаимодействия их электрических зарядов в соответствии с законом Кулона. Процессы ассоциации ионов подчиняются закону действующих масс, термодинамическим соотношениям.
Степень ассоциации ионов зависит от природы растворителя, электролита, температуры, концетрации раствора. Она возрастает с уменьшением диэлектрической проницаемости растворителя вследствие увеличения кулоновского притяжения ионов.
Ассоциация – объединение однородных частиц в растворе.
Коэффициент активности – коэффициент, связывающий реальную концертрацию электролита с его термодинамической активностью в уравнении a = γc (a – активность; с – концентрация; γ – коэффициент активности).
Необходимость введения активностей обусловлена отклонениями термодинамических уравнений от идеальности за счет электростатических сил и сил межмолекулярного взаимодействия. В этом случае при использовании концетраций результаты расчета не сответствуют экспериментальным данным.
Чтобы уравнения для идеальных растворов не меняли вид, в них используются активности. Для определения коэффициентов активности используются различного вида приближения, в основе которых лежит предельный закон Дебая-Хюккеля.
Сам по себе предельный закон Дебая-Хюккеля имеет ограниченное применение в области сильно разбавленных растворов, поэтому чаще пользуются различными усовершенствованными приближениями.
Ионная сила раствора — мера интенсивности электрического поля, создаваемого ионами в растворе. Полусумма произведений из концентрации всех ионов в растворе на квадрат их заряда.
Ионная сила раствора имеет большое значение в теории сильных электролитов Дебая — Хюккеля. Основное уравнение этой теории (предельный закон Дебая — Хюккеля) показывает связь между коэффициентом активности иона и ионной силы раствора.
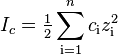
где ci — молярные концентрации отдельных ионов (моль/л), zi заряды ионо.Суммирование проводится по всем типам ионов, присутствующих в растворе. Если в растворе присутствуют два или несколько электролитов, то вычисляется общая суммарная ионная сила раствора.
