
- •Ответы по химии!
- •2 Химическая система (открытая, закрытая, изолированная). Внутренняя энергия.
- •5.Изобарный потенциал реакции (свободная энергия Гиббса). Критерий самопроизвольности реакций.
- •Принцип ле-шателье.Смещение химического равновесия.
- •1. Влияние температуры.
- •2. Влияние давления.
- •3. Влияние концентрации
- •10 Способы выражения концентраций растворов
- •13 Процесс электролитической диссоциации как взаимодействие веществ. Самоионизация.
- •14. Закон действующих масс в растворах электролитов. Сильные и слабые электролиты. Степень диссоциации.
- •15. Теория сильных электролитов. Активность. Коэффициент активности. Ионная сила растворов. Связь ионной силы раствора с коэффициентом активности.
- •16. Протолитическое равновесие. Кислоты, основания, амфолиты по Бренстеду.
- •17. Вода как растворитель. Дифференцирующие и нивелирующие растворители.
- •18. Автопротолиз. Ионное произведение воды. Рн
- •19. Гидролиз по катиону и аниону. Необратимый гидролиз. Константа и степень гидролиза. Расчёт pH.
- •Константа гидролиза.
- •Расчёт pH.
- •20. Буферные растворы, природные буферные системы. Расчёт pH буферных систем, буферная ёмкость.
- •21. Кислоты и основания по Льюису.
- •22. Гетерогенные равновесия. Произведение растворимости.
- •23. Химическая связь: типы связи, механизмы образования, характеристики.
- •24. Комплексные соединения (кс). Строение кс. Номенклатура кс. Классификация кс. Характер связи в кс.
- •Классификация
- •По заряду комплекса
- •По числу мест, занимаемых лигандами в координационной сфере
- •По природе лиганда
- •Химическая связь в комплексных соединениях.
- •25.Диссоциация комплексных ионов. Константа нестойкости. Комплексообразование в организме.
- •26.Изомерия кс. Комплексообразование в организме.
- •27.Строение гемма
- •28. Овр и их биологическая роль.
- •30. Коллоидные системы. Строение коллоидной частицы. Двойной электрический слой. Электрокинетические явления.
- •31. Методы очистки коллоидных растворов. Диализ, электролиз, ультрафикация.
- •32.. Получение и свойства дисперсных систем. Получение суспензий, эмульсий, коллоидных растворов.
- •33. Устойчивость дисперсных систем. Седиментационная , агрегативная и конденсационная устойчивость лиозолей. Факторы, влияющие на устойчивость лиозолей.
- •34. Коагуляция.Порог коагуляци и нго определение,правило Шульце-Гарди.Взаимная коагуляция.
- •35. Поверхностные явления и адсорбция. Адсорбционные равновесия и процессы на подвижных границах раздела фаз.Уравнение Гиббса
- •36. Поверхностно-активные и поверхностно-неактивные вещества. Изменение поверхностной активности в гомологических рядах (правило Траубе).
- •37. Поверхностное натяжение и методы его определения
- •38. Адсорбция из раствора на твёрдом адсорбенте
- •39. Адсорбционные равновесия на неподвижных границах раздела твёрдых фаз. Физическая адсорбция и хемосорбция
- •Типы адсорбционных взаимодействий
- •40.Адсорбция из растворов. Уравнение Ленгмюра. Зависимость величины адсорбции от различных факторов.
- •Зависимость величины адсорбции от:
- •41. Применения десорбциооных процессов в медицине Применение адсорбционных процессов в медицине
- •42. Хроматография
- •43. Специфические свойства вмс.
- •44. Понятие биогенности химических элементов.
- •45. Химия биогенных элементов s-блока.
- •46. Химия биогенных элементов d-блока.
- •47. Химия биогенных элементов p-блока.
- •49.Полифункциональные органические соединения
- •50 Полиамины: этилендиалин.Путресцин.Кадоверин.
- •51 Гетерофункциональные соединения
- •52 Б) Оксокислоты-адельгидо- и кетонокислоты
- •53 Гетерофункциональные производные бензольного ряда как лекарственные средства
- •54 Гетероциклическими называют циклические органические соединения, в состав цикла которых, помимо атомов углерода, входят один или несколько атомов других элементов (гетероатомов).
- •13.1.2. Номенклатура
- •13.2.1. Ароматические свойства
- •13.2.2. Кислотно-основные и нуклеофильные свойства
- •13.5.1. Гидроксипурины
- •55.Фолиевая кислота, биотин, тиамин. Понятие о строении и биологической роли. Представление об алкалоидах и антибиотиках
- •Эффекты биотина
- •Физиологические функции
- •Значение тиамина в спорте
- •Пищевые источники
- •Алкалоиды
- •Антибио́тики
- •56.Пептиды и белки
- •Свойства пептидов
- •R h2n—сн—соон
- •Биологическое значение углеводов
- •Виды углеводов
- •Гомополисахариды
- •Влияние мукополисахаридов на стабилизацию структуры коллагена дентины и эмали
- •58.Нуклеиновые кислоты
- •60.Полимеры. Понятие о полимерах медицинского назначения.
- •Полимеры медицинского назначения
26.Изомерия кс. Комплексообразование в организме.
Изомерия КС:
Сольватная изомерия: обнаруживается в изомерах когда распределение молекул воды между внутренней и внешней сферами оказывается неодинаковым.
[Cr(H2O)6]Cl3 (фиолетовый) и [Cr(H2O)5Cl]Cl2H2O (зеленый)
Ионизирующая изомерия: связана с различной лёгкостью диссоциации ионов из внутренней и внешней сферы комплекса.
[Pt(NH)4Cl2]Br2 и [Pt(NH)4Br2]Cl2
Координирующая изомерия: Встречается в тех комплексных соединениях, где и катион и анион являются комплексными.
[Co(NH3)6][Fe(CN)6] и [Fe(NH3)6][Co(CN)6]
Изомерия связи: возникает только тогда, когда монодентатные лиганды могут координироваться через два разных атома.
Пространственная изомерия: обусловлена тем, что одинаковые лиганды располагаются вокруг комплексообразователя либо рядом (цис), либо напротив (транс).
[clclPtNH3NH3] [clNH3PtclNH3]
Зеркальная (оптическая) изомерия: например в катионе дихлоро – диэтилендиамино-хрома (III)
[Cr(en)2Cl2]+
27.Строение гемма
Наиболее известным переносчиком кислорода является гемоглобин. Он присутствует в организмах позвоночных, а также и ряда беспозвоночных (например, двустворчатых моллюсков, морских многощетинковых червей, голотурий). Молекула гемоглобина состоит из белковой части - глобина и гсма - комплекса Fe(II) с одним из порфиринов -так называемым протопорфирином IX. Порфирин - это циклическая молекула, в состав которой входит 4 пиррольные группы. Так выглядит молекула гема:

Атом железа образует с атомами азота две ковалентные и две координационные (донорно-акцепторные) связи. В действительности же все 4 связи Fe-N почти равноценны (как и 4 связи N-H в катионе аммония), поэтому вклад резонансных структур примерно одинаков. С трех сторон порфириновый цикл гема содержит гидрофобные заместители -метальные и винильные группы, а с четвертой стороны - две гидрофильные карбоксильные группы, которые в нейтральной среде находятся в анионной форме СОО-. Координационное число атома железа в геме равно 4, поэтому он может образовывать еще две координационные связи, дополняя свое окружение до октаэдрического.
28. Овр и их биологическая роль.
Окисли́тельно-восстанови́тельные реа́кции, также редокс — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
Вещества, содержащие атомы, которые понижают свою степень окисления, называют окислителями, а вещества, содержащие атомы, которые повышают степень окисления, - восстановителями.
Межмолекулярные (межатомные) окислительно-восстановительные реакции характеризуются тем, что атомы, изменяющие свои степени окисления, находятся в разных по своей химической природе атомных или молекулярных частицах. Другими словами, одни вещества (простые или сложные), вступающие в химические реакции, являются окислителями, а другие – восстановителями
2. Внутримолекулярные окислительно-восстановительные реакции характеризуются тем, что атомы, изменяющие свои степени окисления, находятся в одной и той же молекулярной частице:
-3 +6 О +3
(NH4)2Cr2O7 = N2 + Cr2O3 + 4Н2О
Биологическая роль: Окислительно-восстановительные реакции играют огромную роль в природе. Без этих реакций невозможна жизнь. Дыхание, обмен веществ, синтез растениями клетчатки из углекислого газа и воды - все это окислительно-восстановительные процессы. Большинство химических реакций, происходящих в природе - окислительно-восстановительные.
29.Классификация дисперсных систем. Классификация дисперсных систем по степени дисперсности; по агрегатному состоянию фаз; по силе межмолекулярного взаимодействия между дисперсной фазой и дисперсной средой.
Дисперстные системы – системы, состоящие из частиц одной фазы, которые распределены в другой фазе.
1)
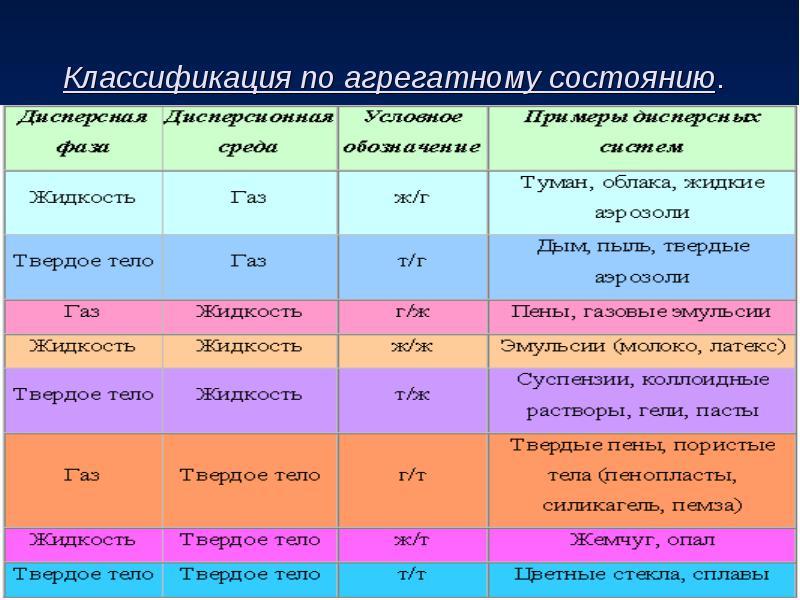
2)По степени раздробленности (дисперсности)
Коллоидная дисперсность:
Т1/Г2 – пыль в верхних слоях атмосферы, аэрозоли.
Т1/Ж2 – лиозоли, дисперсные красители вводе, латексы синтетических полимеров.
Грубая дисперсность:
Т1/Г2 – дымы
Ж1/Г2 – туманы
Т1/Ж2 – суспензии
Ж1/Ж2 – жидкие эмульсии
Г1/Ж2 – газовые эмульсии
3)По силе взаимодействия между дисперстной средой и дисперстной фазой:
Лиофильные: сильное межмолекулярное взаимодействие веществ фазы и среды с образованием сольватных оболочек из молекул дисперстной среды (мыла, глины).
Лиофобные: слабое взаимодействие вещества дисперстной фазы со средой (пены, лиозоли, аэрозоли, эмульсии).
