
1
Химия – это наука, изучающая
состав, строения, свойства веществ, а
также процессы превращения одних веществ
в другие.![]()
![]()
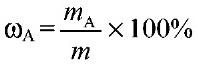
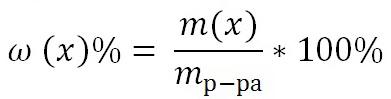
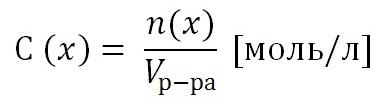
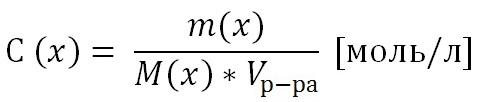
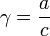
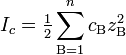
![]()
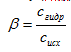
![]()
![]()
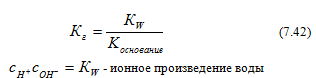
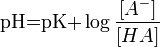
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Химия окружающей среды включает в себя более узкие разделы химии, такие, как геохимия, химия почв, гидрохимия, химия атмосферы, химия природных соединений органического происхождения и др. Химия окружающей среды изучает химические процессы во всех оболочках Земли, в том числе в биосфере, изучает миграции и превращения всех химических соединений, в том числе природных и антропогенных загрязнителей.
В последнее время, в связи со значительно возросшим масштабом воздействия человека на окружающую среду, со значительно возросшим количеством загрязняющих веществ антропогенного происхождения, в химии окружающей среды выделяют экологическую химию, изучающую те химические процессы в земных оболочках, которые происходят под влиянием человеческой деятельности.
![]()
2Химическая система - это индивидуальные вещества или смеси веществ, отделенные от окружающей среды реальной или воображаемй поверхностью раздела. Взаимодействие системы и окружающей среды рассматривается только с точки зрения обмена веществом или энергией.
системы подразделяются :
на открытые - обмениваются со средой и веществом и энергией;
изолированные - не обмениваются со средой ни веществом, ни энергией;
закрытые - обмениваются со средой только энергией.
Внутренняя энергия- энергия теплового движения частиц, химическая и ядерная энергия, определяющая поступательное, колебательное и вращательное движение молекул, внутримолекулярное взаимодействие и колебание атомов, энергию вращения электронов
U = G + Wсв
Свободная энергия (G) – та часть внутренней энергии, которая может быть использована для совершения работы.
Связанная энергия(Wсв) – та часть энергии, которую нельзя превратить в работу.
3. Тепловые эффекты химических реакций. Химическая реакция заключается в разрыве одних и образовании других связей, поэтому она сопровождается выделением или поглощением энергии в виде теплоты, света, работы расширения образовавшихся газов.
По признаку выделения или поглощения теплоты реакции делятся на экзотермические и эндотермические.
Количество теплоты, которое выделяется или поглощается в результате реакций между определенными количествами реагентов, называют тепловым эффектом химической реакции и обычно обозначают символом Q.
Наряду с тепловым эффектом термохимические процессы очень часто характеризуют разностью энтальпий D H продуктов реакции и исходных веществ.
Энтальпия Н — это определенное свойство вещества, оно является мерой энергии, накапливаемой веществом при его образовании.
Процессы, протекающие при постоянном давлении, встречаются гораздо чаще, чем те, которые протекают при постоянном объеме, так как большинство из них проводится в открытых сосудах. Доказано, что в химических процессах, протекающих при постоянном давлении, выделившееся (или поглощенное) тепло есть мера уменьшения (или соответственно увеличения) энтальпии реакции D H.
При экзотермических реакциях, когда тепло выделяется, D Н отрицательно. При эндотермических реакциях (тепло поглощается) и D H положительно.
Термохимические уравнения. : Термохимические уравнения включают в себя кроме химических формул тепловой эффект реакции
![]()
![]()
Теплота образования химических соединений. Теплотой образования соединения называется количество теплоты, которое выделяется или поглощается при образовании одного моля химического соединения из простых веществ при стандартных условиях (р = 105 Па, T = 298 К). Она измеряется в кДж/моль. Согласно этому определению, теплота образования простого вещества при стандартных условиях равна О.
Изменение энтальпии D Н зависит от давления и температуры. Поэтому для того, чтобы облегчить сравнение термохимических данных для различных реакций, были приняты определенные стандартные состояния (условия).
При написании термохимических уравнений твердое вещество, жидкость и газ обязательно обозначаются символами (тв), (ж) и (г) соответственно, поскольку изменение энтальпии зависит от агрегатного состояния реагирующих веществ и продуктов реакции. Стандартное состояние: для газа — состояние чистого газа при 105 Па; для жидкости — состояние чистой жидкости при 105 Па; для твердого вещества — наиболее устойчивое при давлении 105 Па кристаллическое состояние, например графит у углерода, ромбическая сера у серы и т. п. Стандартное состояние всегда относится к 298 К.
Закон Гесса и его следствия. Важнейшим законом, на котором основано большинство термохимических расчетов, является закон Гесса (его называют также законом суммы тепловых эффектов).
Тепловой эффект химической реакции зависит от состояния исходных веществ и продуктов реакции, но не зависит от промежуточных стадий реакций.
Особенно удобно проводить такие расчеты, используя следствия, непосредственно вытекающие из закона Гесса:
Тепловой эффект химической реакции равен разности суммы теплот образования продуктов реакции и суммы теплот образования исходных веществ (суммирование проводится с учетом числа молей веществ, участвующих в реакции, т. е. стехиометрических коэффициентов в уравнении протекающей реакции):
4Энтропия (от греч. entropía - поворот, превращение), понятие, впервые введенное в термодинамике для определения меры необратимого рассеяния энергии. Энтропия (S) – термодинамическая функция состояния, которая служит мерой беспорядка (неупорядоченности) системы. Возможность протекания эндотермических процессов обусловлена изменением энтропии, ибо в изолированных системах энтропия самопроизвольно протекающего процесса увеличивается ΔS > 0 (второй закон термодинамики).
Процессы, протекающие без подвода энергии от внешнего источника, называются самопроизвольными. Самопроизвольно протекает большинство экзотермических реакций : реакции горения, образования ржавчины на металле, взаимодействия активных металлов с растворами кислот и водой и пр. Но существуют самопроизвольные и эндотермические процессы, например, растворение некоторых солей в воде. Следовательно, кроме энтальпийного фактора имеется другая движущая сила самопроизвольных процессов. энтропия зависит от:
-
агрегатного состояния вещества. Энтропия увеличивается при переходе от твердого к жидкому и особенно к газообразному состоянию (вода, лед, пар).
изотопного состава (H2O и D2O).
молекулярной массы однотипных соединений (CH4, C2H6, н-C4H10).
строения молекулы (н-C4H10, изо-C4H10).
кристаллической структуры (аллотропии) – алмаз, графит.
Произведение изменения энтропии системы на температуру T ΔS количественно оценивает эту тендецию и называется энтропийным фактором.
5Свободная энергия Гиббса (или просто энергия Гиббса, или потенциал Гиббса, или термодинамический потенциал в узком смысле) — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на принципиальную возможность протекания химической реакции; это термодинамический потенциал следующего вида:
![]()
где U — внутренняя энергия, P — давление, V — объем, T — абсолютная температура, S — энтропия.
Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т. д.)
Понятие энергии Гиббса широко используется в термодинамике и химии.
Самопроизвольные реакции называются – экзергоническими, несамопроизвольные – эндергоническими.
В ходе самопроизвольности процесса энергия Гиббса уменьшается до определенной величины, принимая минимально возможное для данной системы значение. Дальнейшее изменение энергии Гиббса при неизменных условиях невозможно, и система переходит в состояние химического равновесия.
6Скорость химической реакции - это изменение концентрации какого-либо из реагирующих веществ в единицу времени в определённом объёме или на определённой поверхности.
Если реакция протекает идеально, то для оценки скорости достаточно пользоваться понятием средняя скорость. В этом случае рассматривают изменение концентрации вещества за некоторый промежуток времени и относят это изменение к единице времени V = ±(c2-c1)/(τ2-τ1)=±Δc/Δτ.. Важно знать, по какому веществу оценивается скорость реакции. Если это исходное вещество, то концентрация его убывает V= - Δc/Δτ. Если контроль ведут по продукту реакции, то концентрация его возрастает V= + Δc/Δτ.
Если реакция протекает сложно, то для оценки протекания химического процесса пользуются понятием истинная скорость химической реакции. Её можно определить математически и графически. Истинная скорость – это скорость реакции в данный момент времени. Причём в разные моменты она разная. Чем меньше рассматриваемый промежуток времени, тем точнее определяется скорость химической реакции. Vист= ± Δc/Δτ
Графическая скорость определяют по тангенсу угла наклона прямой к оси времени, т.е. Δс/Δτ = tg α.
Математическое выражение скорости представляет собой производную концентрации во времени: Vист=± dc/dτ. В этом случае концентрация контролируемого вещества вполне определённа и её выражают в моль/л.
закон действующих масс: при постоянной температуре скорость химической реакции прямо пропорциональна концентрации реагирующих веществ. nА + mB=gD, v=k CА n CВ m.
молекулярность реакции – это число молекул, участвующих в элементарном акте химического взаимодействия. По этому признаку различают мономолекулярные, бимолекулярные и тримолекулярные реакции.
Порядок реакции — это сумма показателей степеней концентрации веществ в уравнении закона действующих масс. СuО(к) + Н2 (г) = Сu (к) + Н2О(г), v=kC(H2), H2 + I2 = 2HI, v =kC(H2)C(I2).
энергией активации - избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества, называется энергией активации. Молекулы, обладающие такой энергией, называются активными молекулами. С ростом температуры число таких молекул возрастает, поэтому скорость реакции тоже должна увеличиваться.
Факторы, влияющие на скорость химической реакции.
1.Температура (Скорость химических реакций, как правило, при повышении температуры возрастает)
правилом Вант-Гоффа, согласно которому при повышении температуры на каждые 10°С скорость реакции увеличивается примерно в 2—4 раза.
уравнение Аррениуса, ln k = - (Ea/RT) + C (или k = Aexp(-Ea/RT). В этом уравнении константа скорости k связана с экспоненциальным выражением exp(-Ea/RT). Символ еxp означает основание натуральных логарифмов; R- универсальная газовая постоянная; Т — температура по шкале Кельвина; Еа — энергия активации; А — коэффициент пропорциональности
2.Концентрация
3.Природа веществ
4.Присутствие католизатора (Вещества, которые увеличивают скорость химической реакции, оставаясь в конечном итоге неизменными по химическому составу и количеству, называют катализаторами)
Катализ - процесс увеличения скорости реакции с помощью катализатора
1.гомогенный (каталитическое разложение пероксида водорода в водном растворе на воду и кислород в присутствии ионов Cr2O72-)
2.гетерогенный (окисление SO2, до SO3 в присутствии катализатора)
Автокатализ - ускорение химической реакции одним из её продуктов.
Пример гидролиз этил-ацетата в водном растворе:
CH3COOC2H5 + H2O =CH3COOH + C2H5OH.
7Обратимые - Реакции, протекающие одновременно в двух противоположных направлениях.
H2 + I2↔2HI
Необратимые реакции — реакции, при которых взятые вещества нацело превращаются в продукты реакции, не реагирующие между собой при данных условиях
Пример необратимых реакций; Zn+2HCI →ZnCI2 + H2↑
Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой.
Частное от деления произведения равновесных концентраций исходных веществ и продуктов реакции является величиной постоянной и называется - константой равновесия Кр
СC * СD = Кравн СA *СB
Для необратимых процессов Кр →∞.
Если Кр=0 это указывает на полное отсутствие химического процесса.
Принцип Ле Шателье если на систему, находящуюся в равновесии, воздействовать извне, то в системе усилится то из направлений процесса, которое противодействует данному воздействию.
Факторы влияющие на химическое равновесие:
1) температура
При увеличении температуры химическое равновесие смещается в сторону эндотермической (поглощение) реакции, а при понижении в сторону экзотермической (выделение) реакции.
CaCO3=CaO+CO2 -Q t↑
N2+3H2↔2NH3 +Q t↑
2) давление
При увеличении давления химическое равновесие смещается в сторону меньшего объёма веществ, а при понижении в сторону большего объёма. Этот принцип действует только на газы, т.е. если в реакции участвуют твердые вещества, то они в расчет не берутся.
CaCO3=CaO+CO2
1моль=1моль+1моль
3) концентрация исходных веществ и продуктов реакции
При увеличении концентрации одного из исходных веществ химическое равновесие смещается в сторону продуктов реакции, а при увеличении концентрации продуктов реакции-в сторону исходных веществ.
S2+2O2=2SO2
Катализаторы не влияют на смещение химического равновесия!
8Общая характеристика растворов.
Растворами называются гомогенные системы переменного состава, в которых растворенное вещество находится в виде атомов, ионов или молекул, равномерно окруженных атомами, ионами или молекулами растворителя. Любой раствор состоит по меньшей мере из двух веществ, одно из которых считается растворителем, а другое - растворенным веществом. Растворителем считается компонент, агрегатное состояние которого такое же, как и агрегатное состояние раствора. Деление это довольно условно, а для веществ, смешивающихся в любых соотношениях (вода и ацетон, золото и серебро), лишено смысла. В этом случае растворителем считается компонент, находящийся в растворе в большем количестве. Состав растворов может меняться в довольно широких пределах, в этом растворы сходны с механическими смесями. По другим признакам, таким как однородность, наличие теплового эффекта и окраски растворы сходны с химическими соединениями. Растворы могут существовать в газообразном, жидком или твердом агрегатном состоянии. Воздух, например, можно рассматривать как раствор кислорода и других газов в азоте; морская вода - это водный раствор различных солей в воде. Металлические сплавы относятся к твердым растворам одних металлов в других. Раствор, в котором вещество при данной температуре уже больше не растворяется, или иначе, раствор, находящийся в равновесии с растворяемым веществом, называется насыщенным. Пересыщенным называется раствор, в котором при данной температуре содержится большее количество растворенного вещества, чем в насыщенном растворе. Пересыщенный раствор крайне нестабилен и при изменении условий (энергичное встряхивание или внесение активных центров кристаллизации - кристалликов соли, пылинок) образуется насыщенный раствор и кристаллы соли. Раствор, содержащий меньше растворенного вещества, чем насыщенный, называется ненасыщенным раствором.
Гетероге́нная систе́ма — неоднородная система, состоящая из однородных частей (фаз), разделенных поверхностью раздела. Однородные части (фазы) могут отличаться друг от друга по составу и свойствам. Число веществ (компонентов), термодинамических фаз и степеней свободы связаны правилом фаз. Примерами гетерогенных систем могут служить: жидкость — насыщенный пар; насыщенный раствор с осадком; многие сплавы.
Гомоге́нная систе́ма - однородная система, химический состав и физические свойства которой во всех частях одинаковы или меняются непрерывно, без скачков (между частями системы нет поверхностей раздела). В гомогенной системе из двух и более химических компонентов каждый компонент распределен в массе другого в виде молекул, атомов, ионов. Составные части гомогенной системы нельзя отделить друг от друга механическим путем.
В гомогенных смесях составные части нельзя обнаружить ни визуально, ни с помощью оптических приборов, поскольку вещества находятся в раздробленном состоянии на микроуровне. Гомогенными смесями являются смеси любых газов и истинные растворы, а также смеси некоторых жидкостей и твердых веществ, например сплавы.
9Растворы – это однородные (гомогенные) дисперсные системы, состоящие из двух или большего числа компонентов (относительные количества которых могут меняться в широких пределах) и продуктов их взаимодействия.
Способы выражения концентрации растворов.
1) Массовая доля раствора ω (х). Выражается отношением массы растворенного вещества m(х) к массе раствора.
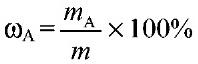
является величиной безразмерной или выражается в процентах:
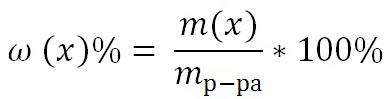 Например,
15%-ный раствор: массовая доля ω (х) = 0,15
Например,
15%-ный раствор: массовая доля ω (х) = 0,15
2) Молярная концентрация раствора С(х). Выражается отношением количества растворенного вещества n(x) к объему раствора, выраженному в литрах.
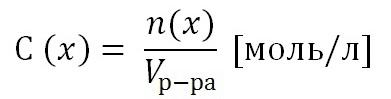
Т.к. количество вещества n(x) выражается отношением массы вещества m(x) к его молярной массе M(x), то молярную концентрацию раствора удобно выразить как
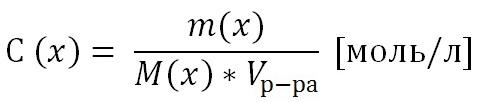
10Растворимость – это способность вещества растворяться в том или ином растворителе.
Растворение представляет собой сложный физико-химический процесс.
Переход растворяемого вещества в раствор осуществляется самопроизвольно, и раствор остается ненасыщенным. Наряду с этим происходит и обратный процесс — его выделение. Со временем скорости этих процессов выравниваются и наступает динамическое равновесие, при котором состав системы не меняется. Энтальпийный и энтропийный факторы процесса становятся одинаковыми, т. е. раствор становится насыщенным.
Мерой растворимости вещества при данных условиях служит концентрация его насыщенного раствора. По растворимости твердые вещества условно делят на легкорастворимые, труднорастворимые (или малорастворимые) и практически нерастворимые.
Растворимость большинства твердых веществ с понижением температуры уменьшается и часть вещества выделяется в кристаллическом виде. Выделение вещества при охлаждении горячего насыщенного раствора называется кристаллизацией.
Химическое растворение основано на химическом превращении, в результате которого можно получить соответствующий раствор целевого продукта. Подобные процессы приводят к образованию растворов молекулярного или ионного типа. Если же растворение не сопровождается такой выраженной реакцией, как при химическом растворении, то процесс ограничивается взаимодействием молекул растворяемого вещества с молекулами растворителя, которое называется сольватацией. Продукты этого взаимодействия называются сольватами.
Растворение можно рассматривать в виде следующих последовательных процессов:
а) разрушение связей в исходном веществе с поглощением энергии (эндотермический процесс)
АВ=А + В
б) сольватация (гидратация) частиц А и В с образованием сольватов (гидратов) и выделением энергии (экзотермический процесс)
А + Н2О-=А-Н2О
В + Н2О-=В*Н2О
11 Коллигативные свойства растворов — это те свойства, которые при данных условиях независимыми от химической природы растворённого вещества.
Идеальные растворы - это растворы в которых внутренняя энергия каждого компонента не зависит от концентрации
закон Рауля показывает, что относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества.
Закон Рауля справедлив для растворов неэлектролитов с очень низкой или высокой концентрацией одного из компонентов
Исследуя замерзание и кипение растворов, Рауль установил следующие закономерности:
1) повышение температуры кипения раствора пропорционально количеству молей растворенного вещества при условии, что количество молей растворителя постоянно:
Δtкип = Еm
2) понижение температуры замерзания раствора пропорционально числу молей растворенного вещества при постоянном количестве растворителя:
Δtзам = Кm
Явление массопереноса растворителя через полупроницаемую мембрану, сквозь которую могут просачиваться малые молекулы, но не способны проходить большие молекулы из разбавленного раствора в раствор более высокой концентрации, называется осмосом.
Давление, которое необходимо создать с той стороны мембраны, где находится раствор, чтобы приостановить осмос, называется осмотическим давлением. Изучение явления осмоса позволило Вант-Гоффу вывести уравнение, в котором показана зависимость осмотического давления от концентрации: осмотическое давление равно тому давлению, которое производило бы растворенное вещество, если бы оно в виде идеального газа занимало тот же объем при той же температуре: P=1000CRT где Р — осмотическое давление раствора, Па; С — концентрация в моль/л; R —универсальная газовая постоянная; Т — абсолютная температура.
12Электролитической диссоциацией - называют распад на катионы и анионы ионных кристаллов при растворении или расплавлении.
Электролитическая диссоциация лежит в основе деления растворов на два класса - растворы неэлектролитов и растворы электролитов. Наблюдаемое различие в коллигативных свойствах разбавленных растворов электролитов и неэлектролитов объясняется тем, что из-за электролитической диссоциации увеличивается общее число частиц в растворе. Это, в частности, приводит к увеличению осмотического давления раствора сравнительнос растворами неэлектролитов, понижению давления пара растворителя над раствором, увеличениюизменения температуры кипения и замерзания раствора относительно чистого растворителя. Электролитической диссоциацией объясняется также ионная электропроводность электролитов.
Самоионизация наблюдается в метиловом спирте, уксусной кислоте, жидком аммиаке и многих других растворителях. Эти растворители называются протонными, или кислыми, поскольку самоионизация обусловлена переносом протона от одной молекулы растворителя к другой. В апротонных растворителях либо совсем не содержится водорода, как, например, в жидком диоксиде серы, либо они так прочно связаны, что перенос просто невозможен.
13 Степенью диссоциации электролита называется отношение числа его молекул, распавшихся в данном растворе на ионы(n), к общему числу его молекул в растворе(N).
ά =n/N ά%=n/N 100%
Степень диссоциации принято обозначать греческой буквой ά и выражать либо в долях единицы, либо в процентах. Так, для 0,1 н. раствора СН3СООН ά = 0,013 (или 1,3%).
Электролиты можно разделить на две группы - сильные и слабые электролиты.
Сильные электролиты в водных растворах диссоциированы практически полностью. Понятие степени диссоциации к ним не применимо. К сильным электролитам принадлежат почти все соли; из кислот и оснований к ним относятся HNO3, HCIO4, НСI, HBr, HI, КОН, NaOH, Ba(OH)2 и Са(ОН)2.
Слабые электролиты в водных растворах диссоциируют только частично, и в растворе устанавливается динамическое равновесие между недиссоциированными молекулами и ионами.
К слабым электролитам относится большинство органических кислот, а из важнейших неорганических соединений к ним принадлежат Н2СО3, H2S, HCN, H2SiО3и NH4OH.
Закон действия масс
Закон действия масс открыт опытным путем К.М. Гульдбергом и П. Вааге в 1867 г. Он гласит: При постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, причем каждая концентрации входит в произведение в степени, равной коэффициенту, стоящему перед формулой вещества в уравнении реакции.
Уравнение химической реакции в общем виде можно представить так:
аА + вВ ↔ сС + dD
Тогда скорость реакции можно выразить уравнением:
V = k*[A]a *[B]b
14Теория сильных электролитов, была предложена Дебаем и Хюккелем. Согласно этой теории, в растворах сильных электролитов между ионами существует электростатическое взаимодействие. Каждый ион окружен ионной атмосферой из противоионов. Ионная атмосфера тормозит движение ионов в электрическом поле, в результате чего создается эффект неполной диссоциации сильного электролита.
Активность компонентов раствора — эффективная (кажущаяся) концентрация компонентов с учетом различных взаимодействий между ними в растворе, то есть с учетом отклонения поведения системы от модели идеального раствор
Активность была предложена в 1907 году Льюисом как новая переменная, применение которой вместо концентрации позволяет использовать для описания свойств реальных растворов относительно простые уравнения, полученные для идеальных систем. Альтернативой этому пути является использование более сложных уравнений, учитывающих взаимодействие между частицами отличается от общей концентрации на некоторую величину.
Отношение активности к общей концентрации вещества в растворе называется коэффициентом активности
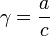
Ионная сила раствора — мера интенсивности электрического поля, создаваемого ионами в растворе.
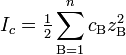
где cB — молярные концентрации отдельных ионов (моль/л), zB заряды ионов.
![]()
где γ — коэффициент активности, А — постоянная, не зависящая от заряда иона и ионной силы раствора, но зависящая от диэлектрической постоянной растворителя и температуры.
15Амфоли́ты — молекулы, в структуре которых присутствуют как кислотные, так и основные группы, существующие в виде цвиттерионов при определённых значениях pH.. Амфолиты образуют растворы с хорошими буферными свойствами. Благодаря способности к выборочной ионизации они противодействуют изменению pH при добавлении кислоты или основания. В присутствии кислот они принимают на себя протоны, удаляя последние из раствора, и противодействуют повышению его кислотности. При добавлении оснований амфолиты высвобождают ионы водорода в раствор, препятствуя возрастанию pH, и тем сохраняя его равновесие.
По Бренстеду-Лоури, кислоты представляют собой вещества, способные отдавать протон, а основания - вещества, присоединяющие протон.
Протолитические равновесия- это реакции, связанные с переносом протона (реакции нейтрализации, гидролиза и диссоциации).
16Вследствие уникальной способности воды растворять различные вещества, в природе чистой воды, т.е. без примесей, не существует. В одном литре пресной воды, употребляемой нами, содержится до 1 г разных веществ. Эти вещества необходимы для обеспечения нашей жизнедеятельности, а так же жизнедеятельности растений и животных. Дистиллированная вода для них так же вредная, как и слишком минерализованная. Из-за способности воды растворять многие химические вещества, при нынешней экологической обстановке, она стала объектом постоянного и интенсивного загрязнения.
Нивелирующий растворитель - растворитель, в котором кислоты и основания различной природы не изменяют соотношения в своей силе
Наиболее эффективные нивелирующие растворители для кислот характеризуются сильноосновными свойствами, например, протофильные растворители, имеющие относительно сильные протонно-акцепторные свойства.
Наиболее эффективными нивелирующими растворителями в отношении оснований являются протогенные растворители, которые обладают ярко выраженными протонодонорными свойствами.
Дифференцирующие растворители, вызывающие у смесей кислот или оснований заметное различие констант диссоциации.
Дифференцирующими растворителями для кислот являются ацетон СН3 - СО-СН3 и другие органические растворители, обладающие меньшим сродством к протону, чем вода.
Применение дифференцирующих растворителей позволяет определять константы диссоциации сильных кислот в этих растворителях. Для двух различных растворителей отношение констант диссоциации кислот одинакового типа ( молекулярные, катионные или анионные кислоты) является приблизительно постоянной величиной.
17 Автопротолиз – гомофазный процесс самоионизации, обратимый процесс передачи протона от одной нейтральной молекулы жидкости к другой и образования в результате равного числа катионов и анионов.
Ионное произведение воды́ — произведение концентраций ионов водорода Н+ и ионов гидроксида OH− в воде или в водных растворах, константа автопротолиза воды.
Вывод значения ионного произведения воды:
Вода, является слабым электролитом, и в небольшой степени диссоциирует:
H2O + H2O ↔ H3O+ + OH−
или
H2O ↔ H+ + OH−
Водоро́дный показа́тель, pH — мера активности ионов водорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный десятичный логарифм активности водородных ионов, выраженной в молях на литр.
Для удобства представления, чтобы избавиться от отрицательного показателя степени, вместо концентраций ионов водорода пользуются их десятичным логарифмом, взятым с обратным знаком, который собственно и является водородным показателем — pH.
В зависимости от соотношения концентраций ионов H+ и OH¯ различают три вида реакции среды:
кислая среда: [H+] > [OH¯]; [H+] > 10-7 моль/л; pH < pOH; pH < 7;
нейтральная среда: [H+] = [OH¯] = 10-7 моль/л; pH = pOH = 7;
щелочная среда: [H+] < [OH¯]; [H+] < 10-7 моль/л; pH > pOH; pH >7;
Таким образом, значения pH всех водных растворов электролитов укладывается в шкалу pH от 0 до 14.
18Гидролиз по аниону: если соль образована славой кислотой и сильным основанием.
NaCN + H2O = HCN + NaOH
Гидролиз по катиону: если соль образована сильной кислотой и слабым основанием.
NH4CI + H20 = NH3 * H20 + HCI
Гидролиз по катиону и по аниону если образована слабой кислотой и слабым основанием.
(необратимый гидролиз).
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
Очень важное значение в промышленности основного органического и нефтехимического синтеза имеет такой процесс, как гидролиз. Применяя его в отношении жиров, целлюлозы и углеводов давно получают мыло, глицерин, этиловый спирт и другие ценные продукты. В области органического синтеза рассматриваемые операции используются главным образом для производства спиртов С2-С5, фенолов, простых эфиров, окисей, многих ненасыщенных соединений, карбоновых кислот и их производных (сложных эфиров, ангидридов, нитрилов, амидов), а также ацетальдегида и других соединений. Перечисленные вещества имеют очень важное применение в качестве промежуточных продуктов органического синтеза, мономеров и фенолов, эфиров акриловой и метакриловой кислот, меламинов, хлоролефинов, акрилонитрилов, пластификаторов и смазочных материалов. Также используют для растворителей (спирты, простые и сложные эфиры, хлоролефины), пестицидов, поверхностно-активных веществ и т.д.
Расчет рН
pН = –lg[H+]
pH = 14 + lg[OH–]
степень гидролиза (β) – отношение концентрации молекул, подвергшихся гидролизу (сгидр) к исходной концентрации растворенной соли (сисх):
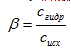
Гидролиз протекает в заметной степени
только в разбавленных растворах,
тогда ![]() следовательно,
следовательно,![]() Это
произведение называется константой
гидролиза (Кг):
Это
произведение называется константой
гидролиза (Кг):
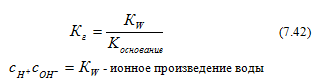
19Буферные системы – в состав в которых поддерживает рH.
Буферные растворы — растворы с определённой устойчивой концентрацией водородных ионов; смесь слабой кислоты и её соли или слабого основания и его соли. Величина рН буферного раствора мало изменяется при добавлении небольших количеств свободной сильной кислоты или щёлочи, при разбавлении или концентрировании.
Буферные растворы имеют большое значение для протекания процессов в живых организмах. Например, в крови постоянство водородного показателя рН поддерживается буферными смесями, состоящими из карбонатов и фосфатов. Известно большое число буферных растворов (ацетатно-аммиачный буферный раствор, фосфатный буферный раствор, боратный буферный раствор, формиатный буферный раствор и др.).
Расчет рН буферных систем
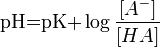
буферная ёмкость раствора — определяет способность раствора сохранять постоянной концентрацию определённых ионов (обычно применяется к ионам H+) при условии, что в растворе протекают химические реакции, или при добавлении к раствору электролитов.
20В теории Льюиса (1923 г.) на основе электронных представлений было ещё более расширено понятие кислоты и основания.
Кислота Льюиса — молекула или ион, имеющие вакантные электронные орбитали, вследствие чего они способны принимать электронные пары. Это, например, ионы водорода – протоны, ионы металлов (Ag+, Fe3+), оксиды некоторых неметаллов (например, SO3, SiO2), ряд солей (AlCl3), а также такие вещества как BF3, Al2O3. Кислоты Льюиса, не содержащие ионов водорода, называются апротонными (апротонная кислота — это химическое соединение, в которое не входит атом водорода, но являющееся акцептором пары электронов. ZnCl2,).
Основание Льюиса — это молекула или ион, способные быть донором электронных пар: все анионы, аммиак и амины, вода, спирты, галогены.
Примеры химических реакций между кислотами и основаниями Льюиса:
AlCl3 + Cl− → AlCl4−
BF3 + F− → BF4−
PCl5 + Cl− → PCl6
21Произведение растворимости (ПР) — произведение концентрации ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
Гетерогенные равновесия в водных растворах характеризуются тем, что перенос частиц происходит через поверхность раздела по крайней мере двух сосуществующих фаз.
По своему характеру двухфазные гетерогенные равновесия достаточно многообразны, но здесь будут затронуты лишь некоторые из них, представляющие наибольший практический интерес и имеющие важное значение в аналитической, физической химии и в различных химических технологиях. К ним, в первую очередь, относятся следующие системы:
1. Твердая фаза (осадок) – жидкая фаза (насыщенный раствор вещества, находящегося в осадке). Эта система имеет большое значение, т.к. в химической практике часто приходится одни вещества отделять от других. Осаждение отделяемого вещества с последующим фильтрованием– один из наиболее простых и часто применяемых приемов разделения. Не менее важен и обратный процесс – переведение малорастворимых веществ в раствор. Это наиболее часто встречающийся в химии случай реакций образования и растворения осадков.
2. Твердая фаза (ионит) – жидкая фаза (раствор). Ионный обмен широко применяется для очистки воды от примесей (умягчение, обессоливание), а также для разделения веществ, близких по своим химическим свойствам, когда обычные методы химического разделения оказываются неэффективными. Здесь речь идет о ионном обмене на поверхности ионитов (катионитов и анионитов).
3. Жидкая фаза (раствор вещества в растворителе I) – жидкая фаза (раствор вещества в растворителе II). Этот случай реализуется тогда, когда некоторое вещество растворено в двух несмешивающихся друг с другом растворителях, причем в одном из них растворимость вещества больше, чем в другом. Практическое применение этого явления носит название экстракции. Экстракция является одним из наиболее применяемых методов разделения веществ как в промышленности, так и в химическом анализе.
22Химическая связь – электронный феномен, заключающийся в том, что по крайней мере один электрон, находившейся в силовом поле своего ядра, оказывается в силовом поле другого ядра или нескольких ядер одновременно.
Основными типами химической связи являются: ковалентная, ионная, металлическая и водородная.
-
Ковалентная - химическая связь, образованная перекрытием пары валентных электронных облаков.
Н *+* Н Н2
Ковалентная связь характеризуется:
1. направленностью в пространстве
2. полярностью
Полярность связи определяется асимметрией в распределении общего электронного облака вдоль оси связи.
А) Если общие электронные пары располагаются симметрично относительно обоих ядер, то такая ковалентная связь называется неполярной.
В молекулах простых веществ — водорода Н2, кислорода О2, азота N2, хлора С12, фтора F2 атомы соединяются неполярной ковалентной связью.
Б) Если общие электронные пары смещаются к одному из атомов (располагаются несимметрично относительно ядер различных атомов), то такая ковалентная связь называется полярной.
Связь в молекулах воды Н2О, аммиака NH3, хлороводорода НС1— полярная.
3.кратностью
4.связи - это равновесное расстояние между ядрами атомов. Длину связи выражают в нанометрах (нм). Чем меньше длина связи, тем прочнее химическая связь. Мерой прочности связи является ее энергия.
5.Энергия связи - это работа, которую необходимо затратить на разрыв связи. Выражают энергию связи в килоджоулях на моль (кДж/моль); например, в молекуле водорода энергия связи равна 435 кДж/моль.
2.Ионная связь
Заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения электронов, называют ионами.
Металлы главных подгрупп I и II групп при соединении с неметаллами главной подгруппы VII группы образуют типичные ионные соединения. Например, хлорид натрия NaCl, фторид калия KF, хлорид кальция СаС12.
Ионные соединения — твердые кристаллические вещества.
3. Водородная связь
Водородная связь образуется за счет сил электростатического притяжения полярных молекул друг к другу, особенно когда они содержат атомы сильно электроотрицательных элементов (F, O, N).
Например, водородные связи образуют HF, H2O, NH3
Водородные связи малоустойчивы и разрываются довольно легко (например, при плавлении льда и кипении воды), но так как на разрыв этих связей требуется затратить некоторую энергию, то температуры плавления и кипения веществ с водородными связями между молекулами оказываются значительно выше, чем у подобных веществ, но без водородных связей.
Многие органические соединения также образуют водородные связи, важную роль водородная связь играет в биологических процессах.
4.Металлическая связь
Химическая связь в металлах между положительными ионами и обобществленными электронами называется металлической связью. Металлическая связь ненаправленна, так как валентные электроны распределены по кристаллу почти равномерно.Металлическая связь характерна только для металлов в твердом или жидком агрегатном состоянии.
23Комплексными соединениями называются - соединения, существующие как в кристаллическом состоянии, так и в растворе, особенностью которых является наличие центрального атома, окруженного лигандами( атом, ион или молекула, связанные с неким центром).
Строение: По координационной теории Вернера в каждом комплексном соединении различают внутреннюю и внешнюю сферу. Центральный атом с окружающими его лигандами образуют внутреннюю сферу комплекса. Ее обычно заключают в квадратные скобки. Все остальное в комплексном соединении составляет внешнюю сферу и пишется за квадратными скобками
В состав комплексных соединений входит атом комплексообразователь, прочно связанные с ним лиганды и ионы противоположного заряда, связанные с атомом комплексообразователем слабее чем лиганды. Атом-комплексообразователь и лиганды при записи формулы заключают в квадратные скобки. Кол-во лигандов зависит от кардиационного чилса атома-комплексообразователя.
Классификация комплексных соединений:
1. по принадлежности комплексного соединения к определенному классу соединений:
комплексные кислоты H 2 [SiF6]. комплексные основания [Ag(NH3)2]OH
комплексные соли K4 [Fe(CN)6]
2. По природе лиганда:
аквакомплексы, аммиакаты, ацидокомплексы (комплексные соединения, в качестве лигандов которых анионы различных кислот, К4 [Fe(CN)6]);
гидрокомплексы (комплексные соединения, в качестве лигандов которых гидроксильные группы, К3 [Al(ОН)6]);
комплексы с макроциклическими лигандами, внутри которых размещается центральный атом.
3. По знаку заряда комплекса:
Катионные – комплексный катион в комплексном соединении [Co(NH3)6]Cl3;
анионные – комплексный анион в комплексном соединении K[PF6];
нейтральные – заряд комплекса равен 0.
4. По внутренней структуре комплекса:
а) В зависимости от числа атомов комплексообразователя: моноядерные – в состав комплексной частицы входит один атом комплексообразователя, например, [Со(NН3)6]Cl3; многоядерные – в составе комплексной частицы несколько атомов комплексообразователя, например, железопротеиновый комплекс.
б) В зависимости от числа видов лигандов в комплексе различают комплексы: однородные (однолигандные), содержащие один вид лиганда, например [Cu(NH3)4]2+ и разнородные (разнолигандные) – два или более видов лигандов, например Pt(NH3)2 С12. В состав комплекса входят лиганды NH3 и Cl—. Для комплексных соединений, содержащих во внутренней сфере различные лиганды, характерна геометрическая изомерия, когда при одинаковом составе внутренней сферы лиганды в ней располагаются по разному относительно друг друга.
Двойные соли – это кристаллические комплексные соединения, образованные из простых солей и имеющие малоустойчивую внутреннюю сферу. Часто формулу двойной соли обозначают перечислением формул простых солей, разделяя их точкой. Например, соль К2[CuCl4] .
Диссоциация.
При растворении в воде комплексных соединений, обычно они распадаются на ионы внешней и внутренней сфер подобно cильным электролитам, так как эти ионы связаны ионогенно, в основном, электростатическими силами. Это оценивается как первичная диссоциация комплексных соединений.
K[Ag(CN) 2] ® К + + [Ag(CN) 2]—
Вторичная диссоциация комплексного соединения – это распад внутренней сферы на составляющие ее компоненты. Этот процесс протекает по типу слабых электролитов, так как частицы внутренней сферы связаны неионогенно (ковалентной связью). Диссоциация носит ступенчатый характер:
Чем меньше значение Кн, тем более устойчивой является внутренняя сфера комплексного соединения, то есть – тем меньше она диссоциирует в водном растворе. В последнее время вместо Кн используют значение константы устойчивости (Ку). Чем больше значение Ку, тем более стабильный комплекс.
К(неус) = [М] * [L] / [ML]
24Окислительно-восстановительные реакции составляют особый класс химических процессов. Их характерной особенностью является изменение степени окисления, по крайней мере, пары атомов: окисление одного (потеря электронов) и восстановление другого (присоединение электронов). Окисление и восстановление, следовательно, такие два полупроцесса, самостоятельное существование каждого из которых невозможно, однако их одновременное протекание обеспечивает реализацию единого окислительно-восстановительного процесса. Хотя главную роль в последнем играют атомы, изменяющие свои степени окисления, окислителями и восстановителями при рассмотрении соответствующих реакций принято называть не отдельные атомы, а вещества, содержащие эти атомы.
Вещества, содержащие атомы, которые понижают свою степень окисления, называют окислителями, а вещества, содержащие атомы, которые повышают степень окисления, - восстановителями.
Окислительно-восстановительные реакции широко распространены в природе и используются в технике. В основе жизни лежат окислительно-восстановительные реакции, происходящие при фотосинтезе, дыхании, транспорте электронов; они же обеспечивают осн. часть энергопотребления человечества за счет сжигания орг. топлива. Получение металлов, извлечение энергии взрыва основано на окислительно-восстановительных реакциях.
25Коллоидные системы — дисперсные системы, промежуточные между истинными растворами и грубодисперсными системами — взвесями.
Строение ДЭС: твердая фаза. Потенциалобразующие ионы. Адсорбционный слой противоионов, диффузный слой противоионов. Мицелла- структурная единица лиофобного коллоида.
Электрокинетические явления, группа явлений, наблюдаемых в дисперсных системах и капиллярах и выражающихся либо в возникновении движения одной из фаз по отношению к другой под действием внешнего электрического поля, либо в возникновении разности потенциалов в направлении относительного движения фаз, вызываемого механическими силами (потенциал течения).
Электрокинетические явления обусловлены существованием на границе фаз избыточных зарядов, располагающихся в виде двух противоположно заряженных слоев, называемых двойным электрическим слоем. Внешнее электрическое поле, направленное вдоль границы фаз, вызывает смещение одного ионного слоя по отношению к другому, что приводит к относительному перемещению фаз, т. е. к электроосмосу(течение жидкости в капиллярах и пористых телах, вызванное внеш. электрич. Полем) или электрофорезу (движение твердых частиц или капель, взвешенных в электролите, при наложении электрич. поля.). Аналогичным образом при течении жидкости или оседании частиц дисперсной фазы наблюдаются явления, обратные электроосмосу и электрофорезу, — относительное движение ионных слоев и пространственное разделение зарядов (поляризация) в направлении движения фаз, т. е. возникновение соответственно потенциалов течения или седиментации.
Электрокинетические явления, группа явлений, наблюдаемых в дисперсных системах и капиллярах и выражающихся либо в возникновении движения одной из фаз по отношению к другой под действием внешнего электрического поля (электроосмос,электрофорез), либо в возникновении разности потенциалов в направлении относительного движения фаз, вызываемого механическими силами (седиментационный потенциал, или эффект Дорна, потенциал течения). Э. я. обусловлены существованием на границе фаз избыточных зарядов, располагающихся в виде двух противоположно заряженных слоев, называемых двойным электрическим слоем.
26Коагуляция (свертывание, сгущение), также старение — объединение мелких частиц дисперсных систем в более крупные под влиянием сил сцепления с образованием коагуляционных структур.
Коагуляция — физико-химический процесс слипания коллоидных частиц.
Коагуляция ведёт к выпадению из коллоидного раствора хлопьевидного осадка или к застудневанию. Коагуляция — естественный, самопроизвольный процесс расслаивания коллоидного раствора на твёрдую фазу и дисперсионную среду. Таким образом дисперсная система стремится достигнуть состояния минимальной энергии.
Значение коагуляции в медицине: процесс образования кровяного сгустка. Стимулом для этого может служить контакт крови с какойлибо поврежденной внутренней поверхностью кровеносного сосуда (внутренней системой (intrinsic system)) или с нарушением целостности мягких тканей (внешней системой (extrinsic system)). Свертывание крови происходит вследствие взаимодействия множества различных веществ (факторов коагуляции). Под влиянием тромбокиназы выделяющийся при разрушении тромбоцитов белок плазмы протромбин превращается в тромбин, под воздействием которого растворенный в плазме белок крови фибриноген превращается в нерастворимый фибрин, волокна которого образуют основу тромба. В результате этого кровь превращается из жидкости в студенистую массу. Процесс свертывания крови играет существенную роль при остановке кровотечений (гемостаз).
27Адсорбция — это, в широком смысле, процесс изменения концентрации у поверхности раздела двух фаз, а в более узком и употребительном — это повышение концентрации одного вещества (газ, жидкость) у поверхности другого вещества (жидкость, твердое тело).
Поглощаемое вещество, ещё находящееся в объёме фазы, называют адсорбтив, поглощённое — адсорбат. В более узком смысле под адсорбцией часто понимают поглощение примеси из газа или жидкости твёрдым веществом (в случае газа и жидкости) или жидкостью (в случае газа) — адсорбентом. При этом, как и в общем случае адсорбции, происходит концентрирование примеси на границе раздела адсорбент-жидкость либо адсорбент-газ. Процесс, обратный адсорбции, то есть перенос вещества с поверхности раздела фаз в объём фазы, называется десорбция.
Поверхностные явления - совокупность явлений обусловленных тем, что силы взаимодействия между частицами, составляющими тело, не скомпенсированы на его поверхности.
К поверхностным явлениям относятся: поверхностное натяжение, капиллярные явления, поверхностная активность, смачивание, адсорбция, адгезия и др.
Способы определения:
Способы определения поверхностного натяжения делятся на статические и динамические. В статических методах поверхностное натяжение определяется у сформировавшейся поверхности, находящейся в равновесии. Динамические методы связаны с разрушением поверхностного слоя.
Статические методы:
1.Метод поднятия в капилляре;
2.Метод Вильгельми;
3.Метод лежачей капли;
4.Метод определения по форме висячей капли;
5.Метод вращающейся капли.
Динамические методы:
1.Метод дю Нуи (метод отрыва кольца);
2.Сталагмометрический, или метод счета капель;
3.Метод максимального давления пузырька;
4.Метод осциллирующей струи;
5.Метод стоячих волн;
6.Метод бегущих волн.
Метод вращающейся капли: Сущностью метода является измерение диаметра капли жидкости, вращающейся в более тяжелой жидкости. Этот способ измерения годится для измерения низких или сверхнизких значений межфазного натяжения. Он широко применяется для микроэмульсий, измерения эффективности ПАВ в нефтедобыче, а также для определения адсорбционных свойств.
Метод Дю Нуи (метод отрыва кольца): Метод является классическим. Сущность метода вытекает из названия. Платиновое кольцо поднимают из жидкости, смачивающей его, усилие отрыва и есть сила поверхностного натяжения и может быть пересчитано в поверхностную энергию. Метод подходит для измерения ПАВ, трансформаторных масел и т. д.
28Абсо́рбция — поглощение сорбата всем объёмом сорбента.
В технике и химической технологии чаще всего встречается абсорбция (поглощение, растворение) газов жидкостями. Но известны и процессы абсорбции газов и жидкостей кристаллическими и аморфными телами (например, абсорбция водорода металлами, абсорбция низкомолекулярных жидкостей и газов цеолитами, абсорбция нефтепродуктов резинотехническими изделиями и т.п.).
Часто в процессе абсорбции происходит не только увеличение массы абсорбирующего материала, но и существенное увеличение его объема (набухание), а также его физических характеристик – вплоть до агрегатного состояния.
На практике абсорбция чаще всего применяется для разделения смесей, состоящих из веществ, имеющих различную способность к поглощению подходящими абсорбентами. При этом целевыми продуктами могут быть как абсорбировавшиеся, так и не абсорбировавшиеся компоненты смесей.
Явления абсорбции широко распространены не только в промышленности, но и в природе (пример - набухание семян), а также в быту. При этом они могут приносить как пользу, так и вред (например, физическая абсорбция атмосферной влаги приводит к набуханию и последующему расслоению деревянных изделий, химическая абсорбция кислорода резиной - к потере ею эластичности и растрескиванию). Из-за фонетической и физической близости обозначаемых понятий абсорбцию часто неправильно называют адсорбцией и наоборот.
Адсорбция из растворов на твердом адсорбенте—• более сложный процесс, чем адсорбция газов.
Поэтому адсорбция из растворов определяется не только силами взаимодействия между молекулами растворенного вещества и адсорбентом, но и взаимодействием растворитель — адсорбент и растворитель — растворенное вещество.
Адсорбция молекулярно растворенного вещества в зависимости от его равновесной концентрации характеризуется обычной (как и для газов) изотермой адсорбции.
Повышение температуры вызывает снижение адсорбции из растворов, но в значительно меньшей степени, чем адсорбцию газов.
Большое влияние на адсорбцию из растворов оказывают природа адсорбента, растворителя и растворенного вещества.
Их не следует применять при адсорбции растворенных веществ из водных растворов, так как они лучше адсорбируют растворитель — воду.
Поэтому, как правило, адсорбция лучше идет из водных растворов и хуже из растворов с органическими растворителями.
На адсорбцию влияет также способность растворителя растворять адсорбтив.
Чем лучше растворитель растворяет адсорбтив, тем адсорбция из раствора идет хуже.
Адсорбция зависит и от строения молекул адсорб-тива.
Например, в спиртовом производстве из водно-спиртовой смеси адсорбцией на угле удаляют сивушные масла.
29Высокомолекулярные соединения обладают специфическим комплексом физико-химических и механических свойств.
Важнейшие из этих свойств:
1.способность образовывать высокопрочные анизотропные высоко- ориентированные волокна и пленки;
2.способность к большим, длительно развивающимся обратимым деформациям;
3.способность в высокоэластичном состоянии набухать перед растворением; высокая вязкость растворов.
Высокомолекулярные соединения могут существовать в кристаллическом и аморфном состояниях. Необходимое условие кристаллизации - регулярность достаточно длинных участков макромолекулярной цепи. В кристаллических полимерах возможно возникновение разнообразных кристаллических форм (фибрилл, сферолитов, монокристаллов и др.), тип которых во многом определяет свойства полимерного материала.
Высокомолекулярные соединения могут вступать в основном в следующие реакции:
1.Образование химичесикх связей между макромолекулами (т. и. сшивание);
2.Распад макромолекулярных цепей на отдельные, более короткие фрагменты;
3.Реакции боковых функциональных групп высокомолекулярных соединений с низкомолекулярными веществами, не затрагивающие основную цепь и приводящие к образованию полимераналогов;
4.Внутримолекулярные реакции, протекающие между функциональными группами одной макромолекулы, направленная внутримолекулярная циклизации.
Некоторые свойства высокомолекулярных соединений например: растворимость, способность к вязкому тёчению, стабильность и др., очень чувствительны к действию небольших количеств примесей или добавок, реагирующих с макромолекулами.
Важнейшие характеристики высокомолекулярных соединений: химический состав, молекулярная масса и молекулярно-массовое распределение, степень разветвленности макромолекулярных цепей, стереорегулярность и др.
30Так как растворимость белков зависит от заряда и наличия гидратной оболочки, то исчезновение одного или обоих этих факторов ведет к осаждению белка и потере его функций. Некоторые способы осаждения позволяют впоследствии восстановить нативные свойства и работоспособность белков.
Обратимость осаждения белков обусловлена сохранением первичной структуры белка. Восстановление физико-химических и биологических свойств белка называется ренативация (ренатурация). Иногда для ренативации достаточно просто удалить повреждающий агент.
Денатурация – необратимое осаждение белка из-за разрыва связей, стабилизирующих четвертичную, третичную, вторичную структуры белка, сопровождаемое изменением растворимости, вязкости, химической активности, снижением или полной потерей биологической функции.
1. Физическая денатурация:
Вызывается повышением температуры, ультрафиолетовым и микроволновым излучением, механическими воздействиями, ионизацией заряженными частицами.
2. Химическая денатурация:
Зависит от природы денатурирующего реагента;
кислоты и щелочи образуют водородные связи с пептидными группами:
органические растворители образуют водородные связи и вызывают дегидратацию;
алкалоиды образуют связи с полярными группами и разрывают систему водородных и ионных связей;
тяжелые металлы взаимодействуют с заряженными радикалами, нейтрализуют отрицательные заряды и разрывают систему водородных и ионных связей.
Высаливание – это добавление к раствору белка нейтральных солей (Na2SO4, (NH4)2SO4). Механизм высаливания заключается во взаимодействии анионов (SO42-) и катионов (Na+, NH4+) с зарядами белка (группы NH4+ и COO–). В результате заряд исчезает, и соответственно, исчезает взаимоотталкивание молекул. Одновременно резко уменьшается гидратная оболочка. Все это приводит к "слипанию" молекул и осаждению.
31ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА, основаны на зависимости физ. св-в в-ва от его природы, причем ана-лит. сигнал представляет собой величину физ. св-ва, функционально связанную с концентрацией или массой определяемого компонента. Физико-химические методы анализа могут включать хим. превращения определяемого соед., растворение образца, концентрирование анализируемого компонента, маскирование мешающих в-в и др. В отличие от "классич." химических методов анализа, где аналит. сигналом служит масса в-ва или его объем, в физико-химических методах анализа в качестве аналит. сигнала используют интенсивность излучения, силу тока, электропроводность, разность потенциалов и др.
Важное практич. значение имеют методы, основанные на исследовании испускания и поглощения электромагн. излучения в разл. областях спектра. К ним относится спектроскопия (напр., люминесцентный анализ, спектральный анализ), нефелометрия и турбидиметрия и др. К важным физико-химическим методам анализа принадлежат электрохим. методы, использующие измерение электрич. св-в в-ва (вольтамперометрия, кондуктометрия, кулонометрия, потенциометрия и т. д.), а также хроматогра-фия (напр., газовая хроматография, жидкостная хроматог-рафия, ионообменная хроматография, тонкослойная хроматография). Успешно развиваются методы, основанные на измерении скоростей хим. р-ций (кинетические методы анализа), тепловых эффектов р-ций (термометрич. титрование), а также на разделении ионов в магн. поле (масс-спектрометрия).
При выполнении физико-химических методов анализа используют специальную, иногда довольно сложную, измерит. аппаратуру, в связи с чем эти методы часто наз. инструментальными. Многие совр. приборы оснащены встроенными ЭВМ, к-рые позволяют находить оптим. условия анализа (напр., спектральную область получения наиб. точных результатов при анализе смеси окрашенных в-в), выполняют расчеты и т. д.
Деление аналит. методов на физ., хим. и физ.-хим. весьма условно. Часто к физико-химическим методам анализа относят, напр., ядерно-физ. методы. В последнее время наметилась тенденция делить методы анализа на хим., физ. и биол.- вовсе без физ.-химических.
32Элементы необходимые организму для построения и жизнедеятельности клеток и органов, называют биогенными элементами.
Существует несколько классификаций биогенных элементов:
А) По их функциональной роли:
1) органогены, в организме их 97,4% (С, Н, О, N, Р, S),
2) элементы электролитного фона (Na, К, Ca, Mg, Сl). Данные ионы металлов составляют 99% общего содержания металлов в организме;
3) Микроэлементы – это биологически активные атомы центров ферментов, гормонов (переходные металлы).
Б) По концентрации элементов в организме биогенные элементы делят:
1) макроэлементы;
2) микроэлементы;
3) ультрамикроэлементы.
Макроэлементы: Эти элементы слагают плоть живых организмов. К макроэлементам относят те элементы, рекомендуемая суточная доза потребления которых составляет более 200 мг. Макроэлементы, как правило, поступают в организм человека вместе с пищей.
Биогенные элементы: Кислород- 65%,Углерод- 18%,Водород- 10%,Азот- 3%.
Эти макроэлементы называют биогенными элементами.
Другие макроэлементы: Рекомендуемая суточная доза > 200 мг: Калий, Кальций, Магний, Натрий, Сера, Фосфор, Хлор.
Микроэлементы: Микроэлементами называются элементы, содержание которых в организме мало, но они участвуют в биохимических процессах и необходимы живым организмам. Рекомендуемая суточная доза потребления микроэлементов для человека составляет менее 200 мг.
Основные микроэлементы: Бром, Железо, Йод, Кобальт, Марганец, Медь, Молибден, Селен, Фтор, Хром, Цинк.
В процессе усвоения организмом витаминов, микроэлементов и макроэлементов возможен антагонизм (отрицательное взаимодействие) или синергизм (положительное взаимодействие) между разными компонентами.
Ультрамикроэлементы составляют менее 0,0000001 % в организмах живых существ, к ним относят золото, серебро оказывают бактерицидное воздействие, ртуть подавляет обратное всасывание воды в почечных канальцах, оказывая воздействие на ферменты. Так же к ультрамикроэлементам относят платину и цезий. Некоторые к этой группе относят и селен, при его недостатке развиваются раковые заболевания.
33s-Элементы - это элементы, у атомов которых электронами заселяются s-подуровни внешнего уровня.
Сокращенная электронная формула элементов IA - группы ns1, IIА - группы ns2 .
Химические свойства. s-элементы легко отдают валентные s-электроны, проявляя сильные восстановительные свойства. Эти вещества - типичные металлы, обладают блеском, высокой электрической и теплопроводностью, химически очень активны.
s-Элементы имеют малые значения энергии ионизации при относительно больших радиусах атомов и ионов. Как правило, они образуют соединения с ионным типом связи, исключение составляет водород, для которого наиболее характерна ковалентная связь.
Н, Na, К, Mg, Са - жизненно необходимы для живых и растительных организмов.
По содержанию в организме человека Н (10%), Na (0,08%) и К (0,23%) относятся к макроэлементам, а остальные щелочные металлы (Li, Rb, Cs) — к микроэлементам. Щелочные металлы в виде различных соединений входят в состав тканей человека и животных. Na и К относятся к жизненно необходимым элементам, участвуют в обмене веществ. Li, Rb, Cs также постоянно содержатся в организме, однако физиологическая и биохимическая роль их мало выяснена.
В стоматологической практике используются раствор НСl, NaCl, NaHCO3, Na2B4O7·10H2O.
Жизненно необходимыми элементами II А - группы являются Са и Mg. В стоматологической практике используются 2CaSO4·H2O, СаС12 и др.; в рентгенологии - BaSО4.
34d-Элементы - это элементы, у атомов которых происходит заселение электронами d-подуровня второго снаружи уровня. К d-блоку относятся 32 элемента ПСЭ. d-Элементы входят в состав 4-7 больших периодов.
В периодах с увеличением заряда ядра возрастание радиуса атомов происходит медленно, непропорционально числу электронов, заполняющих оболочку атомов. Такое «непропорциональное» изменение радиусов объясняется лантаноидным сжатием, а также проникновением ns - электронов под d-электронный слой.
Все атомы d-блока, за исключением группы I Б и II Б, имеют незавершенный d-подуровень. Такие электронные оболочки неустойчивы. Этим объясняется переменная валентность и набор разных степеней окисления d-элементов. В свою очередь, это определяет окислительно-восстановительные свойства большинства соединений d-элементов. В группах Б (сверху вниз) уменьшаются металлические и восстановительные свойства элементов.
В растворах d-элементы с высшей степенью окисления представлены анионами, как правило, кислородсодержащими. При этом соединения с высшей степенью окисления проявляют кислотные и окислительные свойства.
Низкая степень окисления обусловливает основные и восстановительные свойства, ей соответствует катионная форма d-элементов. Амфотерные свойства более типичны для соединений с промежуточной степенью окисления.
В периоде с увеличением заряда ядра уменьшается устойчивость соединений с высшей степенью окисления элементов. И параллельно возрастают окислительные свойства. В группах Б (сверху вниз) увеличивается электроотрицательность элементов, нарастают неметаллические и кислотные свойства.
В группах с увеличением заряда ядра увеличивается устойчивость соединений с высшей степенью окисления, и одновременно уменьшаются их окислительные свойства.
1Б группа(медь, серебро, золото).
II Б группа(цинк, кандий, ртуть, хром, молибден, вольфрам).
VII Б группа(марганец, технеций, рений).
VIII Б группа
Группу VIII Б составляют девять d-элементов: Fе, Co, Ni, Ru, Rh, Pd, Os, Ir, Pt. Общие закономерности четче проявляются по горизонтали, чем по вертикали. Поэтому Fе, Со, Ni объединены в семейство железа. Остальные шесть элементов образуют семейство платины.
35р-Элементы - это элементы, у атомов которых происходит заполнение электронами р - подуровня внешнего уровня.
К р - блоку относятся 30 элементов III А(бор, алюминий, галлий, таллий), IVА(углерод, кремний, германий, олово, свинец), VА(азот, фосфор, мышьяк, сурьма, висмут), VIА(кислород, сера, селен, теллур, полоний),VIIA(фтор,хлор,бром,йод) - групп ПСЭ.
р-Элементы входят во второй и третий малые периоды, а также в четвертый — шестой большие периоды.
В периодах слева направо атомные и ионные радиусы р - элементов по мере увеличения заряда ядра уменьшаются, энергия ионизации и сродство к электрону возрастают, электроотрицательность увеличивается, окислительная активность элементов и неметаллические свойства усиливаются.
В группах радиусы атомов и однотипных ионов, в общем, увеличиваются. Энергия ионизации при переходе от 2р-элементов к 6р-элементам уменьшается, так как по мере возрастания числа электронных оболочек усиливается экранирование заряда ядер электронами, предшествующими внешним электронам. С увеличением порядкового номера р-элемента в группе неметаллические свойства ослабевают, а металлические усиливаются.
На свойства р-элементов и их соединений оказывают влияние как появление новых подуровней на внешней электронной оболочке, так и заполнение подуровня внутренних электронных оболочек. р-Элементы второго периода резко отличаются от элементов последующих периодов. Так, начиная с р-элементов третьего периода, появляется свободный 3d-подуровень.
36 Полифункциональные соединения – это соединения в молекулах которых присутствуют две или более одинаковых функциональных групп.
Гетерофункциональными называют соединения в молекулах которых имеются различные функциональные группы.
С накопление кислотных групп повышаются кислотные свойства соединения. Так ителенглеколь проявляет более сильные кислотные свойства чем этанол, что связано с индуктивным эффектом групп- СН2ОН – СООН.
Наличие дополнительного электроноакцепторного заместителя повышает кислотность.
С накопление амино групп в молекуле повышается основность.
Так ацетамид проявляет нейтральный характер и не реагирует с разбавленными минеральными кислотами, мочевина образует с ними достаточно устойчивые соли.
Хелатообразование также отражает склонность полифункциональных соединений к образованию циклических структур вследствие одновременного участия в реакции нескольких функциональных групп. Хелатообразованием (или хелатиро-ванием) называют процесс возникновения дополнительных неко-валентных связей в тех структурах, в которых атом водорода (или металла), связанный ковалентной связью, ориентирован между двумя электронодонорными фрагментами одной и той же молекулы, предоставляющими этому атому водорода (или металла) дополнительное электронное облако. Эти фрагменты хелатообразователя как бы схватывают атом водорода подобно клешне, что и стало причиной названия таких структур (хелаты, от греческого цгХ - клешня).Одним из частных случаев хелатирования является образование внутримолекулярной водородной связи в моноанионах дикарбоновых кислот или в 1,3-дикарбонильных соединениях, описанное ранее:..Хелатообразование особенно часто происходит с участием атомов металлов с недозаполненными внутренними электронными оболочками - Fe, Cu, Ni, Со, Мп, Mg и т.п. Поэтому хелатирование нередко используют для выделения ионов этих металлов из смесей и для их количественного определения. Кроме того, образование окрашенных соединений (вследствие возникновения хромофорных групп в виде протяжённой сопряжённой системы) даёт возможность использовать хелатирование для качественного обнаружения как полифункциональных группировок, так и ионов металлов. Ион Fe+3 образует с ацетилацетоном енолят…
ЦИКЛИЗАЦИЯ, р-ция внутри- или межмол. образования (замыкания) цикла из ациклич. молекул либо фрагментов карбо- или гетероцикла. Циклизация может осуществляться с помощью р-ций замещения, присоединения, отщепления, а также перегруппировок. Примерами р-ций замещения могут служить внутримол. ацилирование, лактонизация (см. Лактоны), циклокетонизация - образование циклич. кетоновпиролизом солей дикарбоновых к-т (р-ция Ружички), разновидность таких р-ций - циклоконденсация, в результате к-рой цикл образуется из двух или неск. молекул, напр. синтез замещенных циклопропанов из 1,4-дибромолефинов и натриймалонового эфира (р-ция Ипатьева), синтез пирролов из 1,4-дикарбонильных соед. и аммиака или первичных аминов
37Многоатомные спирты - органические соединения, содержащие в своём составе более одной гидроксильной группы -ОН.
Нитроглицерин — сложный эфир глицерина и азотной кислоты.. Широко известен благодаря своим взрывчатым (и в некоторой степени лекарственным) свойствам. Химическая формула CHONO2(CH2ONO2)2. Впервые синтезирован итальянским химиком Асканьо Собреро в 1847 году.
