
- •Лекция 1
- •1. Основные понятия
- •2. Цели естествознания
- •3. Закономерности и особенности развития естествознания.
- •4. Основные стороны и методы естествознания.
- •5. Аспекты и структуры естествознания.
- •6.Общеметодологические проблемы естествознания
- •7. Методология:
- •Лекция 2
- •1. Методология современной физики
- •2. Материя и формы её существования.
- •2.1. Материальное единство мира и единство научного знания.
- •2.2. Материя и движение
- •2.3. Идеалистические толкования движения.
- •3.Проблема возникновение Вселенной.
- •Лекция 3
- •1. Вещество состоит из атомов
- •2.Атомные процессы (испарение и растворение).
- •3. Химические реакции
- •Лекция 4
- •1. Сущность научного метода познания природы.
- •2.Классическая физика
- •3. Квантовая физика
- •Лекция 5
- •1. Физика и химия.
- •2. Физика и биология.
- •3. Физика и астрономия
- •4. Физика и геология.
- •5. Физика и психология.
- •6. С чего все пошло ?
- •Лекция 6
- •1. Основные понятия динамики
- •2 Динамические законы Ньютона
- •3. Закон всемирного тяготения
- •4. Тяготение и относительность
- •Лекция 7
- •1.Философское значение законов превращения и сохранения в современной физике.
- •2. Закон сохранения массы.
- •3. Закон сохранения и превращения энергии
- •3.1. Работа мощность энергия
- •Лекция 8
- •3.2. Кинетическая и потенциальная энергии.
- •3.3. Прочие формы энергии
- •3.4 Закон сохранения энергии
- •4. Закон взаимосвязи массы и энергии
- •Лекция 9
- •5. Закон сохранения импульса.
- •6. Закон сохранения момента импульса.
- •7. Прочие законы сохранения в классической и современной физике.
- •1.Статический и термодинамический методы исследования.
- •2.Основные понятия термодинамики.
- •3. Законы термодинамики. Энтропия.
- •Лекция 11
- •1 Время и пространство
- •2 Время Расстояние и Движение в физике
- •2.1 Движение в физике
- •2.2 Время в физике
- •2.3 Расстояние в физике
3. Законы термодинамики. Энтропия.
Если термодинамическая система неподвижна, то для совершения работы необходимо перемещение взаимодействующих с ней внешних тел, т.е. необходимо изменение внешних параметров системы.
В отсутствие внешних силовых полей обмен энергией между неподвижной системой и внешней средой с помощью совершения работы может происходить лишь при изменении и формы системы.
По закону сохранения энергии работа А совершаемая над системой внешними силами, численно равна и противоположна по знаку работе А, совершаемой системой над внешней средой, т.е. против внешних сил: A’=-A.
Работой расширения называется работа, которую система производит против внешнего давления.
A=PВНЕШН dV
элементарная работа расширения равна:
где PВНЕШН- равномернораспределенное внешнее давление.
dV- элементарное изменение объема системы.
Если процесс расширения является равновесным, то PВНЕШН =P
где P- давление в системе.
Тогда
A=PdV
отсюда
работа равновесного расширения системы
от объема V1
до объема V2
равна:
![]()
![]()
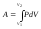
Первый закон (начало) термодинамики.
Опыт показывает, что в соответствии с законом сохранения энергии: Изменение внутренней нергии системы, которое происходит в процессе перехода системы из состояния 1 в состояние 2 U1-2, равно сумме работы совершенной над системой, внешними силами и количества теплоты сообщаемого системе U1-2 =A’1-2 +Q1-2
А так как A’1-2 =-A1-2 , то
U1-2 =Q1-2 - A1-2
Q1-2 = U1-2 +A1-2
где A1-2 - есть работа, совершенная системой над внешними телами в процессе 1 2, то
т.е. иными словами.
Количество теплоты, сообщаемое системе, расходуется на изменение внутренней энергии системы U1-2 и на совершение ею работы против внешних сил..
Для элементарного количества теплоты Q, элементарной работы A и бесконечно малого изменения внутренней энергии U 1-й закон термодинамики имеет вид:
Q=U+A (дифференциальная форма)
В термодинамике принято: Если к системе подводится тепло, то Q>0 ;
Если тепло отводится, то Q<0 ;
Если система производит работу над внешними телами, то A>0 ; Если над системой внешними силами совершается работа, то A<0 .
Если в ходе процесса не производится ни какой работы, в том числе работы против внешнего давления A=pdV=0
dV=0
v=const
т.е. объем системы остается постоянным (изохорический процесс) : U=Qv
где Qv - теплота поглощенная системой в изохорическом процессе.
т.е. в случае термодинамического процесса, протекающего без изменения объема системы, изменение внутренней энергии системы равно количеству теплоты сообщаемому системе.
Если же система периодически возвращается в первоначальное состояние, т.е. совершает круговой процесс , то U1-1 =0 и A1-1 =Q1-1
Отсюда следует, что нельзя построить периодически действующий двигатель, который совершал бы работу большую, чем та которая подводится к двигателю из вне.
Такой двигатель называется вечным двигателем первого рода. Невозможность создания двигателя первого рода является одной из формулировок первого начала термодинамики.
Существенным ограничением первого начала термодинамики является невозможность с его помощью предсказать направление протекания термодинамического процесса.
Любой процесс, при котором не нарушается закон сохранения энергии возможен с точки зрения первого начала термодинамики.
В частности, возможен процесс передачи энергии в форме теплоты от менее нагретого тела к более нагретому.
Возможен также процесс, единственным результатом которого было бы получение теплоты от тела и превращения ее в эквивалентную работу.
Второй закон (начало) термодинамики.
Вторым законом (началом) термодинамики называют полученное опытным путем утверждение о невозможности построения вечного двигателя второго рода.
Вечным двигателем второго рода называется периодически действующее устройство/6 основанное на I законе термодинамики, которое совершает работу за счет охлаждения одного источника теплоты (например внутренней энергии больших водоемов).
Второе начало термодинамики имеет две распространенные формулировки, эквивалентные друг другу.
по Кельвину: невозможен круговой процесс, единственным результатом которого является превращение всей теплоты, полученной от нагревателя в эквивалентную ей работу.
по Клаузиусу: невозможен круговой процесс, единственным результатом которого является передача теплоты от менее нагретого тела к более нагретому.
Из второго закона термодинамики следует неравноценность работы и теплоты, как двух форм передачи энергии.
Т.е.: переход упорядоченного движения тела как целого в хаотическое движение его частиц является необратимым процессом, происходящим без компенсирующих процессов, т.е. самопроизвольно.
Переход же неупорядоченного движения частиц тела в упорядоченное движение тела как целого требует, чтобы одновременно происходил какой-либо компенсирующий процесс.
Здесь мы должны ввести понятия макросостояния и микросостояния системы.
Макросостояние - состояние системы, характеризующееся определенными значениями ее макроскопических свойств ( T, P, V и т.д.)
Микросостояние - состояние системы, характеризующееся определенным состоянием каждой частицы (молекулы или атома); это положение в пространстве и скорости этой частицы по осям xi yi zi ; vxi vyi vzi .
Одно и тоже макросостояние соответствует большому числу различных микросостояний. Макросостояние системы тем более вероятно, чем большим числом микросостояний оно может осуществиться.
Обычно число микросостояний, отвечающих одному и тому же макросостоянию системы, очень велико.
Это связано с тем, что в макроскопических количествах вещества число частиц (молекул или атомов) колоссально велико, а их положения и скорости движения при обычных температурах чрезвычайно разнообразны.
Характеризовать в этом смысле состояние системы оказалось удобнее не самой вероятностью осуществления данного макросостояния (термодинамическая вероятность), а величиной пропорциональной ее логарифму.
Термодинамическая вероятность W состояния системы - это число способов, которыми может быть реализовано данное состояние макроскопической системы, или число микросостояний, осуществляющих данное макросостояние.(по определению термодинамическая вероятность т.е. она не есть вероятность в математическом смысле ).W>>1 P<1
Эта величина называется энтропией .
Энтропия связана с числом равновесных микроскопических состояний, которое можно реализовать данное макроскопическое состояние системы уравнением:
S=K ln W +const (формула Больцмана)
где K - постоянная Больцмана.
Наименьшую энтропию имеют правильно построенные кристаллы при абсолютном нуле температуры.
При нарушении правильности структуры энтропия возрастает, т.к. возрастает скорость частиц, а следовательно и число способов их распределения.
Возрастает энтропия и при переходе вещества из кристаллического состояния в жидкое и далее в газообразное.
Подобно внутренней энергии энтропия зависит только от состояния системы. Но в отличие от других функций состояния системы связь изменения энтропии с теплотой зависит от способа проведения процесса - его скорости.
При бесконечно медленном проведении процесса работа принимает максимально возможное значение.
Такое проведение процесса называется термодинамически обратимым или просто обратимым.
В ряде случаев к обратимому процессу можно приблизиться в экспериментальных условиях с высокой точностью. Например, при плавлении или испарении вещества.
Если процесс проводится обратимо и при постоянной температуре (изотермически), то изменение энтропии связано с поглощаемой теплотой уравнением

где QОБРАТ - количество теплоты, поглощенной системой при изотермическом обратимом процессе.
Отношение

![]() в изотермическом процессе называется
приведенным количеством теплоты.
в изотермическом процессе называется
приведенным количеством теплоты.
Приведенное количество теплоты сообщенное телу на бесконечно малом участке процесса равно
![]()
Приведенное количество теплоты, сообщаемое телу в любом обратимом круговом процессе равно нулю
![]()
из равенства 0 этого интеграла по замкнутому контуру следует, что выражение есть полный дифференциал некоторой функции, которая определяется только состоянием системы и не зависит от пути каким система пришла в это состояние. Таким образом:
S- энтропия
Т.о. энтропия есть термодинамическая функция, показывающая, как изменяется рассеивание энергии при переходе системы из одного состояния в другое в обратимом изотермическом процессе.
Энтропия имеет размерность [ Дж/К]. Как видно из вышеприведенного уравнения имеют одинаковые знаки.
Поэтому при нагревании тела его энтропия возрастает ( ), а если тело охлаждается, то его энтропия убывает ( ).
Рассмотрим некоторые важнейшие свойства энтропии замкнутых систем:
Энтропия замкнутой системы, совершающей обратимый цикл Карно не изменяется: SОБРАТ =0 S=const
Энтропия замкнутой системы, совершающей цикл Карно возрастает: SНЕОБР >0
Энтропия замкнутой системы при любых происходящих в ней процессах не убывает:
S>>0 (неравенство Клаузиуса)
Последний пункт (закон возрастания энтропии) является одной из формулировок II закона термодинамики.
Второе начало термодинамики, установленное для замкнутых систем на Земле, не может быть распространено на всю бесконечную Вселенную.
В середине XIX в. возникла проблема так называемой тепловой смерти Вселенной. Рассматривая Вселенную как замкнутую систему и применяя к ней II начало термодинамики, Клаузиус свел его содержание к утверждению, что энтропия Вселенной должна достигнуть своего максимума.
Это означает, что со временем все формы движения должны перейти в тепловую.
Переход же теплоты от горячих тел к холодным приведет к тому, что температура всех тел во вселенной сравняется, т.е. наступит полное тепловое равновесие и все процессы во Вселенной прекратятся - наступит тепловая смерть Вселенной.
Ошибочность вывода о тепловой смерти заключается в том, что бессмысленно применять второе начало термодинамики к незамкнутым системам, например к такой безграничной и бесконечно развивающейся системе, как Вселенная.
На несостоятельность вывода о тепловой смерти указывал Ф.Энгельс в работе "Диалектика природы".
Третий закон (начало) термодинамики.
Поскольку энтропия, как однозначная функция состояния системы вводится
В связи с этим оказывается невозможным определения абсолютного значения энтропии.
Экспериментальное изучение свойств веществ при сверхнизких температурах привело к установлению третьего закона термодинамики или теоремы Нернеста - Планка.
При любом изотермическом процессе, проведенном при абсолютном нуле температуры, изменение энтропии S=0 и отсюда ST=0 =S0 =const
............ независимо от изменения любых других параметров состояния (например V; P и др.).
Третье начало не позволяет находить абсолютное значение энтропии. Однако постоянство энтропии при Т=0К позволяет выбрать эту постоянную за начало отсчета значений энтропии, т.е. принять S0 =0 (гипотеза Планка).
Другим следствием третьего начала термодинамики является: Теплоемкость любого тела при приближении к абсолютному нулю температуры стремиться к нулю.
Теплоемкостью С тела называется физическая величина, численно равная отношению количества теплоты Q, сообщаемому телу, к изменению dT температуры тела в рассматриваемом термодинамическом процессе.
![]()
Значение С (теплоемкость) зависит от массы тела, его химического состава, термодинамического состояния и процесса, в котором сообщается теплота (изобарный Ср или изохорный ..).
И наконец из третьего начала следует, что невозможен такой процесс, в результате которого тело могло бы быть охлаждено до температуры абсолютного нуля (принцип недостижимости абсолютного нуля температуры).
