
- •Головне видавництво видавничого об'єднання «вища школа»
- •Передмова
- •Предмет аналітичної хімії
- •Сучасні завдання аналітичної хімії
- •Методи аналітичної хімії
- •§ 1. Закон діючих мас
- •§ 2. Теорія електролітичної дисоціації
- •§ 3. Концентрація водневих іонів води. Поняття про рН
- •§ 4. Концентрація водневих іонів розчинів кислот і основ
- •§ 5. Гідроліз. Концентрація водневих іонів розчинів солей
- •§ 6. Буферні розчини
- •§ 7. Графічний метод обчислення рН розчину
- •§ 9. Добуток розчинності
- •§ 10. Вплив однойменних іонів на розчинність осадів
- •§ 11. Розчинність осадів у кислотах
- •§ 12. Розчинність осадів при утворенні комплексів
- •§ 13. Осади кристалічні і неявнокристалічні (аморфні)
- •§ 14. Колоїдні розчини
- •Розділ 3. Комплексні сполуки
- •§ 15. Загальні положення
- •§ 16. Комплексні сполуки з неорганічними лігандами
- •§ 17. Комплексні сполуки з органічними лігандами
- •§ 18. Застосування комплексних сполук в аналізі
- •§ 19. Органічні реактиви
- •Розділ 4. Реакції окислення-відновлення
- •§ 20. Загальна характеристика
- •§ 21. Окислювально-відновний потенціал
- •§ 22. Властивості окислювально-відновного потенціалу. Рівняння Нернста
- •§ 23. Окислювальний потенціал і напрям реакцій окислення-відновлення
- •§ 24. Індуктивні реакції окислення-відновлення
- •§ 25. Хроматографічний аналіз. Іонообмінники
- •§ 26. Екстракція. Інші методи розділення
- •§ 27. Аналіз у розчині та сухий метод аналізу
- •§ 28. Макро-, мікро- і напівмікроаналіз. Краплинний, безстружковий і мікрокристалоскопічний методи аналізу
- •§ 29. Чутливість і специфічність реакцій
- •§ Зо. Хімічні реактиви
- •§ 31. Концентрація розчинів
- •§ 32. Техніка роботи в лабораторії якісного аналізу
- •§ 33. Дробний і систематичний методи якісного аналізу
- •§ 34. Класифікація катіонів на аналітичні групи
- •Розділ 7. І аналітична група катіонів
- •§ 35. Загальна характеристика групи
- •§ 36. Натрій
- •§ 38. Амоній
- •§ 39. Магній
- •§ 40. Аналіз суміші катіонів і аналітичної групи
- •Розділ 8. II аналітична група катіонів § 41. Загальна характеристика групи
- •§ 43. Стронцій
- •§ 44. Кальцій
- •§ 45. Аналіз суміші катіонів і і II аналітичних груп
- •Розділ 9. Ill аналітична група катіонів § 46. Загальна характеристика групи
- •§ 47. Алюміній
- •§ 48. Хром
- •§ 50. Марганець
- •§ 51. Цинк
- •§ 52. Кобальт
- •§ 53. Нікель
- •§ 54. Аналіз суміші катіонів III аналітичної групи
- •§ 56. Аналіз суміші катіонів III, II і і аналітичних груп, що містить фосфат-іони
- •Розділ 10. IV аналітична група катіонів
- •§ 57. Загальна характеристика групи
- •Підгрупа срібла
- •§ 59. Свинець
- •§ 60. Ртуть (і)
- •§ 61. Аналіз суміші катіонів підгрупи срібла
- •IV аналітичної групи
- •Підгрупа міді
- •§ 62. Ртуть (II)
- •§ 64. Кадмій
- •§ 65. Вісмут
- •§ 66. Аналіз суміші катіонів IV—і аналітичних груп
- •Розділ 11. V аналітична група катіонів § 67. Загальна характеристика групи
- •§ 69. Сурма
- •§ 70. Олово
- •§ 71. Аналіз суміші катіонів IV і V аналітичних груп
- •Розділ 12. Аналіз рідкісних елементів § 72. Загальна характеристика
- •§ 73. Титан
- •§ 74. Ванадій
- •§ 75. Молібден
- •§ 76. Вольфрам
- •§ 78. Безсірководневі методи якісного аналізу катіонів
- •Розділ 13. Аналіз аніонів § 79. Класифікація аніонів
- •І група аніонів
- •§ 86. Кремнієва кислота і реакції силікат-іонів SiO|—
- •II група аніонів
- •§ 91. Йодистоводнева кислота і реакції йодид-іонів і
- •§ 92. Сірководнева кислота і реакції сульфід-іонів s2-
- •Ill група аніонів
- •§ 94. Азотна кислота і реакції нітрат-іонів імог
- •§ 95. Азотиста кислота і реакції нітрит-іонів n02
- •§ 96. Оцтова кислота і реакції ацетат-іонів сн3соо
- •§ 97. Хлорнувата кислота і реакції гіпохлорат-іонів сюг
- •§ 98. Аналіз суміші аніонів і—III аналітичних груп
- •§ 100. Розчинення речовини і виявлення катіонів
- •§ 101. Виявлення аніонів
- •§ 102. Аналіз металів і сплавів
- •§ 103. Предмет і значення кількісного аналізу
- •§ 104. Визначення основних компонентів і визначення домішок
- •§ 105. Класифікація хімічних методів кількісного аналізу
- •І. Гравіметричий аналіз1
- •§ 106. Суть методу
- •§ 107. Вимоги до осадів у гравіметричному аналізі
- •§ 108. Співосадження
- •§ 109. Умови осадження
- •§ 110. Відокремлення осаду від маточного розчину
- •§ 111. Переведення осаду у вагову форму
- •§ 112. Принцип дії аналітичних терезів
- •§ 113. Правила користування аналітичними терезами і зважування на них
- •Розділ 18. Приклади гравіметричних визначень
- •§ 114. Розрахунки у гравіметричному аналізі
- •0,3115 Г становить 100%;
- •0,5025 Г становить 100%; 0,0874 г » х%,
- •§ 115. Визначення заліза у вигляді оксиду
- •§ 116. Визначення сульфатів у вигляді сульфату барію
- •§ 117. Розділення і визначення кальцію і магнію
- •§ 118. Визначення нікелю в сталях
- •II. Титриметричний аналіз Розділ 19. Загальні положення титриметричного аналізу
- •§ 119. Суть методу
- •§ 120. Концентрація розчинів і розрахунки в титриметричному аналізі
- •§ 121. Приготування робочих розчинів
- •§ 122. Методи непрямого титрування
- •§ 123. Точка еквівалентності
- •§ 124. Установлення точки еквівалентності за допомогою індикаторів
- •§ 125. Мірний посуд
- •§ 126. Перевірка мірного посуду
- •§ 127. Титрування кислотами та основами
- •§ 128. Індикатори методу кислотно-основного титрування (методу нейтралізації)
- •§ 129. Вибір індикаторів при титруванні кислотами та основами
- •§ 130. Криві титрування
- •§ 131. Помилки титрування
- •2NaHc03 ї± н20 -f- c02 -f Na2c03.
- •§ 132. Робочі розчини методу кислотно-основного титрування
- •§ 133. Приклади застосування методу кислотно-основного титрування (методу нейтралізації)
- •§ 134. Криві титрування
- •§ 135. Індикатори методів окислення-відновлення
- •§ 136. Еквівалент у реакціях окислення-відновлення
- •Розділ 22. Перманганатометрія
- •§ 137. Загальна характеристика методу. Приготування робочого розчину перманганату калію
- •§ 138. Визначення заліза
- •§ 139. Визначення пероксиду водню
- •§ 140. Визначення нітритів
- •Розділ 23. Йодометрія
- •§ 141. Загальна характеристика методу
- •§ 142. Приготування робочих титрованих розчинів
- •§ 143. Йодометричне визначення міді
- •§ 144. Йодометричне визначення активного хлору в хлорному вапні
- •B/r. WNa,s203l/NaliS!03јCl " 10°
- •§ 145. Йодометричне визначення сірки
- •Розділ 24. Метод осадження § 146. Загальна характеристика методу
- •§ 147. Індикатори
- •§ 148. Помилки титрування в методі осадження
- •§ 149. Робочі розчини і вихідні речовини методу осадження
- •§ 150. Визначення галогенід-іонів
- •Розділ 25. Методи комплексоутворення
- •§ 151. Загальні положення методів комплексоутворення
- •§ 152. Меркуриметричне визначення хлоридів
- •§ 153. Комплексонометричне визначення твердості води
- •III. Спектрофотометричний і колориметричний методи аналізу Розділ 26. Загальні положення
- •§ 154. Суть методів
- •§ 155. Загальні умови колориметричного визначення
- •§ 156. Закон Бугера—Ламберта—Бера
- •§ 157. Методи вимірювання інтенсивності забарвлення
- •§ 159. Визначення міді в грунтах
- •§ 160. Загальні положення
- •§ 161. Наближене визначення рН
- •§ 162. Безбуферні методи визначення рН
- •§ 163. Буферний метод визначення рН
- •IV. Аналіз різних матеріалів Розділ 29. Аналіз продуктів харчування § 164. Визначення кислотності хліба і молока
- •§ 165. Аналіз грунту і води
- •§ 166. Визначення оксидів кальцію і магнію в доломіті
- •Розділ 31. Аналіз добрив
- •§ 167. Визначення фосфору в суперфосфаті
- •§ 168. Визначення калію в калійних добривах
- •§ 169. Визначення азоту в аміачних добривах
- •Додатки
- •Кислоти
- •Густина розчинів їдких калі і натру
§ 125. Мірний посуд
У попередньому розділі ми розглянули загальні положення титрометричного аналізу, яких треба додержувати при проведенні точних аналітичних визначень. Нагадуємо, що першою умовою є вміння приготовляти робочі розчини точно відомої концентрації. Друга важлива умова — правильне встановлення точки еквівалентності, що в свою чергу залежить від вибору відповідного індикатора. Нарешті, не менш важливе значення мають способи точного вимірювання об'ємів розчинів, які витрачаються на титрування. Навіть при умові правильного виготовлення робочих розчинів і правильного встановлення точки еквівалентності у визначенні можна припустити велику помилку, якщо не додержувати певних правил при вимірюванні об'ємів. У цьому розділі ми розглядаємо посуд, який застосовують для вимірювання об'ємів розчинів, а також способи користування ним та його перевірки.
Для точного вимірювання об'ємів розчинів в титриметричному аналізі використовують мірні колби, піпетки і бюретки. Кожний з цих видів посуду має цілком певне призначення. Мірні колби — це колби з подовженими шийками, відносно малого діаметра, з пришліфованими скляними пробками (рис. 33). На шийці колби позначена її місткість у мілілітрах і температура, при якій налитий до риски розчин займає зазначений об'єм. Звичайно колби калібрують при температурі 20° С. Це означає, що об'єм розчину, налитого в колбу до риски, відповідає зазначеному об'єму тільки при 20° С. При вищій температурі об'єм колби внаслідок термічного розширення скла стає трохи більшим від зазначеного і, навпаки, зниження температури зумовлює деяке його зменшення. Зміна температури повітря в межах 3—4° Свтой чи інший бік мало впливає на зміну об'єму колби, тому при звичайних визначеннях цією помилкою можна нехтувати. Надто точні визначення треба робити так, щоб температура робочого розчину в колбі
397
дорівнювала температурі, зазначеній на ЇЇ поверхні, або вносити в розрахунок концентрації розчину відповідну поправку.
гот
Мірні колби великої місткості (500—1000 мл) призначені головним чином для приготування робочих розчинів. Наважку вихідної речовини переносять з годинникового скла в колбу через суху лійку з широкою шийкою. Скло і лійку старанно промивають водою, наливають у колбу воду приблизно до її половини і перемішують розчин до повного розчинення речовин. Треба мати на увазі, що розчинення часто супроводиться охолодженням або нагріванням розчину. У цих випадках треба почекати, поки температура розчину зрівняється з температурою повітря. Після цього в колбу доливають воду
Н
гот
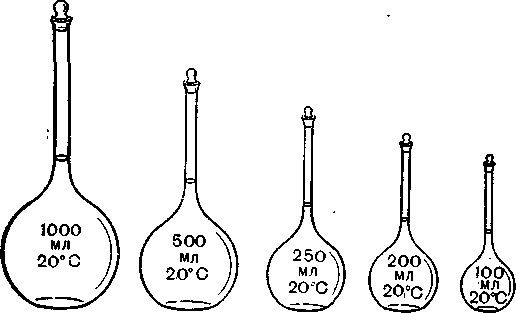
Рис. 33. Мірні колби.
Рис. 34. Піпетки.
майже до риски. Останні порції води треба добавляти дуже обережно, поки нижній меніск рідини в колбі торкнеться колової риски на її шийці. Для цього зручно користуватись піпеткою або крапельницею.
При спостереженні рівня меніска око спостерігача повинно бути в одній горизонтальній площині з рискою колби. На шийці колби вище від риски не повинні затримуватись окремі краплини води. Довівши об'єм розчину до риски, колбу закривають прошліфованою пробкою і старанно перемішують розчин збовтуванням.
Мірними колбами меншої місткості (200—250 мл) також можна користуватись для приготування робочих розчинів. Але їх частіше використовують для розчинення аналізованої речовини. З колби відбирають для титрування певну частину розчину, що дає можливість зробити кілька паралельних титрувань, користуючись однією Н£Е£>ьксю. ДЧ{иі колби мають на шийці в більшості випадків одну риску. Такі колби калібровані на вливання, тобто об'єм налитого в колбу розчину відповідає її номінальному об'єму. Але вилитий з колби розчин матиме трохи менший об'єм, тому що частина розчину змочує стінки і залишається в колбі. Отже, мірні колби з однією рискою непридатні для відмірювання пев-
398
них об'ємів розчинів. Колби з двома рисками на шийці калібровані одночасно на вливання і виливання. Об'єм розчину, налитого в колбу до верхньої риски, трохи більший за номінальний, але коли цей розчин вилити з колби, то його об'єм точно дорівнюватиме зазначеному.
Піпетки (рис. 34) призначені для відбирання певної кількості розчину і відповідно до цього калібровані на виливання; об'єм вилитого розчину дорівнює номінальній місткості піпетки. Циліндрична піпетка з поділками, нанесеними по всій її довжині, не зовсім точна, використовується для приблизного відмірювання розчинів. В аналітичній практиці більш поширені піпетки з розширенням, які мають на тонкій шийці одну риску. Найбільш поширені піпетки місткістю 5, 10, 20, 25 і 50 мл. Піпетки на 1, 3, 100 і 250 мл застосовують рідше.
Піпетку перед використанням треба добре вимити. Критерієм чистоти піпетки є рівномірне змочування водою її внутрішньої поверхні і повне стікання води чи розчину із стінок. Неможна користуватись піпетками, на стінках яких затримуються окремі краплини, тому що розчин у цьому випадку відмірюватиметься неточно. Забруднену піпетку найкраще очистити, зануривши її у високий циліндр, наповнений хромовою сумішшю. Через деякий час піпетку виймають і добре споліскують спочатку водопровідною, а потім дистильованою водою і витирають зверху насухо (або висушують у штативі).
При користуванні піпетками треба додержувати певних правил. При наповненні піпетки її кінчик весь час повинен бути занурений у розчин, інакше в неї може проникнути повітря і розчин попаде в рот працюючому. Рідину обережно втягують ротом крізь верхній отвір піпетки, стежачи, щоб рівень розчину піднявся лише трохи вище від риски. Після цього вказівним пальцем закривають отвір, виймають з розчину піпетку і зайвий розчин випускають, обережно відсуваючи вбік палець. Нижній меніск розчину повинен бути на одному рівні з рискою. При цьому треба звертати увагу на те, щоб піпетка була у вертикальному положенні, а око спостерігача — на одній горизонтальній площині з її рискою. Слід мати на увазі, що для правильного відмірювання певної кількості розчину піпеткою істотне значення має швидкість його витікання з останньої. При великій швидкості витікання частина розчину не встигає вилитись і залишається на стінках. Найповніше виливання буває тоді, коли швидкість витікання в секундах чисельно дорівнює місткості піпетки в мілілітрах. Так, розчин з піпетки місткістю 25 мл повинен витікати приблизно за 25 с. Нижній отвір піпетки звичайно має саме такий отвір, щоб це співвідношення додержувалось. Якщо цього немає, то треба сповільнювати витікання розчину, закриваючи верхній отвір піпетки вказівним пальцем.
При виливанні кінчик піпетки повинен доторкатися до стінок посудини, щоб розчин не розбризкувався. Звичайно після виливання в кінчику піпетки залишається трохи розчину. Не слід видувати цей залишок, тому що його враховують при нанесенні риски.
Бюретки (рис. 35) призначені для титрування, тобто для повільного вливання робочого розчину в розчин визначуваної речовини. Як видно з
399
рисунка, бюретка являє собою циліндричну трубку з краном і нанесеними по всій довжині поверхні великими та малими поділками. Великі поділки яронумеровані зверху вниз; об'єм розчину між двома сусідніми поділками звичайно дорівнює 1 мл. Відстань між великими поділками поділена малими поділками ще на десять чи п'ять частин; отже, ціна кожної малої поділки дорівнює 0,1 або 0,2 мл. Треба, проте, зазначити, що бюреткою можна вимірювати об'єми з точністю до 0,02—0,03 мл, оцінюючи на око положення
меніска рідини між двома малими поділками.
Бюретки найчастіше мають місткість 50 і 25 мл; бюретками на 10 мл користуються рідше.
о
%
■=-w
їм
=50
![]()
Рис. 35. Бюретки.
У нижній частині бюретка має пришліфований скляний кран, призначений для повільного випускання розчину. Шліф крана треба змащувати тонким шаром вазеліну; це полегшує його повертання і усуває можливість утворення плівки сухих солей на поверхні шліфа внаслідок випаровування розчину. Плівка солей часто настільки міцно затискає в отворі кран, що його дуже важко відкрити, особливо після того, як бюреткою з розчином деякий час не користувалися. Це найчастіше спостерігається, коли в бюретці є розчин їдкого лугу. У таких випадках замість скляного крана краще користуватись затвором з гумової трубки, усередині якої міститься скляна кулька. Гумову трубку надівають одним кінцем на нижній кінець бюретки без крана, а в другий кінець трубки вставляють скляну трубочку з відтягнутим кінцем. Розчин з бюретки випускають, натискаючи двома пальцями на скляну кульку і трохи відтягуючи вбік гуму, що прилягає до скляної кульки.
Бюретку перед користуванням треба добре вимити. Це найлегше зробити за допомогою так званого «йоржа». Критерієм чистоти, як і в попередніх випадках, є повне змочування рідиною поверхні внутрішніх стінок бюретки. Вимиту бюретку споліскують спочатку дистильованою водою, а потім 2—З рази невеликими порціями того робочого розчину, який наливатиметься в бюретку. Робочий розчин наливають у бюретку за допомогою лійки. Коли бюретка наповниться розчином, лійку обов'язково треба зняти. Треба стежити за тим, щоб кінчик бюретки нижче скляного крана або гумового затвора був заповнений розчином і щоб у цьому кінчику не залишилося повітря. Інакше під час титрування бульбашки повітря можуть бути витиснуті з кінчика струменем розчину, що витікає з бюретки; це призведе до помилки у визначенні об'єму розчину, витраченого на титрування. Бульбашки повітря можна витиснути з кінчика бюретки різними способами. Іноді для цього досить налити в бюретку розчин і повністю відкрити кран. Можна також занурити кінчик бюретки в розчин, відкрити кран і зверху засмоктати
400
розчин у бюретку. При гумовому затворі треба повернути капіляр кінцем догори і випустити з бюретки трохи ршчшіу.
Точність вимірювання об'єму розчину бюреткою залежить від додержання повних правил спостереження за рівнем меніска рідини. У більшості випадків відлік роблять за п п жнім м є и і с к о м. Винятком є ти-
а 5
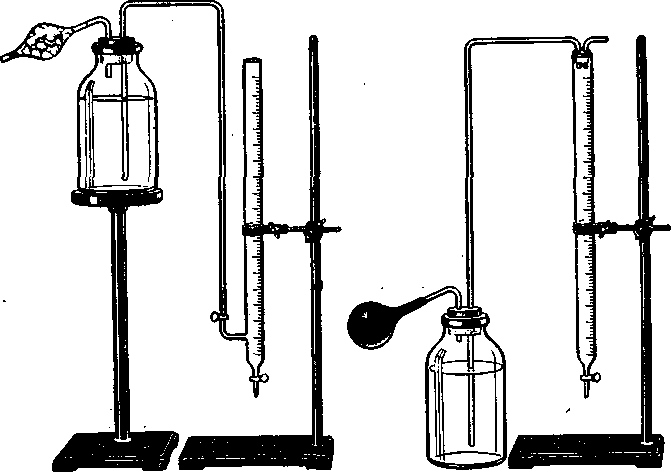
Рис. 36. Пристрої для зберігання запасних титрованих розчинів.
трування інтенсивно забарвленими розчинами, наприклад йоду чи перманганату, коли нижній меніск важко побачити; у цих випадках відлік роблять за верхнім меніском. Меніск найкраще видно при певному освітленні.
Рівень розчину перед титруванням установлюють на нульовій поділці бюретки. Саме титрування проводять так. Під бюретку підставляють конічну колбу з розчином, колбу тримають за шийку правою рукою і перемішують розчин, обертаючи колбу. Лівою рукою відкривають кран і регулюють ним швидкість витікання робочого розчину. Звичайно перше титрування вважають орієнтовним, і тому тут можна щоразу випускати з бюретки по 2—3 мл розчину. Коли першим титруванням буде встановлено приблизну кількість розчину, потрібного для визначення, у колбу наливають ще стільки досліджуваного розчину і повторюють титрування. Нехай, наприклад, перше орієнтовне титрування дало такі наслідки: після добавлення 20 мл робочого розчину індикатор ще не змінив свого кольору, а доливання ще 2 мл розчину спричинило зміну забарвлення індикатора. Друге повторне титрування тоді роблять так. Перші 20 мл розчину виливають з бюретки
401
швидше, ніж при першому титруванні, а потім починають добавляти його окремими краплинами, весь час стежачи за забарвленням індикатора в колбі. Після досягнення кінцевої точки титрування чекають 1—2 хв, поки розчин повністю стече із стінок бюретки, а тоді обчислюють кількість витраченого на титрування розчину з точністю до 0,02—0,03 мл. Ніколи не можна

Рис. 37. Бюретка Рис. 38. Пристрої для зберігання запасних титро-
Кравезінського. ваних розчинів в атмосфері інертного газу.
обмежуватись лише одним визначенням; треба повторити титрування з новими такими самими об'ємами досліджуваного розчину ще 1—2 рази. Визначення можна вважати правильним, якщо розходження в об'ємі розчину, витраченого на титрування, не перевищує 0,1—0,2 мл.
У заводських і науково-дослідних лабораторіях, де щодня доводиться робити багато визначень, склянку з робочим розчином зручно сполучити з бюреткою так, щоб останню можна було наповнювати автоматично. Для цього використовують різні системи сполучення; деякі з них показано на рис. 36. З рис. 36, а видно, що бюретку можна наповнити за допомогою крана, але в цьому випадку треба мати спеціальні бюретки з бічними нижніми кранами. Звичайну бюретку зручно наповнювати за допомогою гумової груші, як показано на рис. 36, б. Певні переваги має бюретка Кравезін-ського (рис. 37). Розчин нагнітають у неї, як і в попередньому випадку, гумовою грушею, але рівень рідини встановлюється на нульовій поділці бюретки автоматично. З рисунка видно, що зайвий розчин виливається назад у склянку через трубку, що міститься всередині бюретки. Іноді доводиться використовувати робочі розчини речовини, які легко окислюються киснем
402
повітря. У цьому випадку розчин у бюретці і в склянці треба тримати в атмосфері СОо або іншого інертного газу. Найпростіше застосувати для цього прилад, схему якого подано па рис. 38.
