
- •Головне видавництво видавничого об'єднання «вища школа»
- •Передмова
- •Предмет аналітичної хімії
- •Сучасні завдання аналітичної хімії
- •Методи аналітичної хімії
- •§ 1. Закон діючих мас
- •§ 2. Теорія електролітичної дисоціації
- •§ 3. Концентрація водневих іонів води. Поняття про рН
- •§ 4. Концентрація водневих іонів розчинів кислот і основ
- •§ 5. Гідроліз. Концентрація водневих іонів розчинів солей
- •§ 6. Буферні розчини
- •§ 7. Графічний метод обчислення рН розчину
- •§ 9. Добуток розчинності
- •§ 10. Вплив однойменних іонів на розчинність осадів
- •§ 11. Розчинність осадів у кислотах
- •§ 12. Розчинність осадів при утворенні комплексів
- •§ 13. Осади кристалічні і неявнокристалічні (аморфні)
- •§ 14. Колоїдні розчини
- •Розділ 3. Комплексні сполуки
- •§ 15. Загальні положення
- •§ 16. Комплексні сполуки з неорганічними лігандами
- •§ 17. Комплексні сполуки з органічними лігандами
- •§ 18. Застосування комплексних сполук в аналізі
- •§ 19. Органічні реактиви
- •Розділ 4. Реакції окислення-відновлення
- •§ 20. Загальна характеристика
- •§ 21. Окислювально-відновний потенціал
- •§ 22. Властивості окислювально-відновного потенціалу. Рівняння Нернста
- •§ 23. Окислювальний потенціал і напрям реакцій окислення-відновлення
- •§ 24. Індуктивні реакції окислення-відновлення
- •§ 25. Хроматографічний аналіз. Іонообмінники
- •§ 26. Екстракція. Інші методи розділення
- •§ 27. Аналіз у розчині та сухий метод аналізу
- •§ 28. Макро-, мікро- і напівмікроаналіз. Краплинний, безстружковий і мікрокристалоскопічний методи аналізу
- •§ 29. Чутливість і специфічність реакцій
- •§ Зо. Хімічні реактиви
- •§ 31. Концентрація розчинів
- •§ 32. Техніка роботи в лабораторії якісного аналізу
- •§ 33. Дробний і систематичний методи якісного аналізу
- •§ 34. Класифікація катіонів на аналітичні групи
- •Розділ 7. І аналітична група катіонів
- •§ 35. Загальна характеристика групи
- •§ 36. Натрій
- •§ 38. Амоній
- •§ 39. Магній
- •§ 40. Аналіз суміші катіонів і аналітичної групи
- •Розділ 8. II аналітична група катіонів § 41. Загальна характеристика групи
- •§ 43. Стронцій
- •§ 44. Кальцій
- •§ 45. Аналіз суміші катіонів і і II аналітичних груп
- •Розділ 9. Ill аналітична група катіонів § 46. Загальна характеристика групи
- •§ 47. Алюміній
- •§ 48. Хром
- •§ 50. Марганець
- •§ 51. Цинк
- •§ 52. Кобальт
- •§ 53. Нікель
- •§ 54. Аналіз суміші катіонів III аналітичної групи
- •§ 56. Аналіз суміші катіонів III, II і і аналітичних груп, що містить фосфат-іони
- •Розділ 10. IV аналітична група катіонів
- •§ 57. Загальна характеристика групи
- •Підгрупа срібла
- •§ 59. Свинець
- •§ 60. Ртуть (і)
- •§ 61. Аналіз суміші катіонів підгрупи срібла
- •IV аналітичної групи
- •Підгрупа міді
- •§ 62. Ртуть (II)
- •§ 64. Кадмій
- •§ 65. Вісмут
- •§ 66. Аналіз суміші катіонів IV—і аналітичних груп
- •Розділ 11. V аналітична група катіонів § 67. Загальна характеристика групи
- •§ 69. Сурма
- •§ 70. Олово
- •§ 71. Аналіз суміші катіонів IV і V аналітичних груп
- •Розділ 12. Аналіз рідкісних елементів § 72. Загальна характеристика
- •§ 73. Титан
- •§ 74. Ванадій
- •§ 75. Молібден
- •§ 76. Вольфрам
- •§ 78. Безсірководневі методи якісного аналізу катіонів
- •Розділ 13. Аналіз аніонів § 79. Класифікація аніонів
- •І група аніонів
- •§ 86. Кремнієва кислота і реакції силікат-іонів SiO|—
- •II група аніонів
- •§ 91. Йодистоводнева кислота і реакції йодид-іонів і
- •§ 92. Сірководнева кислота і реакції сульфід-іонів s2-
- •Ill група аніонів
- •§ 94. Азотна кислота і реакції нітрат-іонів імог
- •§ 95. Азотиста кислота і реакції нітрит-іонів n02
- •§ 96. Оцтова кислота і реакції ацетат-іонів сн3соо
- •§ 97. Хлорнувата кислота і реакції гіпохлорат-іонів сюг
- •§ 98. Аналіз суміші аніонів і—III аналітичних груп
- •§ 100. Розчинення речовини і виявлення катіонів
- •§ 101. Виявлення аніонів
- •§ 102. Аналіз металів і сплавів
- •§ 103. Предмет і значення кількісного аналізу
- •§ 104. Визначення основних компонентів і визначення домішок
- •§ 105. Класифікація хімічних методів кількісного аналізу
- •І. Гравіметричий аналіз1
- •§ 106. Суть методу
- •§ 107. Вимоги до осадів у гравіметричному аналізі
- •§ 108. Співосадження
- •§ 109. Умови осадження
- •§ 110. Відокремлення осаду від маточного розчину
- •§ 111. Переведення осаду у вагову форму
- •§ 112. Принцип дії аналітичних терезів
- •§ 113. Правила користування аналітичними терезами і зважування на них
- •Розділ 18. Приклади гравіметричних визначень
- •§ 114. Розрахунки у гравіметричному аналізі
- •0,3115 Г становить 100%;
- •0,5025 Г становить 100%; 0,0874 г » х%,
- •§ 115. Визначення заліза у вигляді оксиду
- •§ 116. Визначення сульфатів у вигляді сульфату барію
- •§ 117. Розділення і визначення кальцію і магнію
- •§ 118. Визначення нікелю в сталях
- •II. Титриметричний аналіз Розділ 19. Загальні положення титриметричного аналізу
- •§ 119. Суть методу
- •§ 120. Концентрація розчинів і розрахунки в титриметричному аналізі
- •§ 121. Приготування робочих розчинів
- •§ 122. Методи непрямого титрування
- •§ 123. Точка еквівалентності
- •§ 124. Установлення точки еквівалентності за допомогою індикаторів
- •§ 125. Мірний посуд
- •§ 126. Перевірка мірного посуду
- •§ 127. Титрування кислотами та основами
- •§ 128. Індикатори методу кислотно-основного титрування (методу нейтралізації)
- •§ 129. Вибір індикаторів при титруванні кислотами та основами
- •§ 130. Криві титрування
- •§ 131. Помилки титрування
- •2NaHc03 ї± н20 -f- c02 -f Na2c03.
- •§ 132. Робочі розчини методу кислотно-основного титрування
- •§ 133. Приклади застосування методу кислотно-основного титрування (методу нейтралізації)
- •§ 134. Криві титрування
- •§ 135. Індикатори методів окислення-відновлення
- •§ 136. Еквівалент у реакціях окислення-відновлення
- •Розділ 22. Перманганатометрія
- •§ 137. Загальна характеристика методу. Приготування робочого розчину перманганату калію
- •§ 138. Визначення заліза
- •§ 139. Визначення пероксиду водню
- •§ 140. Визначення нітритів
- •Розділ 23. Йодометрія
- •§ 141. Загальна характеристика методу
- •§ 142. Приготування робочих титрованих розчинів
- •§ 143. Йодометричне визначення міді
- •§ 144. Йодометричне визначення активного хлору в хлорному вапні
- •B/r. WNa,s203l/NaliS!03јCl " 10°
- •§ 145. Йодометричне визначення сірки
- •Розділ 24. Метод осадження § 146. Загальна характеристика методу
- •§ 147. Індикатори
- •§ 148. Помилки титрування в методі осадження
- •§ 149. Робочі розчини і вихідні речовини методу осадження
- •§ 150. Визначення галогенід-іонів
- •Розділ 25. Методи комплексоутворення
- •§ 151. Загальні положення методів комплексоутворення
- •§ 152. Меркуриметричне визначення хлоридів
- •§ 153. Комплексонометричне визначення твердості води
- •III. Спектрофотометричний і колориметричний методи аналізу Розділ 26. Загальні положення
- •§ 154. Суть методів
- •§ 155. Загальні умови колориметричного визначення
- •§ 156. Закон Бугера—Ламберта—Бера
- •§ 157. Методи вимірювання інтенсивності забарвлення
- •§ 159. Визначення міді в грунтах
- •§ 160. Загальні положення
- •§ 161. Наближене визначення рН
- •§ 162. Безбуферні методи визначення рН
- •§ 163. Буферний метод визначення рН
- •IV. Аналіз різних матеріалів Розділ 29. Аналіз продуктів харчування § 164. Визначення кислотності хліба і молока
- •§ 165. Аналіз грунту і води
- •§ 166. Визначення оксидів кальцію і магнію в доломіті
- •Розділ 31. Аналіз добрив
- •§ 167. Визначення фосфору в суперфосфаті
- •§ 168. Визначення калію в калійних добривах
- •§ 169. Визначення азоту в аміачних добривах
- •Додатки
- •Кислоти
- •Густина розчинів їдких калі і натру
§ 108. Співосадження
Після переведення наважки в розчин розділення компонентів досліджуваної речовини є одним з найвідповідальніших етапів аналізу. Від чіткого розділення компонентів залежить успішне виконання аналізу. У більшості випадків визначуваний компонент відокремлюють у формі осаду. Вище було розглянуто заходи, за допомогою яких можна зменшити розчинність і забезпечити практично повне осадження. Проте для відокремлення осаду повнота осадження є умовою необхідною, але недостатньою.
Щоб дістати правильні результати аналізу, відокремлення компонента також повинно бути повним, тобто осад має бути чистим, без домішок. Експериментально встановлено, що в процесі роботи осад звичайно захоплює з розчину сторонні речовини, які самі собою при цих умовах розчинні. Забруднення осаду призводить до помилок при зважуванні, а також при визначенні тих компонентів, які повинні залишитися в розчині. Так, якщо до розчину суміші солей ВаС12 і FeCl3 долити сірчаної кислоти, то сульфат барію, який при цьому випадає в осад, частково захоплює сульфат заліза, хоч ця сіль добре розчиняється і повинна була б при таких умовах залишитись у розчині.
З наведеного прикладу видно, що характер забруднення осаду сульфату барію іонами заліза інший, ніж при спільному осадженні групи катіонів у вигляді фосфатів, карбонатів або сульфідів. У перелічених випадках таке спільне осадження легко передбачити за даними розчинності відповідних сполук. Так, якщо до розчину ацетату алюмінію, в якому міститься ацетат заліза, долити розчин гідрофосфату натрію, то разом з фосфатом алюмінію осаджуватиметься і фосфат заліза. У такому випадку відбувається не захоплення фосфату заліза осадом фосфату алюмінію, бо FeP04 навіть при відсутності алюмінію є нерозчинною сполукою, а спільне осадження обох солей. На підставі величин розчинності відповідних осадів можна легко передбачити, що коли до розчину солей барію і свинцю долити сірчаної кислоти, то ці катіони випадуть в осад у вигляді сульфатів. Але передбачити перехід
339
добре розчинного сульфату заліза в осад сульфату барію на основі порівняння величин розчинності обох речовин зовсім неможливо. Проте при осадженні сульфату барію в присутності іонів заліза осад завжди в більшій або меншій мірі забруднений залізом. Про це свідчить колір осаду, який після прожарювання буде не чисто білим (колір BaS04), а забарвленим у коричневий колір оксиду заліза (III). Таке забарвлення зумовлене тим, що при прожарюванні сульфат заліза розкладається за рівнянням
Fe2(S04)3 = Fe203 + 3S03.
Перехід в осад сторонніх компонентів, які самі собою в таких умовах не осаджуються, називається співосадженням.
Співосадження розчинних речовин — дуже поширене явище. Характерною ознакою його є те, що в більшості випадків воно спостерігається тільки під час утворення осаду. Так, при зливанні розчинів ВаС12 і H2S04 повинен утворюватись осад, який містить тільки іони Ва"+ і SC>4—. Проте виявляється, що в осаді є помітна кількість іонів С\~ у вигляді хлориду барію. Отже, хлорид барію, який добре розчиняється у воді, опинився в осаді при утворенні сульфату барію. Але коли до розчину хлориду барію добавити чистого сульфату барію, то іони хлору в осад не переходять.
При осадженні сульфату барію осад захоплює з розчину різні сторонні речовини, найчастіше катіони заліза, кальцію, аніони NO^~, С1~ тощо. Захоплені речовини не відмиваються водою. Утворення оксалату кальцію в присутності солей магнію веде до захоплення осадом СаС204 помітної кількості іонів магнію. При осаджуванні аміаком гідроксиду заліза в присутності солей нікелю осад Fe (ОН)3 захоплює помітні кількості нікелю, хоч в індивідуальному стані нікель за цих умов і утворює розчинний аміачний комплекс. Присутність нікелю в осаді Fe (OH)3 легко довести так. Осад промивають водою або розчином аміаку до одержання зовсім безбарвного фільтрату. Потім осад гідроксиду заліза розчиняють у кислоті і повторюють осадження аміаком. При цьому внаслідок утворення комплексних іонів [Ni (NH3)6] + розчин над осадом забарвлюється в синій колір.
При відокремленні кремнієвої кислоти з розчину силікатів захоплюються домішки багатьох речовин, які в цих умовах досить розчинні. Ці домішки не відмиваються ні водою, ні кислотою. Щоб мати точні результати, кремнієву кислоту після прожарювання обробляють фтористою кислотою і знову прожарюють. Вміст Si02 визначають за втратою маси. Твердий залишок, що являє собою суміш захоплених кремнієвою кислотою домішок (оксид заліза та інших металів), переводять у розчин і приєднують до основного фільтрату.
Співосадження має велике значення для аналітичної хімії. Це явище негативно впливає на повноту розділення і визначення елементів. Тому при виконанні аналізу треба вжити відповідних заходів для максимального усу нення явища співосадження. \
Поряд з цим співосадження має і позитивне значення для аналізу. Часто це явище використовують при визначенні малих кількостей елементів, на-
3-10
приклад для вилучення й аналізу рідкісних і радіоактивних елементів. Коли концентрація визначуваної речовини в розчині дуже мала, цю речовину часто не вдається перевести в осад. Це зумовлено тим, що при добавлянні оеаджувача не вдається досягти величини добутку розчинності відповідного осаду, або тим, що утворюється колоїдний розчин. У таких випадках для вилучення визначуваного мікрокомпонента в осад використовують явище співосадження. Для цього в розчині утворюють відповідний осад іншої сполуки, який у процесі свого утворення захоплює визначуваний мікрокомпо-нент. Наприклад, концентрація іонів РЬ2+ в природній воді звичайно дуже мала, і тому важко знайти реагент, за допомогою якого можна було б перевести в осад мікрокількість свинцю. Отже, для того щоб свинець випав в осад, треба збільшити його концентрацію в розчині; це можна зробити випарюванням 10 л досліджуваної води до об'єму 100 мл. Але такий спосіб забирає багато часу н енергії; крім цього, водночас збільшується концентрація інших компонентів, які містяться у воді, що заважає проведенню дальшого аналізу. Набагато швидше й зручніше можна досягти концентрування свинцю за допомогою співосадження його з осадом СаС03, який утворюється прн добавлянні до досліджуваної води розчину Na2C03. При утворенні карбонату кальцію цей осад захоплює з води іони свинцю. Потім осад СаС03 відфільтровують і розчиняють у невеликій кількості оцтової кислоти. Концентрація свинцю в такому розчині буде достатньою, і цей елемент можна визначити без особливих труднощів.
Такий метод вилучення мікрокомпонентів з дуже розбавлених розчинів називається осадженням з колектором. Колектором називають осад, який захоплює з розчину визначуваний мікрокомпонент. У наведеному вище прикладі колектором є осад СаС03, а мікрокомпонентом — свинець.
За основними характерними рисами процесів явища співосадження поділяються на такі головні три типи:
Адсорбція речовин на поверхні осаду. Для цього типу співосадження характерним є те, що захоплена речовина перебуває на поверхні. Але адсорбовані компоненти тримаються дуже міцно, іноді навіть не відмиваються водою. Особливістю цього типу співосадження є те, що при цьому можливий іонний обмін між електролітами розчину і захопленими речовинами. У таких випадках за допомогою іонного обміну можна усунути захоплені осадом компоненти.
Оклюзія. Це такий тип співосадження, коли захоплена речовина міститься всередині кристалів основного осаду. Співосадження такого типу відбувається при утворенні кристалічних осадів. Захоплений осадом компонент важко вилучити.
Післяосадження. Цей тип співосадження відзначається тим, що осад забруднюється сторонніми речовинами не під час формування, а тоді, коли осад вже утворився. Наприклад, при осадженні кальцію у вигляді оксалату в присутності магнію осад оксалату кальцію внаслідок співосадження частково забруднюється солями магнію. Але якщо залишити осад оксалату кальцію з розчином на тривалий час, то згодом і магній починає випадати у вигляді оксалату.
ЗН
Адсорбція на поверхні осадів. Чистота й інші властивості осаду великою мірою залежать від явищ, які відбуваються на його поверхні. Іони або молекули на поверхні твердої речовини перебувають в інших умовах, ніж ті, які містяться всередині частинок. Ці останні іони або молекули зв'язані з сусідніми в усіх напрямах, так що сили, які діють між ними, взаємно зрівноважуються. В іонів або молекул поверхневого шару зрівноважуються тільки ті сили, які напрямлені всередину частинки і в площині самої поверхні. Так, на іони, що містяться всередині кристала типу NaCl, діють електричні сили шести іонів, які його оточують. Водночас іони, що містяться на поверхні кристала, оточені тільки п'ятьма іншими іонами. Тому на поверхні осаду і залишається вільне силове поле, за рахунок якого притягуються з розчину протилежно заряджені частинки. Внаслідок цього процесу на поверхні осаду утворюється адсорбційний шар. Між частинками, що адсорбувались, і частинками, які є в розчині, установлюється динамічна рівновага. Стан цієї рівноваги залежить від багатьох факторів. Наведемо найголовніші з них.
Поверхня осаду. Процес адсорбції полягає в тому, що частинки з розчину притягуються поверхнею осаду. Кількість адсорбованої речовини зростає із збільшенням поверхні осаду. Поверхня кристалічних осадів порівняно невелика, тому адсорбція сторонніх речовин таким осадом незначна. Найбільше значення має явище адсорбції для аморфних осадів у зв'язку з їх дуже великою поверхнею. Співосадження при аморфних осадах зумовлене головним чином адсорбцією на поверхні.
Загальна поверхня тієї самої кількості речовини значно збільшується при зменшенні величини зерна. Так, кубічний кристал з довжиною ребра 1 см має поверхню 6 см2. Якщо такий куб розділити на дрібні кубики з довжиною ребра 1 мм, то виходить 1000 кубиків. Поверхня кожного кубика дорівнюватиме 6 мм2, а загальна поверхня — 6000 мм2, або 60 см2. Отже, при зменшенні розміру частинок у 10 раз у стільки ж разів збільшується загальна поверхня речовини.
Крім розміру поверхні кристалів, адсорбція великою мірою залежить від природи осаду. Так, гідрофобні осади слабко адсорбують молекули води і випадають у вигляді щільної маси. Такі осади займають невеликий об'єм і порівняно добре відокремлюються фільтруванням. Прикладом гідрофобних осадів можуть бути сульфіди металів. Ці осади в присутності електролітів легко і швидко коагулюють.
Зовсім інша картина спостерігається при утворенні гідрофільних осадів. Частинки таких осадів, наприклад кремнієвої кислоти, адсорбують велику кількість води, важко коагулюють і утворюють об'ємні маси у формі гелів.
Гідрофільність або гідрофобність деяких осадів залежить від умов осадження. Так, при осадженні гідроксиду магнію в присутності надлишку іонів магнію утворюється гідрофобний осад, а в присутності надлишку лугу — гідрофільний осад.
Вплив концентрації сторонніх речовин на чистоту осаду. Адсорбція сторонніх речовин збільшується з підвищенням їх концентрації в ррзчині.
342
Вплив концентрації речовин, які адсорбуються на чистому осаді, характеризується кривою (рис. 26). З рисунка видно, що в розбавлених розчинах адсорбція менша. Проте слід мати на увазі, що при осадженні з таких розчинів збільшується об'єм і поверхня аморфного осаду. Чистіший осад аморфної форми утворюється з концентрованих розчинів, тому що в цих умовах поверхня осаду зменшується.
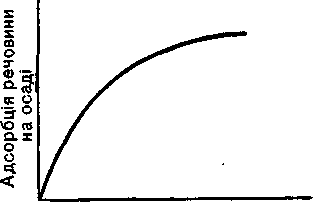
Адсорбція — процес екзотермічний. Тому підвищення температури сприяє десорбції. Отже, при нагріванні кількість адсорбованої осадом речовини зменшується. Тому в аналітичній практиці осадження аморфних осадів, наприклад гідроксиду заліза, проводять з концентрованих і гарячих розчинів. При цьому поряд із зменшенням поверхні осаду ослаблюється адсорбція сторонніх речовин. Коли осад випаде, розчин розбавляють гарячою водою, внаслідок чого концентрація сторонніх речовин у маточному розчині знижується і забруднення осаду зменшується.
Природа присутніх у розчині іонів. Концентрація речовини в розчині
У розчині звичайно містяться різні Рис. 26. Залежність адсорбції речови- іони. Проте адсорбція іонів відзнача- Ни від її концентрації в розчині.
ється вибірністю: осад краще адсорбує
ті іони, які з іонами осаду утворюють нерозчинні або малодисоційовані сполуки. Зокрема, найбільше адсорбуються власні (однойменні) іони осаду, які містяться в розчині у надлишку. Так, коли в маточному розчині разом з осадом хлориду срібла присутні аніони СР і NOi~, то більше адсорбуються іони СР- Коли разом з осадом хлориду срібла в розчині містяться катіони Na+ і Ag+, то більше адсорбуються іони Ag+. Адсорбовані на поверхні осаду іони притягують іони протилежного заряду, які порівняно легко обмінюються на інші іони при промиванні розчином електроліту.
Умови осадження. Адсорбція великою мірою залежить від умов осадження, а саме: від порядку доливання реагуючих речовин, швидкості їх доливання і кислотності середовища. Наприклад, коли до розчину нітрату срібла повільно доливати розчин хлориду натрію, то частинки осаду AgCl, які при цьому утворюються, у розчині стикатимуться з надлишком AgN03. У цих умовах осад адсорбуватиме іони Ag+, а не іони СР, які повністю витрачені на утворення осаду. Разом з адсорбованими іонами срібла до поверхні осаду притягуються іони протилежного заряду — NOr. Отже, у присутності надлишку нітрату срібла утворюється осад AgCl, забруднений домішкою нітрату срібла. Коли порядок зливання розчинів поміняти, тобто до розчину NaCl повільно доливати розчин AgN03, то на поверхні осаду будуть адсорбовані молекули нітрату натрію. Адсорбція водневих або гідроксильних іонів сама собою не впливає на результати аналізу, тому що при прожарюванні осаду ці іони звітрюються. Проте ці іони можуть притягувати протилежно заряджені іони і впливати на точність розділення. Наприклад, при осаджуванні
343
заліза надлишком гідроксиду амонію осад Fe (OH)3 адсорбує гідроксильні іони, які в свою чергу можуть притягувати з розчину різні катіони (Са2+, Mg2+ тощо). Внаслідок цього процесу осад забруднюється домішками сторонніх катіонів. Осад гідроксиду заліза, що утворюється в слабкокислому розчині (без надлишку NH4OH), адсорбує іони Н+. У таких умовах частинки осаду мають позитивний заряд, через що мало адсорбують інші катіони. Тому при відокремленні заліза від кальцію і магнію краще не застосовувати надлишку гідроксиду амонію. При осаджуванні гідроксиду заліза із слабкокислого розчину адсорбуються аніони. Отже, для відокремлення заліза від іонів SO2- краще застосовувати надлишок гідроксиду амонію.
Оклюзія. Крім адсорбції на поверхні, сторонні речовини захоплюються з розчину під час зростання та укрупнення первинних частинок осаду і внаслідок цього процесу переходять всередину кристалів. Такий тип співосаджен-ня називається оклюзією. Це явище найхарактерніше для кристалічних осадів. Так, багато осадів, особливо при повільній їх кристалізації, містять оклюдовану воду, яка відокремлюється тільки при прожарюванні або висушуванні при великій температурі. Інших сторонніх речовин, захоплених осадом внаслідок оклюзії, позбутись дуже важко, що може бути причиною серйозних помилок в аналізі.
Причини забруднення осадів у результаті оклюзії різні. Оклюзія може бути внаслідок утворення хімічних сполук, утворення ізоморфних кристалів, внутрішньої адсорбції.
Утворення хімічних сполук. Причину співосадження іноді пояснюють утворенням певних сполук основної речовини осаду з домішками. Вважають, наприклад, що, .поряд з основною реакцією утворення сульфату барію Ва2+ + SOJf = BaS04, забруднення осаду Ва$04 хлоридом або сульфатом калію відбувається внаслідок утворення таких сполук:
|
0 О-К |
|
* ' |
Ва-Сі |
А • |
\ |
У/ ^ |
0 0 |
0 0 |
V* |
ч |
s4 |
Ва |
' * |
/ |
0 0 |
0 0 |
/ |
* / |
Ва-СІ |
S |
|
* ч~ |
|
0 О-К |
Проте такі хімічні сполуки утворюються дуже рідко. Осади різного хімічного складу дійсно утворюються в тих випадках, коли іони здатні утворювати комплексні сполуки. Наприклад, при осадженні свинцю із солянокислого розчину сірководнем спостерігається співосадження іонів СІ-. Це зумовлено тим, що в розчині містяться комплексні іони [РЬС1]+, які з сірководнем утворюють оранжево-червоного кольору осад [PbClL S*. Аналогічна сполука білого кольору [HgCl]2 S * утворюється при осаджуванні іонів Hg""r
* Якщо добавити надлишок H2S, ці сполуки перетворюються в звичайні сульфіди.
344
з солянокислого розчину сірководнем. Проте явище оклюзії найчастіше зумовлюється причинами іншого характеру, ніж утворення хімічних сполук.
Утворення ізоморфних кристалів. Однією з важливих причин співосадження є ізоморфізм багатьох іонів і сполук. Нагадаємо, що ізоморфними називаються речовини, здатні утворювати спільну кристалічну решітку, причому утворюються так звані мішані кристали. Прикладом речовин, однотипних за будовою кристалічних решіток, можуть бути різні галуни. Так, алюмінієвий і хромовий галуни здатні утворювати кристали, в яких містяться обидва ці галуни.
Часто явище ізоморфізму (роль ізоморфізму у співосадженні вперше встановив акад. В. Г. Хлопін) пояснюється тим, що іони з близькими радіусами можуть заміщувати один одного в кристалічній решітці. Наприклад, радіус іона Ra2+ (0,152 нм) за своїм розміром близький до радіуса іона Ва2+ (0,143 нм); сульфати радію і барію ізоморфні. Тому при осадженні BaS04 в присутності навіть дуже незначної кількості іонів радію останні разом з іонами барію утворюють спільні кристали. Наслідком цього процесу є ізоморфне співосадження сульфату радію із сульфатом барію.
У ряді випадків співосадження буває зумовлене близькістю параметрів кристалічних решіток різних сполук. Так, при осадженні BaS04 з розчину, в якому міститься КМп04, утворюється осад рожевого кольору. Цей осад при промиванні не знебарвлюється, тому що КМп04 міститься в решітці кристалів.
Принцип ізоморфізму використовують при виборі колектора (основний осад) для співосадження малих кількостей речовини з розбавлених розчинів. Прикладом може бути застосування осаду BaS04 для співосадження радію.
Мішані кристали утворюють не тільки речовини, які мають близькі за будовою кристалічні решітки. У ширшому розумінні системи, що утворюють мішані кристали, називають твердими розчинами. Відомі тверді розчини різних солей, силікатів, металевих сплавів тощо. У ряді випадків співосадження також зв'язане з утворенням твердих розчинів.
Внутрішня адсорбція. У багатьох випадках причиною співосадження є адсорбція домішок на поверхні кристала під час його зростання. Ця форма співосадження спостерігається найчастіше при утворенні деревоподібних кристалічних зростків (дендритів). Від центра кристалізації виростає головна вісь, а від неї в усі боки відходять гілки. У процесі кристалізації ці гілки зростають і утворюють кістяк кристала (лід на поверхні віконного скла, сніжинки). Часто первинні кристали осадів також виділяються у вигляді дендритів з великою розвинутою поверхнею. На цій поверхні адсорбуються з розчину окремі іони, які «заростають» новими кристалами і залишаються всередині великого кристала. Деякі іони домішок при утворенні нового шару кристала можуть заміщатись іонами, які входять в основну решітку кристала. Проте залежно від порядку і швидкості зливання розчинів та інших умов більша або менша частина домішок залишається всередині кристала і не відмивається при промиванні осаду. Наприклад, коли осад BaS04 утворюється в присутності надлишку солі хлориду барію, то під час зростання кристалів він адсорбуватиме іони Ва2+. А тому що осад і розчин
345
повинні бути електронейтральними, то разом з іонами Ва + до поверхні частинок осаду притягуються іони СІ-. При дуже повільному осадженні, тобто в умовах, коли кристали зростають дуже повільно, іони S04_ з розчину встигають замістити частину іонів СІ- і оклюзія хлориду барію мало помітна. Якщо кристали зростають швидко, то захоплені частинками осаду іони СІ- не встигають обмінятись місцями з іонами S04— і співосадження ВаС12 буває значним.
Сульфат барію захоплює різні речовини. При цьому спостерігається, що більше адсорбуються солі барію, в яких розчинність менша. Так, нітрат барію більше захоплюється осадом BaS04, ніж хлорид барію, бо перша сіль менш розчинна. Тому при осадженні сульфатів краще користуватись розчином хлориду барію.
Ступінь оклюзії залежить від концентрації домішки в розчині: з підвищенням її концентрації оклюзія збільшується.
Регулюванням таких факторів, як порядок зливання розчинів і швидкість осадження, можна змінювати ступінь співосадження, адсорбцію одних іонів замінити іншими. Проте, щоб осад був чистим, його треба розчинити (кислотою) і знову осадити (аміаком або лугом). При повторному осадженні концентрація домішки значно зменшується, через що ступінь співосадження стає незначним. Кількість повторних осаджень залежить від ступеня забруднення осаду, природи осаду, характеру адсорбованої домішки, мети аналізу і ряду інших факторів. При точних аналізах завжди користуються повторним осадженням; цей прийом називається переосадженням.
У тих випадках, коли осад (наприклад, BaS04, Si02 тощо) у кислотах не розчиняється, вміст домішки визначають в осаді після його зважування і в результати аналізу вносять відповідну поправку.
Післяосадження. Явище післяосадження — це поступове утворення другого осаду з реакційної суміші при стоянні після того, як основний осад випав.
Це явище зумовлюється різними причинами. Наприклад, при відокремленні свинцю від цинку сірководнем у кислому розчині спочатку випадає чистий сульфід свинцю. Проте, коли сульфід свинцю відфільтрувати не відразу, а через якийсь час після його утворення, то осад внаслідок процесу післяосадження виявляється забрудненим сульфідом цинку. У цьому випадку причиною післяосадження цинку є адсорбція сульфідом свинцю з розчину іонів S _, концентрація яких на частинках осаду збільшується до величини, достатньої для осадження сульфіду цинку.
В інших випадках причиною післяосадження є те, що осад, який утворився зразу, стає центром кристалізації для осадження другої речовини. Так, коли залишити осад оксалату кальцію в маточному розчині, в якому міститься магній, то через якийсь час починає осаджуватись оксалат магнію.
