
- •Головне видавництво видавничого об'єднання «вища школа»
- •Передмова
- •Предмет аналітичної хімії
- •Сучасні завдання аналітичної хімії
- •Методи аналітичної хімії
- •§ 1. Закон діючих мас
- •§ 2. Теорія електролітичної дисоціації
- •§ 3. Концентрація водневих іонів води. Поняття про рН
- •§ 4. Концентрація водневих іонів розчинів кислот і основ
- •§ 5. Гідроліз. Концентрація водневих іонів розчинів солей
- •§ 6. Буферні розчини
- •§ 7. Графічний метод обчислення рН розчину
- •§ 9. Добуток розчинності
- •§ 10. Вплив однойменних іонів на розчинність осадів
- •§ 11. Розчинність осадів у кислотах
- •§ 12. Розчинність осадів при утворенні комплексів
- •§ 13. Осади кристалічні і неявнокристалічні (аморфні)
- •§ 14. Колоїдні розчини
- •Розділ 3. Комплексні сполуки
- •§ 15. Загальні положення
- •§ 16. Комплексні сполуки з неорганічними лігандами
- •§ 17. Комплексні сполуки з органічними лігандами
- •§ 18. Застосування комплексних сполук в аналізі
- •§ 19. Органічні реактиви
- •Розділ 4. Реакції окислення-відновлення
- •§ 20. Загальна характеристика
- •§ 21. Окислювально-відновний потенціал
- •§ 22. Властивості окислювально-відновного потенціалу. Рівняння Нернста
- •§ 23. Окислювальний потенціал і напрям реакцій окислення-відновлення
- •§ 24. Індуктивні реакції окислення-відновлення
- •§ 25. Хроматографічний аналіз. Іонообмінники
- •§ 26. Екстракція. Інші методи розділення
- •§ 27. Аналіз у розчині та сухий метод аналізу
- •§ 28. Макро-, мікро- і напівмікроаналіз. Краплинний, безстружковий і мікрокристалоскопічний методи аналізу
- •§ 29. Чутливість і специфічність реакцій
- •§ Зо. Хімічні реактиви
- •§ 31. Концентрація розчинів
- •§ 32. Техніка роботи в лабораторії якісного аналізу
- •§ 33. Дробний і систематичний методи якісного аналізу
- •§ 34. Класифікація катіонів на аналітичні групи
- •Розділ 7. І аналітична група катіонів
- •§ 35. Загальна характеристика групи
- •§ 36. Натрій
- •§ 38. Амоній
- •§ 39. Магній
- •§ 40. Аналіз суміші катіонів і аналітичної групи
- •Розділ 8. II аналітична група катіонів § 41. Загальна характеристика групи
- •§ 43. Стронцій
- •§ 44. Кальцій
- •§ 45. Аналіз суміші катіонів і і II аналітичних груп
- •Розділ 9. Ill аналітична група катіонів § 46. Загальна характеристика групи
- •§ 47. Алюміній
- •§ 48. Хром
- •§ 50. Марганець
- •§ 51. Цинк
- •§ 52. Кобальт
- •§ 53. Нікель
- •§ 54. Аналіз суміші катіонів III аналітичної групи
- •§ 56. Аналіз суміші катіонів III, II і і аналітичних груп, що містить фосфат-іони
- •Розділ 10. IV аналітична група катіонів
- •§ 57. Загальна характеристика групи
- •Підгрупа срібла
- •§ 59. Свинець
- •§ 60. Ртуть (і)
- •§ 61. Аналіз суміші катіонів підгрупи срібла
- •IV аналітичної групи
- •Підгрупа міді
- •§ 62. Ртуть (II)
- •§ 64. Кадмій
- •§ 65. Вісмут
- •§ 66. Аналіз суміші катіонів IV—і аналітичних груп
- •Розділ 11. V аналітична група катіонів § 67. Загальна характеристика групи
- •§ 69. Сурма
- •§ 70. Олово
- •§ 71. Аналіз суміші катіонів IV і V аналітичних груп
- •Розділ 12. Аналіз рідкісних елементів § 72. Загальна характеристика
- •§ 73. Титан
- •§ 74. Ванадій
- •§ 75. Молібден
- •§ 76. Вольфрам
- •§ 78. Безсірководневі методи якісного аналізу катіонів
- •Розділ 13. Аналіз аніонів § 79. Класифікація аніонів
- •І група аніонів
- •§ 86. Кремнієва кислота і реакції силікат-іонів SiO|—
- •II група аніонів
- •§ 91. Йодистоводнева кислота і реакції йодид-іонів і
- •§ 92. Сірководнева кислота і реакції сульфід-іонів s2-
- •Ill група аніонів
- •§ 94. Азотна кислота і реакції нітрат-іонів імог
- •§ 95. Азотиста кислота і реакції нітрит-іонів n02
- •§ 96. Оцтова кислота і реакції ацетат-іонів сн3соо
- •§ 97. Хлорнувата кислота і реакції гіпохлорат-іонів сюг
- •§ 98. Аналіз суміші аніонів і—III аналітичних груп
- •§ 100. Розчинення речовини і виявлення катіонів
- •§ 101. Виявлення аніонів
- •§ 102. Аналіз металів і сплавів
- •§ 103. Предмет і значення кількісного аналізу
- •§ 104. Визначення основних компонентів і визначення домішок
- •§ 105. Класифікація хімічних методів кількісного аналізу
- •І. Гравіметричий аналіз1
- •§ 106. Суть методу
- •§ 107. Вимоги до осадів у гравіметричному аналізі
- •§ 108. Співосадження
- •§ 109. Умови осадження
- •§ 110. Відокремлення осаду від маточного розчину
- •§ 111. Переведення осаду у вагову форму
- •§ 112. Принцип дії аналітичних терезів
- •§ 113. Правила користування аналітичними терезами і зважування на них
- •Розділ 18. Приклади гравіметричних визначень
- •§ 114. Розрахунки у гравіметричному аналізі
- •0,3115 Г становить 100%;
- •0,5025 Г становить 100%; 0,0874 г » х%,
- •§ 115. Визначення заліза у вигляді оксиду
- •§ 116. Визначення сульфатів у вигляді сульфату барію
- •§ 117. Розділення і визначення кальцію і магнію
- •§ 118. Визначення нікелю в сталях
- •II. Титриметричний аналіз Розділ 19. Загальні положення титриметричного аналізу
- •§ 119. Суть методу
- •§ 120. Концентрація розчинів і розрахунки в титриметричному аналізі
- •§ 121. Приготування робочих розчинів
- •§ 122. Методи непрямого титрування
- •§ 123. Точка еквівалентності
- •§ 124. Установлення точки еквівалентності за допомогою індикаторів
- •§ 125. Мірний посуд
- •§ 126. Перевірка мірного посуду
- •§ 127. Титрування кислотами та основами
- •§ 128. Індикатори методу кислотно-основного титрування (методу нейтралізації)
- •§ 129. Вибір індикаторів при титруванні кислотами та основами
- •§ 130. Криві титрування
- •§ 131. Помилки титрування
- •2NaHc03 ї± н20 -f- c02 -f Na2c03.
- •§ 132. Робочі розчини методу кислотно-основного титрування
- •§ 133. Приклади застосування методу кислотно-основного титрування (методу нейтралізації)
- •§ 134. Криві титрування
- •§ 135. Індикатори методів окислення-відновлення
- •§ 136. Еквівалент у реакціях окислення-відновлення
- •Розділ 22. Перманганатометрія
- •§ 137. Загальна характеристика методу. Приготування робочого розчину перманганату калію
- •§ 138. Визначення заліза
- •§ 139. Визначення пероксиду водню
- •§ 140. Визначення нітритів
- •Розділ 23. Йодометрія
- •§ 141. Загальна характеристика методу
- •§ 142. Приготування робочих титрованих розчинів
- •§ 143. Йодометричне визначення міді
- •§ 144. Йодометричне визначення активного хлору в хлорному вапні
- •B/r. WNa,s203l/NaliS!03јCl " 10°
- •§ 145. Йодометричне визначення сірки
- •Розділ 24. Метод осадження § 146. Загальна характеристика методу
- •§ 147. Індикатори
- •§ 148. Помилки титрування в методі осадження
- •§ 149. Робочі розчини і вихідні речовини методу осадження
- •§ 150. Визначення галогенід-іонів
- •Розділ 25. Методи комплексоутворення
- •§ 151. Загальні положення методів комплексоутворення
- •§ 152. Меркуриметричне визначення хлоридів
- •§ 153. Комплексонометричне визначення твердості води
- •III. Спектрофотометричний і колориметричний методи аналізу Розділ 26. Загальні положення
- •§ 154. Суть методів
- •§ 155. Загальні умови колориметричного визначення
- •§ 156. Закон Бугера—Ламберта—Бера
- •§ 157. Методи вимірювання інтенсивності забарвлення
- •§ 159. Визначення міді в грунтах
- •§ 160. Загальні положення
- •§ 161. Наближене визначення рН
- •§ 162. Безбуферні методи визначення рН
- •§ 163. Буферний метод визначення рН
- •IV. Аналіз різних матеріалів Розділ 29. Аналіз продуктів харчування § 164. Визначення кислотності хліба і молока
- •§ 165. Аналіз грунту і води
- •§ 166. Визначення оксидів кальцію і магнію в доломіті
- •Розділ 31. Аналіз добрив
- •§ 167. Визначення фосфору в суперфосфаті
- •§ 168. Визначення калію в калійних добривах
- •§ 169. Визначення азоту в аміачних добривах
- •Додатки
- •Кислоти
- •Густина розчинів їдких калі і натру
II група аніонів
До II групи аніонів належать іони, що утворюють з іонами срібла солі, які погано розчиняються у воді й нітратній кислоті: хлорид-, бромід-, йодид-, сульфід- і роданід-іони. Отже, груповим реактивом на аніони II групи є нітрат срібла в азотнокислому середовищі. Хлорид барію не осаджує аніонів II групи.
Солі аніонів II групи з катіонами І групи безбарвні.
§ 89. Соляна кислота і реакції хлорид-іонів СІ~
Соляна (хлористоводнева) кислота являє собою розчин хлороводню у воді. Це сильна кислота, тобто у водних розчинах вона практично повністю дисоціює на іони. Концентрована соляна кислота з густиною 1,19 • 103 кг/м3, що є в продажу, містить близько 37% хлороводню.
Усі хлориди добре розчиняються у воді, за винятком хлоридів срібла, ртуті (І) і свинцю.
Реакції хлорид-іонів. Нітрат срібла осаджує білий сирнистий осад хлориду срібла, який не розчиняється в розведених кислотах, але добре розчиня-
304
еться в розчині гідроксиду амонію, утворюючи малодисоційовану комплекс ну сполуку — аміакат срібла, що добре розчиняється:
СГ + Ag+ *t AgCl; |AgCl] + 2NH4OH & [Ag (NH,)J CI + 2H20.
Хлорид срібла розчиняється також у розчинах тіосульфату й ціаніду, з якими утворює ще стійкіші комплекси:
2AgCl + 2S20^~ * [Ag2 (S203)2]2- + 2СГ;
AgCl + 2CN- ^ [Ag (CN)2]~ + СГ.
Концентрована сірчана кислота розкладає, особливо при нагріванні, усі хлориди; при цьому виділяється хлороводень:
NaCl + H2S04 *t NaHS04 + HClj.
(конц.)
Хлороводень можна розпізнати за специфічним запахом; колір змоченого водою синього лакмусового папірця змінюється в парі хлороводню на червоний. Якщо в пару хлороводню внести скляну паличку, змочену гідроксидом амонію, то в присутності хлороводню з'явиться білий дим хлориду амонію:
HC1 + NH3 ^ NH4C1.
Дихромат калію в присутності концентрованої сірчаної кислоти виділяє пару (бурого кольору) хлориду хромілу СгОаС12, яка конденсується, утворюючи буру рідину, схожу на бром:
К2Сг207 + 4NaCl + 6H2S04 <± 2Cr02Cr2 + 2KHS04 + 4NaHS04 + 3H20.
Хлорид хромілу взаємодіє з лугами, утворюючи хромат (цим він відрізняється від брому):
Сг02С12 + 40Н- -> СЮ2- + 2С1~ + 2Н20.
Сильні окислювачі з високим окислювальним потенціалом окислюють хлорид-іони у вільний хлор. Порівняно легко окислюються хлориди в хлор перманганатом калію:
ЮСІ- + 2МпО~ + 16Н+ -> 2Мп2+ + 5СІ2 + 8Н20;
Е ,, =+1,55 В.
MnO~/Мі/"1"
Хлор розпізнають за різким своєрідним запахом.
Нітрати ртуті (І) і свинцю осаджують білі хлориди ртуті (І) (каломель) і свинцю:
2Cr + Hgf+ * Hg2Cl2;
2СГ + Pb2+ t± РЬС12.
Як зазначалось раніше (розд. 10, § 59), розчинність хлориду свинцю різко збільшується з підвищенням температури.
305
§ 90. Бромистоводнева кислота і реакції бромід-іонів Вг~
Бромистоводнева кислота являє собою розчин бромоводню у воді. У водних розчинах бромистоводнева кислота практично повністю дисоціює, отже, вона належить до сильних кислот. Солі бромистоводневої кислоти називають бромідами.
Розчиняються броміди аналогічно хлоридам.
Реакції бромід-іонів. Нітрат срібла осаджує жовтуватий сирнистий осад броміду срібла, який не розчиняється в азотній кислоті, але розчиняється в гідроксиді амонію, тіосульфаті натрію та ціаніді калію:
Br~ + Ag+ г± AgBr;
AgBr -{- 2NH4OH j* [Ag (NH3)2]+ + Вг~ + 2H20;
2AgBr+2S20|- й [Ag2(S203)2]2-+2Br-;
AgBr -f- 2CN- *t [Ag (CN)a]- + Br~.
Концентрована сірчана кислота при нагріванні виділяє бромоводень і вільний бром:
NaBr-f-H2S04 <± NaHS04-f НВг; 2NaBr + 3H2S04 <=> 2NaHS04 -f Br2 -f- S02 + 2H20.
Хлорна вода виділяє з кислих розчинів бромідів вільний бром, який добре екстрагується органічними розчинниками (чотирихлорйстим вуглецем, хлороформом, сірковуглецем тощо), забарвлюючи їх у бурий колір. При дії надлишку хлорної води розчин жовтіє у зв'язку з утворенням хлориду брому ВгСІ (цим бром відрізняється від йоду).
Флуоресцеїн — жовтий барвник, який при дії на нього бромом переходить у тетрабромфлуоресцеїн (еозин) червоного кольору:
СОО"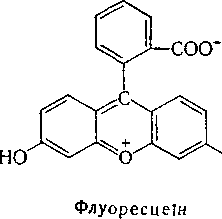
![]()
Bv^ + 4Вг2 — 4НВг + [ |
fl |
^y*r |
ОН HC)V |
Vі |
y™ |
Br |
Еозин |
Br |
Бром виділяють з бромідів окислювачами (наприклад, РЬО.,) в присутності оцтової кислоти. Досліджуваний розчин наливають у пробірку, добавляють твердий РЬ02 І підкислюють суміш оцтовою кислотою. Потім нагрівають суміш і в пару вносять фільтрувальний папір, змочений насиченим розчином флуоресцеїну в 50%-му розчині спирту.
306
Фуксин
H*N
NH2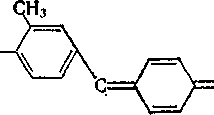 H2N-^/
H2N-^/
СҐ
утворює з дисульфітом безбарвну сполуку. При взаємодії з незначною кількістю брому утворюється енній бромзаміщений барвник. Хлор і йод не дають цієї реакції.
У невелику пробірку вносять краплину досліджуваного розчину і 4—5 краплин 25%-го розчину хромового ангідриду. У другу пробірку вносять кілька краплин 0,1%-го водного розчину фуксину, знебарвлюють фуксин невеликою кількістю твердого дисульфіту натрію в присутності 1—2 краплин концентрованої НС1. Добутим розчином змочують клаптик фільтрувального паперу і прикріплюють його до сухої зовнішньої поверхні годинникового скельця. Годинниковим скельцем накривають першу пробірку, яку нагрівають на водяній бані. Через якийсь час фуксиновий папірець забарвлюється в синьо-фіолетовий колір.
6ВГ 10Br~ -f 2MnOj"
14Н^ 16РГ
Дихромат і перманганат окислюють бромід до вільного брому:
• + Сг20?_ + 14H+ -* 2Сг3+ + ЗВг2 + 7Н20; 2Мп2+ + 5Вг2 + 8Н20.
