
- •Головне видавництво видавничого об'єднання «вища школа»
- •Передмова
- •Предмет аналітичної хімії
- •Сучасні завдання аналітичної хімії
- •Методи аналітичної хімії
- •§ 1. Закон діючих мас
- •§ 2. Теорія електролітичної дисоціації
- •§ 3. Концентрація водневих іонів води. Поняття про рН
- •§ 4. Концентрація водневих іонів розчинів кислот і основ
- •§ 5. Гідроліз. Концентрація водневих іонів розчинів солей
- •§ 6. Буферні розчини
- •§ 7. Графічний метод обчислення рН розчину
- •§ 9. Добуток розчинності
- •§ 10. Вплив однойменних іонів на розчинність осадів
- •§ 11. Розчинність осадів у кислотах
- •§ 12. Розчинність осадів при утворенні комплексів
- •§ 13. Осади кристалічні і неявнокристалічні (аморфні)
- •§ 14. Колоїдні розчини
- •Розділ 3. Комплексні сполуки
- •§ 15. Загальні положення
- •§ 16. Комплексні сполуки з неорганічними лігандами
- •§ 17. Комплексні сполуки з органічними лігандами
- •§ 18. Застосування комплексних сполук в аналізі
- •§ 19. Органічні реактиви
- •Розділ 4. Реакції окислення-відновлення
- •§ 20. Загальна характеристика
- •§ 21. Окислювально-відновний потенціал
- •§ 22. Властивості окислювально-відновного потенціалу. Рівняння Нернста
- •§ 23. Окислювальний потенціал і напрям реакцій окислення-відновлення
- •§ 24. Індуктивні реакції окислення-відновлення
- •§ 25. Хроматографічний аналіз. Іонообмінники
- •§ 26. Екстракція. Інші методи розділення
- •§ 27. Аналіз у розчині та сухий метод аналізу
- •§ 28. Макро-, мікро- і напівмікроаналіз. Краплинний, безстружковий і мікрокристалоскопічний методи аналізу
- •§ 29. Чутливість і специфічність реакцій
- •§ Зо. Хімічні реактиви
- •§ 31. Концентрація розчинів
- •§ 32. Техніка роботи в лабораторії якісного аналізу
- •§ 33. Дробний і систематичний методи якісного аналізу
- •§ 34. Класифікація катіонів на аналітичні групи
- •Розділ 7. І аналітична група катіонів
- •§ 35. Загальна характеристика групи
- •§ 36. Натрій
- •§ 38. Амоній
- •§ 39. Магній
- •§ 40. Аналіз суміші катіонів і аналітичної групи
- •Розділ 8. II аналітична група катіонів § 41. Загальна характеристика групи
- •§ 43. Стронцій
- •§ 44. Кальцій
- •§ 45. Аналіз суміші катіонів і і II аналітичних груп
- •Розділ 9. Ill аналітична група катіонів § 46. Загальна характеристика групи
- •§ 47. Алюміній
- •§ 48. Хром
- •§ 50. Марганець
- •§ 51. Цинк
- •§ 52. Кобальт
- •§ 53. Нікель
- •§ 54. Аналіз суміші катіонів III аналітичної групи
- •§ 56. Аналіз суміші катіонів III, II і і аналітичних груп, що містить фосфат-іони
- •Розділ 10. IV аналітична група катіонів
- •§ 57. Загальна характеристика групи
- •Підгрупа срібла
- •§ 59. Свинець
- •§ 60. Ртуть (і)
- •§ 61. Аналіз суміші катіонів підгрупи срібла
- •IV аналітичної групи
- •Підгрупа міді
- •§ 62. Ртуть (II)
- •§ 64. Кадмій
- •§ 65. Вісмут
- •§ 66. Аналіз суміші катіонів IV—і аналітичних груп
- •Розділ 11. V аналітична група катіонів § 67. Загальна характеристика групи
- •§ 69. Сурма
- •§ 70. Олово
- •§ 71. Аналіз суміші катіонів IV і V аналітичних груп
- •Розділ 12. Аналіз рідкісних елементів § 72. Загальна характеристика
- •§ 73. Титан
- •§ 74. Ванадій
- •§ 75. Молібден
- •§ 76. Вольфрам
- •§ 78. Безсірководневі методи якісного аналізу катіонів
- •Розділ 13. Аналіз аніонів § 79. Класифікація аніонів
- •І група аніонів
- •§ 86. Кремнієва кислота і реакції силікат-іонів SiO|—
- •II група аніонів
- •§ 91. Йодистоводнева кислота і реакції йодид-іонів і
- •§ 92. Сірководнева кислота і реакції сульфід-іонів s2-
- •Ill група аніонів
- •§ 94. Азотна кислота і реакції нітрат-іонів імог
- •§ 95. Азотиста кислота і реакції нітрит-іонів n02
- •§ 96. Оцтова кислота і реакції ацетат-іонів сн3соо
- •§ 97. Хлорнувата кислота і реакції гіпохлорат-іонів сюг
- •§ 98. Аналіз суміші аніонів і—III аналітичних груп
- •§ 100. Розчинення речовини і виявлення катіонів
- •§ 101. Виявлення аніонів
- •§ 102. Аналіз металів і сплавів
- •§ 103. Предмет і значення кількісного аналізу
- •§ 104. Визначення основних компонентів і визначення домішок
- •§ 105. Класифікація хімічних методів кількісного аналізу
- •І. Гравіметричий аналіз1
- •§ 106. Суть методу
- •§ 107. Вимоги до осадів у гравіметричному аналізі
- •§ 108. Співосадження
- •§ 109. Умови осадження
- •§ 110. Відокремлення осаду від маточного розчину
- •§ 111. Переведення осаду у вагову форму
- •§ 112. Принцип дії аналітичних терезів
- •§ 113. Правила користування аналітичними терезами і зважування на них
- •Розділ 18. Приклади гравіметричних визначень
- •§ 114. Розрахунки у гравіметричному аналізі
- •0,3115 Г становить 100%;
- •0,5025 Г становить 100%; 0,0874 г » х%,
- •§ 115. Визначення заліза у вигляді оксиду
- •§ 116. Визначення сульфатів у вигляді сульфату барію
- •§ 117. Розділення і визначення кальцію і магнію
- •§ 118. Визначення нікелю в сталях
- •II. Титриметричний аналіз Розділ 19. Загальні положення титриметричного аналізу
- •§ 119. Суть методу
- •§ 120. Концентрація розчинів і розрахунки в титриметричному аналізі
- •§ 121. Приготування робочих розчинів
- •§ 122. Методи непрямого титрування
- •§ 123. Точка еквівалентності
- •§ 124. Установлення точки еквівалентності за допомогою індикаторів
- •§ 125. Мірний посуд
- •§ 126. Перевірка мірного посуду
- •§ 127. Титрування кислотами та основами
- •§ 128. Індикатори методу кислотно-основного титрування (методу нейтралізації)
- •§ 129. Вибір індикаторів при титруванні кислотами та основами
- •§ 130. Криві титрування
- •§ 131. Помилки титрування
- •2NaHc03 ї± н20 -f- c02 -f Na2c03.
- •§ 132. Робочі розчини методу кислотно-основного титрування
- •§ 133. Приклади застосування методу кислотно-основного титрування (методу нейтралізації)
- •§ 134. Криві титрування
- •§ 135. Індикатори методів окислення-відновлення
- •§ 136. Еквівалент у реакціях окислення-відновлення
- •Розділ 22. Перманганатометрія
- •§ 137. Загальна характеристика методу. Приготування робочого розчину перманганату калію
- •§ 138. Визначення заліза
- •§ 139. Визначення пероксиду водню
- •§ 140. Визначення нітритів
- •Розділ 23. Йодометрія
- •§ 141. Загальна характеристика методу
- •§ 142. Приготування робочих титрованих розчинів
- •§ 143. Йодометричне визначення міді
- •§ 144. Йодометричне визначення активного хлору в хлорному вапні
- •B/r. WNa,s203l/NaliS!03јCl " 10°
- •§ 145. Йодометричне визначення сірки
- •Розділ 24. Метод осадження § 146. Загальна характеристика методу
- •§ 147. Індикатори
- •§ 148. Помилки титрування в методі осадження
- •§ 149. Робочі розчини і вихідні речовини методу осадження
- •§ 150. Визначення галогенід-іонів
- •Розділ 25. Методи комплексоутворення
- •§ 151. Загальні положення методів комплексоутворення
- •§ 152. Меркуриметричне визначення хлоридів
- •§ 153. Комплексонометричне визначення твердості води
- •III. Спектрофотометричний і колориметричний методи аналізу Розділ 26. Загальні положення
- •§ 154. Суть методів
- •§ 155. Загальні умови колориметричного визначення
- •§ 156. Закон Бугера—Ламберта—Бера
- •§ 157. Методи вимірювання інтенсивності забарвлення
- •§ 159. Визначення міді в грунтах
- •§ 160. Загальні положення
- •§ 161. Наближене визначення рН
- •§ 162. Безбуферні методи визначення рН
- •§ 163. Буферний метод визначення рН
- •IV. Аналіз різних матеріалів Розділ 29. Аналіз продуктів харчування § 164. Визначення кислотності хліба і молока
- •§ 165. Аналіз грунту і води
- •§ 166. Визначення оксидів кальцію і магнію в доломіті
- •Розділ 31. Аналіз добрив
- •§ 167. Визначення фосфору в суперфосфаті
- •§ 168. Визначення калію в калійних добривах
- •§ 169. Визначення азоту в аміачних добривах
- •Додатки
- •Кислоти
- •Густина розчинів їдких калі і натру
§ 59. Свинець
Природні сполуки. Найважливіші свинцеві мінерали: галеніт PbS, церусит РЬС03, англезит PbS04, піроморфіт РЬ5С1 (Р04)3 і кроко'іт PbCr04.
Властивості. Свинець — м'який метал блакитно-сірого кольору. Густина його 11,3 • 103 кг/м3, температура плавлення 327,4° С. Свинець ковкий і тягучий, при розрізі має блискучу поверхню, яка на повітрі швидко темніє внаслідок утворення тонкої плівки оксиду свинцю. На свинець діють майже всі кислоти. Він легко розчиняється в розведеній азотній кислоті. Проте концентрована азотна кислота слабко діє на свинець, бо він швидко покривається оксидною плівкою, яка не розчиняється в концентрованій азотній кислоті. Слабко діють на свинець розведена НСІ, H2S04 та інші кислоти, які утворюють з ним нерозчинні солі. Це пояснюється утворенням захисного шару відповідної нерозчинної солі. У гарячих НСІ і H2S04 свинець розчиняється, бо захисні плівки в цих концентрованих кислотах розчинні. Так, при дії концентрованою НСІ утворюються комплексні іони [PbCl4J2+. Реакція відбувається за таким рівнянням:
РЬС12 + 2С1- = [РЬС14]2-
або
РЬС12 -f 2HC1 = Н2 [РЬС14].
При дії концентрованою H,S04 утворюється розчинний гідросульфат (дисульфат) свинцю:
Pb + 2H2S04 = PbS04 + 2H20 + SOa; PbS04 -f H2S04 = Pb (HS04)2,
або
Pb + 3H2S04 = Pb (HS04)2 -f S02 -f H20.
Структурна формула пірогалолу:
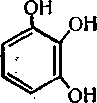
217
Свинець у сполуках буває дво- і чотиривалентним. Іони свинцю безбарвні.
Відомі такі оксиди свинцю: РЬО, РЬ02, РЬ203 і РЬ304 — сурик, або червоний оксид свинцю.
Оксид свинцю (II) РЬО (глет) — порошок жовтого кольору, має амфотерний характер, з лугами утворює плюмбіти. Наприклад, Na2Pb02 — плюм-біт натрію. Проте в РЬО переважають основні властивості. Він легко розчиняється в кислотах, утворюючи відповідні солі.
Оксид свинцю (IV) РЬ02 — коричневого кольору, також має амфотерний характер, але в нього переважають кислотні властивості. РЬ02 — ангідрид метасвинцевої — Н2РЬ03 і ортосвинцевої — Н4РЬ04 кислот:
Н2РЬ03 — Н20 = РЬ02; Н4РЬ04 — 2Н20 = РЬ02.
При дії на нього лугами утворюються відповідні солі, які називаються плюмбатами. Наприклад, Na2Pb03 — метаплюмбат натрію, Са2РЬ04 — ортоплюмбат кальцію. При нагріванні плюмбати розкладаються, виділяючи кисень.
РЬ203 і РЬ304 являють собою плюмбати свинцю (II). Так, РЬ203 — сполука червонувато-жовтого кольору. її можна розглядати як свинцеву сіль метасвинцевої кислоти, тобто метаплюмбат свинцю РЬРЬ03. РЬ304 — порошок яскраво-оранжевого кольору (сурик) є свинцевою сіллю ортосвинцевої кислоти, тобто ортоплюмбат свинцю РЬ2РЬ04.
Про те, що РЬ304 є свинцевою сіллю ортосвинцевої кислоти, свідчить реакція його з азотною кислотою. Так, при нагріванні РЬ304 з гарячою HN03 дві частини свинцю переходять у розчин, в результаті чого утворюється Pb (N03)2, а одна залишається в осаді у вигляді РЬ02:
РЬ2РЬ04 + 4HN03 = 2Pb (N03)2 + Н4РЬ04; Н4РЬ04 = PbCX + 2H20.
Нітрат, нітрит, хлорат і ацетат свинцю легко розчиняються у воді. Важко розчиняються галогеніди (хлорид, бромід і йодид). Решта солей свинцю у воді практично не розчиняється.
Реакція іонів свинцю. Сірководень H2S осаджує іони у вигляді сульфіду свинцю чорного кольору з нейтрального, лужного або слабкокислого розчинів:
Pb2+ + H2S = PbS + 2H+,
або
Pb (CH3COO)2 + H2S = PbS + 2СН3СООН.
Із солянокислих розчинів сірководень спочатку осаджує червоний осад сульфохлориду свинцю Pb.,Cl,S, який при розведенні розчину і дальшому пропусканні сірководню поступово переходить у чорний осад PbS.
Сульфід свинцю не розчиняється в розведених кислотах (НС1, H.:S04, СН3СООН), їдких лугах і сульфідах лужних металів. Він легко розчиняеть-
218
ся в гарячій розведеній азотній кислоті, при розчиненні утворюється нітрат свинцю і виділяється сірка:
3PbS + 8HNO3 = ЗРЬ (N03)2 -f 2NO + 3S + 4Н20.
Гаряча концентрована азотна кислота окислює сульфід свинцю у сульфат, а сама відновлюється прн цьому до N02:
PbS + 8HNO3 = PbS04 + 8Ш2 + 4Н20.
Соляна кислота НС1 і розчинні хлориди утворюють з іонами РЬ2+ білий осад хлориду свинцю РЬС12, який погано розчиняється в холодній воді, але значно краще розчиняється в гарячій:
РЬ2+ + 2НС1 = РЬС12 4- 2Н+.
У літрі холодної води розчиняється 7,54 г, а при 100° С — 35,9 г РЬС12. При охолодженні гарячого розчину РЬС12 виділяється у формі голчастих кристалів. Хлорид свинцю гірше розчиняється в розведеній НС1 або в розчині NaCl, ніж у воді (дія" однойменних іонів). При розчиненні хлориду свинцю в концентрованих розчинах НС1 або NaCl утворюються комплексні
іони [РЬС14]2_:
РЬС12 4- 2С1~ = [РЬС14]2-.
Якщо такий розчин розвести водою, знову осаджується РЬС12. Присутність великої кількості HN03 заважає осадженню свинцю соляною кислотою.
Незважаючи на те, що у воді, яка містить НС1, РЬСЦ розчиняється гірше, ніж у чистій воді, все-таки частина свинцю залишається неосадженою. Тому при відокремленні підгрупи срібла за допомогою соляної кислоти свинець частково залишиться в розчині разом з катіонами підгрупи міді.
їдкі луги NaOH і КОН в еквівалентній кількості осаджують іони РЬ2+ у вигляді гідроксиду свинцю (II) РЬ (ОН)2 білого кольору, який розчиняється в кислотах, а також у надлишку лугу, утворюючи плюмбіт:
Pb (N03)2 4- 2NaOH = Pb (OH)2 4- 2Na\03, Pb (OH)2 4- 2NaOH = Na2Pb02 4- 2H20.
Аміак NH4OH утворює з іонами Pb2+ білий осад Pb (OH)2, який не розчиняється в надлишку аміаку. При обробці РЬС12 аміаком він переходить в основний хлорид РЬОНСІ. Надлишок аміаку перетворює РЬС12 у РЬ (ОН)2.
Карбонати лужних металів Na2C03 і К2С03 осаджують іони РЬ2+ у вигляді основної солі:
2РЬ2+ 4- 2СО^- 4- Н20 = РЬ2 (ОН)2 С03 4- С02, або
2Pb (N03)2 -f 2Na2C03 + 2H20 = Pb2 (ОН)2 С03 + 4NaN03 4- НаС03.
Гідрокарбонати осаджують іони РЬ2+ у вигляді нормального карбонату свинцю:
РЬ2+ 4- 2HC0J- = PbCOj 4- Н20 4- С02,
219
або
Pb (N03)2 + 2NaHCOs = PbC03 + 2NaN03 + C02 + H20.
Гідрофосфат натрію Na2HP04 з іонами Pb2+ утворює білий осад фосфату свинцю РЬ3 (Р04)2, який розчиняється в азотній кислоті і лугах:
3Pb2+ + 4НР02- = РЬ3 (Р04)а + 2Н2РО~,
або
ЗРЬ (N03)2 + 4Na2HP04 = Pb3 (ГО4)2 + 2NaH2P04 + 6NaN03.
Фосфат свинцю в лугах розчиняється внаслідок утворення плюмбіту. Реакція відбувається за таким рівнянням:
РЬ3 (Р04)2 + 12NaOH = 3Na2Pb02 + 2Na3P04 + 6Н20.
Тіосульфат натрію Na2S203 осаджує іони РЬ2+ у вигляді білого осаду тіосульфату свинцю PbS20"3( який розчиняється в надлишку реактиву, утворюючи комплексні іони ІРЬ (S203)3]4~:
Pb2+ + S2o|- = PbS203;
PbS203 + 2S20^~ = [Pb (S203)314-,
або
PbS2Os + 2Na2S2Os = Na4 [Pb (S2Os)3].
При нагріванні з кислотою комплекс [Pb (520з)3]4— розкладається, в результаті чого виділяється сульфід свинцю:
[Pb (S203)3]4- + 2Н+ = PbS + 2S + 2SOa + SO2," + Hfi,
або
Na4 [Pb (S203)31 + 2HN03 = PbS + 2S + 2NaN03 + Na2S04 + 2S02 + H20.
Розведена сірчана кислота і розчинні сульфати осаджують іони РЬ2+ у вигляді білого осаду PbS04, який практично не розчиняється в розведеній сірчаній кислоті:
рь2+ + so2- = Pbso4.
Сульфат свинцю розчиняється при нагріванні в лугах внаслідок утворення плюмбітів:
PbS04 + 4NaOH = Na2Pb02 + Na2S04 + 2Н20. Осад PbS04 частково розчиняється в азотній кислоті. Це відбувається внаслідок утворення HSOT":
PbS04 + H+ = Pb2+ + HSO-; 2PbS04 -!- 2HNOs = Pb (HS04)2 + Pb (N03)2.
Сульфат свинцю легко розчиняється в гарячих концентрованих розчинах ацетату і тартрату амонію. Наприклад:
PbS04 + 2CH3COONH4 = Pb (CH3COO)2 + (NHJa S04.
220
PbS04 в ацетаті амонію розчиняється внаслідок утворення РЬ (СН3СОО)2, який у присутності надлишку ацетат-іонів дуже мало іонізований. Якщо до розчину РЬ (СН3СОО)2 добавити розведену H2S04, то свинець знову осаджується у вигляді PbS04.
Хромат калію К2Сг04 осаджує іони РЬ2+ у вигляді хромату свинцю жовтого кольору:
Pb (N03)2 + К2Сг04 = РЬСЮ4 + 2KN03.
Осад РЬСг04 добре розчиняється в Їдких лугах, погано розчиняється у розведеній азотній кислоті й не розчиняється у воді.
З розчинів PbS04 в ацетаті амонію хромат калію практично повністю осаджує свинець у вигляді хромату свинцю РЬСг04:
РЬ (СН3СОО)2 + К2Сг04 = РЬСЮ4 + 2КСН3СОО.
Виявленню іонів РЬ2+ реакцією утворення хромату свинцю заважають іони Ва2+, Sr2+, Ag"^, Ві3+, Hg2+. Це пояснюється тим, що вони утворюють з хромат-іонами забарвлені осади. Тому, щоб виявити іони Pb + в розчині, що містить перелічені катіони, спочатку сірчаною кислотою відокремлюють сульфати лужноземельних металів і свинцю. Осад, що утворився, обробляють ацетатом амонію, при цьому сульфати лужноземельних металів залишаються нерозчиненими, а свинець у вигляді ацетатного комплексу переходить у розчин. Якщо до розчину добавити кілька краплин К2Сг04, то в присутності свинцю випадає жовтий осад РЬСг04.
Йодид калію КІ з іонами РЬ2+ утворює жовтий осад йодиду свинцю РЬІ2:
РЬ2+ + 21- = РЬІ2.
Осад РЬІ2 розчиняється в надлишку йодиду калію; при цьому утворюється комплексна сіль К2 [PblJ:
РЬІ2 + 2КІ = К2[РЬІ4].
Йодид свинцю розчиняється в гарячій воді. Після охолодження РЬІ2 знову випадає в осад, тепер уже у вигляді блискучих золотистих кристаликів. Ця реакція характерна для іонів РЬ2+ і нею користуються для виявлення свинцю.
Виконання р є а к ц і ї. До 3—5 краплин досліджуваного розчину добавляють 2—3 краплини розчину КІ. Випадає жовтий осад. Суміш кип'ятять. Якщо осад розчинився не повністю, розчин центрифугують і прозору рідину зливають у другу пробірку. Після охолодженйя в присутності свинцю випадає осад у вигляді блискучих золотистих кристаликів.
Краплинна реакція з бензидином. Ця реакція полягає в тому, що бензидин окислюється оксидом свинцю (IV), в результаті чого утворюється продукт синього кольору («бензидинова синь»).
Виконання реакції. На смужку фільтрувального паперу наносять краплину досліджуваного розчину і послідовно добавляють краплину З н. розчину NaOH, краплину 3%-го розчину Н202 і краплину аміаку (1 : 1).
221
Папір висушують. При цьому гідроксид свинцю (II), що утворився, окислюється пероксидом водню в оксид свинцю (IV) (бурого кольору):
РЬ (ОН)2 + Н202 = РЬ02 + 2Н20.
Пляму на папері змочують краплиною розчину ацетату бензидину. У присутності свинцю пляма забарвлюється в синій колір. Цій реакції заважають окислювачі, катіони заліза, хрому, марганцю, міді й вісмуту.
Дитизон з іонами РЬ2+ в нейтральних і слабколужних розчинах утворює внутрішньокомплексну сполуку червоного кольору, яка не розчиняється у воді, але розчиняється в хлороформі та інших органічних розчинниках.
Виконання реакції. У пробірку вміщують 1 мл нейтрального або слабколужного досліджуваного розчину і добавляють кілька краплин свіжоприготовленого реактиву (0,05%-го розчину дитизону в хлороформі або чотирихлористому вуглеці). Суміш збовтують протягом ЗО с. У присутності свинцю зелене забарвлення реактиву переходить у червоне (забарвлення дитизонату свинцю). Цій реакції заважають важкі метали.
Мікрокристалоскопічна реакція. На предметне скло наносять краплину досліджуваного розчину, краплину 1%-го ацетату міді і випарюють досуха. Сухий залишок змочують краплиною концентрованого розчину KN02 і CH3COONH4 в 50%-ній оцтовій кислоті. У присутності свинцю випадають чорні кубічної форми кристали K2Pb [Cu (N02)6] (рис. 20, § 37).
