
- •Головне видавництво видавничого об'єднання «вища школа»
- •Передмова
- •Предмет аналітичної хімії
- •Сучасні завдання аналітичної хімії
- •Методи аналітичної хімії
- •§ 1. Закон діючих мас
- •§ 2. Теорія електролітичної дисоціації
- •§ 3. Концентрація водневих іонів води. Поняття про рН
- •§ 4. Концентрація водневих іонів розчинів кислот і основ
- •§ 5. Гідроліз. Концентрація водневих іонів розчинів солей
- •§ 6. Буферні розчини
- •§ 7. Графічний метод обчислення рН розчину
- •§ 9. Добуток розчинності
- •§ 10. Вплив однойменних іонів на розчинність осадів
- •§ 11. Розчинність осадів у кислотах
- •§ 12. Розчинність осадів при утворенні комплексів
- •§ 13. Осади кристалічні і неявнокристалічні (аморфні)
- •§ 14. Колоїдні розчини
- •Розділ 3. Комплексні сполуки
- •§ 15. Загальні положення
- •§ 16. Комплексні сполуки з неорганічними лігандами
- •§ 17. Комплексні сполуки з органічними лігандами
- •§ 18. Застосування комплексних сполук в аналізі
- •§ 19. Органічні реактиви
- •Розділ 4. Реакції окислення-відновлення
- •§ 20. Загальна характеристика
- •§ 21. Окислювально-відновний потенціал
- •§ 22. Властивості окислювально-відновного потенціалу. Рівняння Нернста
- •§ 23. Окислювальний потенціал і напрям реакцій окислення-відновлення
- •§ 24. Індуктивні реакції окислення-відновлення
- •§ 25. Хроматографічний аналіз. Іонообмінники
- •§ 26. Екстракція. Інші методи розділення
- •§ 27. Аналіз у розчині та сухий метод аналізу
- •§ 28. Макро-, мікро- і напівмікроаналіз. Краплинний, безстружковий і мікрокристалоскопічний методи аналізу
- •§ 29. Чутливість і специфічність реакцій
- •§ Зо. Хімічні реактиви
- •§ 31. Концентрація розчинів
- •§ 32. Техніка роботи в лабораторії якісного аналізу
- •§ 33. Дробний і систематичний методи якісного аналізу
- •§ 34. Класифікація катіонів на аналітичні групи
- •Розділ 7. І аналітична група катіонів
- •§ 35. Загальна характеристика групи
- •§ 36. Натрій
- •§ 38. Амоній
- •§ 39. Магній
- •§ 40. Аналіз суміші катіонів і аналітичної групи
- •Розділ 8. II аналітична група катіонів § 41. Загальна характеристика групи
- •§ 43. Стронцій
- •§ 44. Кальцій
- •§ 45. Аналіз суміші катіонів і і II аналітичних груп
- •Розділ 9. Ill аналітична група катіонів § 46. Загальна характеристика групи
- •§ 47. Алюміній
- •§ 48. Хром
- •§ 50. Марганець
- •§ 51. Цинк
- •§ 52. Кобальт
- •§ 53. Нікель
- •§ 54. Аналіз суміші катіонів III аналітичної групи
- •§ 56. Аналіз суміші катіонів III, II і і аналітичних груп, що містить фосфат-іони
- •Розділ 10. IV аналітична група катіонів
- •§ 57. Загальна характеристика групи
- •Підгрупа срібла
- •§ 59. Свинець
- •§ 60. Ртуть (і)
- •§ 61. Аналіз суміші катіонів підгрупи срібла
- •IV аналітичної групи
- •Підгрупа міді
- •§ 62. Ртуть (II)
- •§ 64. Кадмій
- •§ 65. Вісмут
- •§ 66. Аналіз суміші катіонів IV—і аналітичних груп
- •Розділ 11. V аналітична група катіонів § 67. Загальна характеристика групи
- •§ 69. Сурма
- •§ 70. Олово
- •§ 71. Аналіз суміші катіонів IV і V аналітичних груп
- •Розділ 12. Аналіз рідкісних елементів § 72. Загальна характеристика
- •§ 73. Титан
- •§ 74. Ванадій
- •§ 75. Молібден
- •§ 76. Вольфрам
- •§ 78. Безсірководневі методи якісного аналізу катіонів
- •Розділ 13. Аналіз аніонів § 79. Класифікація аніонів
- •І група аніонів
- •§ 86. Кремнієва кислота і реакції силікат-іонів SiO|—
- •II група аніонів
- •§ 91. Йодистоводнева кислота і реакції йодид-іонів і
- •§ 92. Сірководнева кислота і реакції сульфід-іонів s2-
- •Ill група аніонів
- •§ 94. Азотна кислота і реакції нітрат-іонів імог
- •§ 95. Азотиста кислота і реакції нітрит-іонів n02
- •§ 96. Оцтова кислота і реакції ацетат-іонів сн3соо
- •§ 97. Хлорнувата кислота і реакції гіпохлорат-іонів сюг
- •§ 98. Аналіз суміші аніонів і—III аналітичних груп
- •§ 100. Розчинення речовини і виявлення катіонів
- •§ 101. Виявлення аніонів
- •§ 102. Аналіз металів і сплавів
- •§ 103. Предмет і значення кількісного аналізу
- •§ 104. Визначення основних компонентів і визначення домішок
- •§ 105. Класифікація хімічних методів кількісного аналізу
- •І. Гравіметричий аналіз1
- •§ 106. Суть методу
- •§ 107. Вимоги до осадів у гравіметричному аналізі
- •§ 108. Співосадження
- •§ 109. Умови осадження
- •§ 110. Відокремлення осаду від маточного розчину
- •§ 111. Переведення осаду у вагову форму
- •§ 112. Принцип дії аналітичних терезів
- •§ 113. Правила користування аналітичними терезами і зважування на них
- •Розділ 18. Приклади гравіметричних визначень
- •§ 114. Розрахунки у гравіметричному аналізі
- •0,3115 Г становить 100%;
- •0,5025 Г становить 100%; 0,0874 г » х%,
- •§ 115. Визначення заліза у вигляді оксиду
- •§ 116. Визначення сульфатів у вигляді сульфату барію
- •§ 117. Розділення і визначення кальцію і магнію
- •§ 118. Визначення нікелю в сталях
- •II. Титриметричний аналіз Розділ 19. Загальні положення титриметричного аналізу
- •§ 119. Суть методу
- •§ 120. Концентрація розчинів і розрахунки в титриметричному аналізі
- •§ 121. Приготування робочих розчинів
- •§ 122. Методи непрямого титрування
- •§ 123. Точка еквівалентності
- •§ 124. Установлення точки еквівалентності за допомогою індикаторів
- •§ 125. Мірний посуд
- •§ 126. Перевірка мірного посуду
- •§ 127. Титрування кислотами та основами
- •§ 128. Індикатори методу кислотно-основного титрування (методу нейтралізації)
- •§ 129. Вибір індикаторів при титруванні кислотами та основами
- •§ 130. Криві титрування
- •§ 131. Помилки титрування
- •2NaHc03 ї± н20 -f- c02 -f Na2c03.
- •§ 132. Робочі розчини методу кислотно-основного титрування
- •§ 133. Приклади застосування методу кислотно-основного титрування (методу нейтралізації)
- •§ 134. Криві титрування
- •§ 135. Індикатори методів окислення-відновлення
- •§ 136. Еквівалент у реакціях окислення-відновлення
- •Розділ 22. Перманганатометрія
- •§ 137. Загальна характеристика методу. Приготування робочого розчину перманганату калію
- •§ 138. Визначення заліза
- •§ 139. Визначення пероксиду водню
- •§ 140. Визначення нітритів
- •Розділ 23. Йодометрія
- •§ 141. Загальна характеристика методу
- •§ 142. Приготування робочих титрованих розчинів
- •§ 143. Йодометричне визначення міді
- •§ 144. Йодометричне визначення активного хлору в хлорному вапні
- •B/r. WNa,s203l/NaliS!03јCl " 10°
- •§ 145. Йодометричне визначення сірки
- •Розділ 24. Метод осадження § 146. Загальна характеристика методу
- •§ 147. Індикатори
- •§ 148. Помилки титрування в методі осадження
- •§ 149. Робочі розчини і вихідні речовини методу осадження
- •§ 150. Визначення галогенід-іонів
- •Розділ 25. Методи комплексоутворення
- •§ 151. Загальні положення методів комплексоутворення
- •§ 152. Меркуриметричне визначення хлоридів
- •§ 153. Комплексонометричне визначення твердості води
- •III. Спектрофотометричний і колориметричний методи аналізу Розділ 26. Загальні положення
- •§ 154. Суть методів
- •§ 155. Загальні умови колориметричного визначення
- •§ 156. Закон Бугера—Ламберта—Бера
- •§ 157. Методи вимірювання інтенсивності забарвлення
- •§ 159. Визначення міді в грунтах
- •§ 160. Загальні положення
- •§ 161. Наближене визначення рН
- •§ 162. Безбуферні методи визначення рН
- •§ 163. Буферний метод визначення рН
- •IV. Аналіз різних матеріалів Розділ 29. Аналіз продуктів харчування § 164. Визначення кислотності хліба і молока
- •§ 165. Аналіз грунту і води
- •§ 166. Визначення оксидів кальцію і магнію в доломіті
- •Розділ 31. Аналіз добрив
- •§ 167. Визначення фосфору в суперфосфаті
- •§ 168. Визначення калію в калійних добривах
- •§ 169. Визначення азоту в аміачних добривах
- •Додатки
- •Кислоти
- •Густина розчинів їдких калі і натру
§ 32. Техніка роботи в лабораторії якісного аналізу
У лабораторії якісного аналізу для проведення хімічних реакцій використовують спеціальний хімічний посуд і прилади. Це — звичайні пробірки і пробірки для центрифуг, скляні палички, стакани й колби, фарфорові чашки і тиглі, годинникові скельця, лійки для фільтрування, промивалки
![]()
![]()
а
: ; \ \
а- о
Рис. 11. Пробірки: а — для центрифуг; б — звичайні.
Рис. 12. Капілярні піпетки.
тощо. Правила роботи з цим посудом вивчались при виконанні робіт у лабораторії неорганічної хімії. Тому ми розглянемо тут тільки деякі особливості, характерні саме для роботи в лабораторії якісного аналізу, зокрема при проведенні аналізу напівмікрометодом.
В якісному аналізі слід звертати особливу увагу на чистоту лабораторного посуду. Забруднення пробірки або колби певними хімічними речовинами може призвести до помилки при встановленні якісного складу досліджуваної проби. Звичайно хімічний посуд миють водопровідною водою. Щоб позбутися твердих частинок, які пристають до стінок посуду, користуються йоржиком. Можна мити посуд також розведеними кислотами, розчинами лугів, хромовою сумішшю (суміш сірчаної кислоти з розчином дихромату калію). Вимитий посуд прополіскують кілька разів водопровідною водою, споліскують внутрішні стінки дистильованою водою і ззовні насухо витирають рушником.
118
Для проведення аналізу макрометодом усі хімічні реакції проводять у звичайних пробірках. У пробірку наливають 0,5—1 мл досліджуваного розчину, приблизно стільки ж потрібних реактивів і спостерігають ефект реакції — утворення забарвленої сполуки, виділення осаду або газу. Для фільтрування використовують звичайні лійки.
При проведенні аналізу напівмікрометодом для цієї мети беруть маленькі пробірки для центрифуги або звичайні пробірки висотою 5—6 см (рис. 11). Для виявлення окремих іонів вносять у пробірку 2—3 краплини досліджуваного розчину і такі ж самі кількості розчинів реактивів. Розчини вносять спеціальними капілярними піпетками місткістю 1—2 мл з гумовим ковпач-
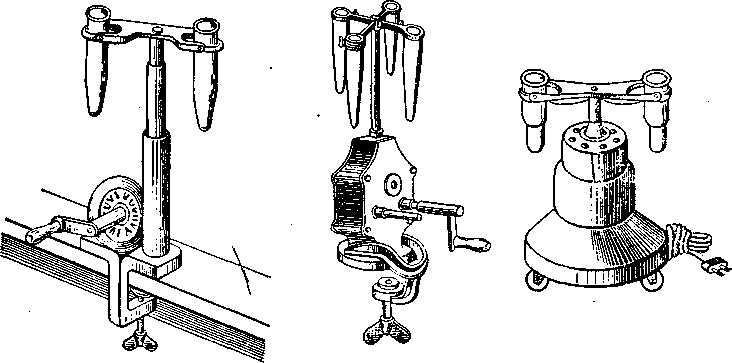
а 5 б
Рис. 13. Центрифуги.
ком на кінці, за допомогою якого можна легко відміряти потрібний невеликий об'єм (рис. 12). У тонкому капілярі піпетки розчин швидко випаровується і сухі солі забивають капіляр. Тому після кожного використання піпетку слід добре промивати водою; в неробочому стані піпетки найкраще зберігати в стакані з водою.
"Тверді осади при виконанні аналізу напівмікрометодом відділяють від розчину центрифугуванням. Для цього використовують ручну (рис. 13, а, б) або електричну (рис. 13, в) центрифуги. Пробірку після проведення в ній реакції осадження вміщують у гніздо центрифуги. Рівень розчину в пгоіірці не повинен доходити до її краю приблизно на 6—8 мм. У протилежне гніздо центрифуги обов'язково вміщують для рівноваги другу пробірку з водою, причому маса обох пробірок повинна бути приблизно однаковою. При порушенні цього правила центрифуга швидко псується. Кристалічні осади збираються щільним шаром на дні пробірки після центрифугування протягом 1—2 хв при швидкості обертання близько 1000 об/хв; аморфні осади потребують більшого часу — 2—3 хв і швидкості обертання до 2000 об/хв. Швидкість обертання треба нарощувати або зменшувати поступово, не допускаючи різких змін, інакше центрифуга може зіпсуватися.
119
Після центрифугування прозорий розчин відділяють від осаду декантацією — простим зливанням в іншу пробірку. Можна також відібрати прозорий розчин капілярною піпеткою.
Розчини в пробірках нагрівають на спеціальних водяних банях, у кришках яких вирізані отвори для кількох пробірок.
tzX
12.
Деякі іони виявляють краплинним методом. Краплину досліджуваного розчину наносять на клаптик фільтрувального паперу, годинникове скельце або фарфорову пластинку із заглибленнями (рис. 14), добавляють краплинами потрібні реактиви і спостерігають ефект реакції. На білій поверхні фарфорової пластинки зручно
с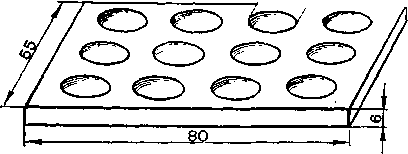 постерігати
кольорові реакції.
постерігати
кольорові реакції.
Рис. 14. Пластинка для краплинного аналізу. Рис. 15. Газова камера.
Рис. 16. Штатив для
зберігання реактивів.
Проводячії реакції осадження, слід приливати розчин осаджувача в певному надлишку. Щоб упевнитися в повноті осадження, після центрифугування до прозорого розчину над осадом добавляють ще кілька краплин осаджувача. Якщо робота виконується правильно, розчин залишається прозорим. Осад треба добре відмити від речовин, які містяться в розчині. Для цього основну частину розчину зливають, потім у пробірку наливають води або іншої промивної рідини і перемішують осад скляною паличкою. Розчин знову центрифугують, після чого зливають промивну рідину. Описану операцію повторюють ще 2—3 рази. Промивною рідиною часто є розчин амонійних солеіі (NH4N03 або NH4C1), особливо в тих випадках, коли мають справу з аморфними осадами, наприклад сульфідів металів, які легко пеп-тизуються і утворюють колоїдні розчини. Часто до промивної рідини добавляють надлишок осаджувача. Так, при промиванні сульфідів металів-застосовують розчин нітрату або хлориду амонію з добавкою сульфіду амонію або насичений сірководнем.
Розчини всіх потрібних хімічних реактивів і сухі препарати містяться в невеликих склянках, вміщених у спеціальний штатив, зовнішній вигляд якого показано на рис. 16. Розчини треба відбирати піпетками з гумовими ковпачками; ці піпетки є одночасно і пробками. Треба пильно стежити за тим, щоб не переплутати піпеток і не вставити піпетку в склянку з іншим розчином. Тому не слід класти піпетку на стіл; відразу після використання закривають нею знову ту склянку, з якої вона була вийнята.
