
- •Головне видавництво видавничого об'єднання «вища школа»
- •Передмова
- •Предмет аналітичної хімії
- •Сучасні завдання аналітичної хімії
- •Методи аналітичної хімії
- •§ 1. Закон діючих мас
- •§ 2. Теорія електролітичної дисоціації
- •§ 3. Концентрація водневих іонів води. Поняття про рН
- •§ 4. Концентрація водневих іонів розчинів кислот і основ
- •§ 5. Гідроліз. Концентрація водневих іонів розчинів солей
- •§ 6. Буферні розчини
- •§ 7. Графічний метод обчислення рН розчину
- •§ 9. Добуток розчинності
- •§ 10. Вплив однойменних іонів на розчинність осадів
- •§ 11. Розчинність осадів у кислотах
- •§ 12. Розчинність осадів при утворенні комплексів
- •§ 13. Осади кристалічні і неявнокристалічні (аморфні)
- •§ 14. Колоїдні розчини
- •Розділ 3. Комплексні сполуки
- •§ 15. Загальні положення
- •§ 16. Комплексні сполуки з неорганічними лігандами
- •§ 17. Комплексні сполуки з органічними лігандами
- •§ 18. Застосування комплексних сполук в аналізі
- •§ 19. Органічні реактиви
- •Розділ 4. Реакції окислення-відновлення
- •§ 20. Загальна характеристика
- •§ 21. Окислювально-відновний потенціал
- •§ 22. Властивості окислювально-відновного потенціалу. Рівняння Нернста
- •§ 23. Окислювальний потенціал і напрям реакцій окислення-відновлення
- •§ 24. Індуктивні реакції окислення-відновлення
- •§ 25. Хроматографічний аналіз. Іонообмінники
- •§ 26. Екстракція. Інші методи розділення
- •§ 27. Аналіз у розчині та сухий метод аналізу
- •§ 28. Макро-, мікро- і напівмікроаналіз. Краплинний, безстружковий і мікрокристалоскопічний методи аналізу
- •§ 29. Чутливість і специфічність реакцій
- •§ Зо. Хімічні реактиви
- •§ 31. Концентрація розчинів
- •§ 32. Техніка роботи в лабораторії якісного аналізу
- •§ 33. Дробний і систематичний методи якісного аналізу
- •§ 34. Класифікація катіонів на аналітичні групи
- •Розділ 7. І аналітична група катіонів
- •§ 35. Загальна характеристика групи
- •§ 36. Натрій
- •§ 38. Амоній
- •§ 39. Магній
- •§ 40. Аналіз суміші катіонів і аналітичної групи
- •Розділ 8. II аналітична група катіонів § 41. Загальна характеристика групи
- •§ 43. Стронцій
- •§ 44. Кальцій
- •§ 45. Аналіз суміші катіонів і і II аналітичних груп
- •Розділ 9. Ill аналітична група катіонів § 46. Загальна характеристика групи
- •§ 47. Алюміній
- •§ 48. Хром
- •§ 50. Марганець
- •§ 51. Цинк
- •§ 52. Кобальт
- •§ 53. Нікель
- •§ 54. Аналіз суміші катіонів III аналітичної групи
- •§ 56. Аналіз суміші катіонів III, II і і аналітичних груп, що містить фосфат-іони
- •Розділ 10. IV аналітична група катіонів
- •§ 57. Загальна характеристика групи
- •Підгрупа срібла
- •§ 59. Свинець
- •§ 60. Ртуть (і)
- •§ 61. Аналіз суміші катіонів підгрупи срібла
- •IV аналітичної групи
- •Підгрупа міді
- •§ 62. Ртуть (II)
- •§ 64. Кадмій
- •§ 65. Вісмут
- •§ 66. Аналіз суміші катіонів IV—і аналітичних груп
- •Розділ 11. V аналітична група катіонів § 67. Загальна характеристика групи
- •§ 69. Сурма
- •§ 70. Олово
- •§ 71. Аналіз суміші катіонів IV і V аналітичних груп
- •Розділ 12. Аналіз рідкісних елементів § 72. Загальна характеристика
- •§ 73. Титан
- •§ 74. Ванадій
- •§ 75. Молібден
- •§ 76. Вольфрам
- •§ 78. Безсірководневі методи якісного аналізу катіонів
- •Розділ 13. Аналіз аніонів § 79. Класифікація аніонів
- •І група аніонів
- •§ 86. Кремнієва кислота і реакції силікат-іонів SiO|—
- •II група аніонів
- •§ 91. Йодистоводнева кислота і реакції йодид-іонів і
- •§ 92. Сірководнева кислота і реакції сульфід-іонів s2-
- •Ill група аніонів
- •§ 94. Азотна кислота і реакції нітрат-іонів імог
- •§ 95. Азотиста кислота і реакції нітрит-іонів n02
- •§ 96. Оцтова кислота і реакції ацетат-іонів сн3соо
- •§ 97. Хлорнувата кислота і реакції гіпохлорат-іонів сюг
- •§ 98. Аналіз суміші аніонів і—III аналітичних груп
- •§ 100. Розчинення речовини і виявлення катіонів
- •§ 101. Виявлення аніонів
- •§ 102. Аналіз металів і сплавів
- •§ 103. Предмет і значення кількісного аналізу
- •§ 104. Визначення основних компонентів і визначення домішок
- •§ 105. Класифікація хімічних методів кількісного аналізу
- •І. Гравіметричий аналіз1
- •§ 106. Суть методу
- •§ 107. Вимоги до осадів у гравіметричному аналізі
- •§ 108. Співосадження
- •§ 109. Умови осадження
- •§ 110. Відокремлення осаду від маточного розчину
- •§ 111. Переведення осаду у вагову форму
- •§ 112. Принцип дії аналітичних терезів
- •§ 113. Правила користування аналітичними терезами і зважування на них
- •Розділ 18. Приклади гравіметричних визначень
- •§ 114. Розрахунки у гравіметричному аналізі
- •0,3115 Г становить 100%;
- •0,5025 Г становить 100%; 0,0874 г » х%,
- •§ 115. Визначення заліза у вигляді оксиду
- •§ 116. Визначення сульфатів у вигляді сульфату барію
- •§ 117. Розділення і визначення кальцію і магнію
- •§ 118. Визначення нікелю в сталях
- •II. Титриметричний аналіз Розділ 19. Загальні положення титриметричного аналізу
- •§ 119. Суть методу
- •§ 120. Концентрація розчинів і розрахунки в титриметричному аналізі
- •§ 121. Приготування робочих розчинів
- •§ 122. Методи непрямого титрування
- •§ 123. Точка еквівалентності
- •§ 124. Установлення точки еквівалентності за допомогою індикаторів
- •§ 125. Мірний посуд
- •§ 126. Перевірка мірного посуду
- •§ 127. Титрування кислотами та основами
- •§ 128. Індикатори методу кислотно-основного титрування (методу нейтралізації)
- •§ 129. Вибір індикаторів при титруванні кислотами та основами
- •§ 130. Криві титрування
- •§ 131. Помилки титрування
- •2NaHc03 ї± н20 -f- c02 -f Na2c03.
- •§ 132. Робочі розчини методу кислотно-основного титрування
- •§ 133. Приклади застосування методу кислотно-основного титрування (методу нейтралізації)
- •§ 134. Криві титрування
- •§ 135. Індикатори методів окислення-відновлення
- •§ 136. Еквівалент у реакціях окислення-відновлення
- •Розділ 22. Перманганатометрія
- •§ 137. Загальна характеристика методу. Приготування робочого розчину перманганату калію
- •§ 138. Визначення заліза
- •§ 139. Визначення пероксиду водню
- •§ 140. Визначення нітритів
- •Розділ 23. Йодометрія
- •§ 141. Загальна характеристика методу
- •§ 142. Приготування робочих титрованих розчинів
- •§ 143. Йодометричне визначення міді
- •§ 144. Йодометричне визначення активного хлору в хлорному вапні
- •B/r. WNa,s203l/NaliS!03јCl " 10°
- •§ 145. Йодометричне визначення сірки
- •Розділ 24. Метод осадження § 146. Загальна характеристика методу
- •§ 147. Індикатори
- •§ 148. Помилки титрування в методі осадження
- •§ 149. Робочі розчини і вихідні речовини методу осадження
- •§ 150. Визначення галогенід-іонів
- •Розділ 25. Методи комплексоутворення
- •§ 151. Загальні положення методів комплексоутворення
- •§ 152. Меркуриметричне визначення хлоридів
- •§ 153. Комплексонометричне визначення твердості води
- •III. Спектрофотометричний і колориметричний методи аналізу Розділ 26. Загальні положення
- •§ 154. Суть методів
- •§ 155. Загальні умови колориметричного визначення
- •§ 156. Закон Бугера—Ламберта—Бера
- •§ 157. Методи вимірювання інтенсивності забарвлення
- •§ 159. Визначення міді в грунтах
- •§ 160. Загальні положення
- •§ 161. Наближене визначення рН
- •§ 162. Безбуферні методи визначення рН
- •§ 163. Буферний метод визначення рН
- •IV. Аналіз різних матеріалів Розділ 29. Аналіз продуктів харчування § 164. Визначення кислотності хліба і молока
- •§ 165. Аналіз грунту і води
- •§ 166. Визначення оксидів кальцію і магнію в доломіті
- •Розділ 31. Аналіз добрив
- •§ 167. Визначення фосфору в суперфосфаті
- •§ 168. Визначення калію в калійних добривах
- •§ 169. Визначення азоту в аміачних добривах
- •Додатки
- •Кислоти
- •Густина розчинів їдких калі і натру
§ 19. Органічні реактиви
Природні органічні реактиви в аналізі неорганічних сполук застосовують досить давно. Ще в стародавні часи греки і римляни користувались вином для визначення середовища розчинів, бо барвники, які входять до складу вин, досить часто є кислотно-основними індикаторами.
Наприкінці XVIII ст. акад. В. М. Севергін для визначення заліза у воді використовував екстракт «дубильних горішків».
У 1883 р. М. О. Ільїнський і Г. Кнорре запропонували реакцію осадження іонів кобальту за допомогою синтетичного органічного реактиву а-нітрозо-|3-нафтолу. У 1905 р. проф. Л. О. Чугаєв запропонував реакцію на іони нікелю за допомогою іншого синтетичного реактиву — диметилглі-оксиму.
Праці Ільїнського і Чугаєва поклали початок новому напряму в аналітичній хімії — застосуванню синтетичних органічних реактивів у неорганічному аналізі.
Тепер для неорганічного аналізу застосовують значно більше органічних реактивів, ніж неорганічних. Це пояснюється тим, що органічні реактиви мають ряд переваг над неорганічними. Головні з них такі: мала розчинність продуктів реакції між органічними реактивами і неорганічними іонами; велика молекулярна маса цих нерозчинних продуктів реакцій, що дуже важлизо для гравіметричного аналізу, особливо при визначенні малих кількостей різних речовин; інтенсивне забарвлення сполук визначуваних неорганічних іонів з органічними реактивами, що да.є можливість широко використовувати органічні реактиви для якісного виявлення і кількісного колориметричного визначення. Крім того, дуже багато сполук неорганічних іонів з органічними реактивами добре розчиняються в органічних розчинниках, що дає можливість застосовувати екстрагування для розділення іонів.
Найбільш стійкі комплекси, як правило, добувають у тих випадках, коли реактив містить солетворну і комплексоутворюючу групи, які при взаємодії з іонами металів утворюють п'яти- і шестичленні кільця.
Органічні реактиви є слабкими кислотами або слабкими основами. Отже, реакції з органічними реактивами значною мірою залежать від
82
рН розчину. Із збільшенням рН розчину стійкість комплексів з органічними реактивами різко підвищується і, навпаки, із зменшенням рН розчину комплекси з органічними реактивами руйнуються.
Наводимо найголовніші властивості кількох органічних реактивів.
ос-Нітрозо-Р-нафтол можна зобразити такою формулою:
N=o )И

Він являє собою оранжево-бурі кристали або порошок. Реактив погано розчиняється у воді, але добре розчиняється в спирті (при нагріванні), ефірі, бензолі, льодяній оцтовій кислоті та розчинах лугів. Температура плавлення а-нітрозо-Р-нафтолу 109,0—109,5° С.
а-Нітрозо-р*-нафтол використовують для виявлення і кількісного визначення кобальту. Реактив утворює з іонами кобальту, заліза (III), міді, цирконію та іншими важкорозчинні сполуки. При взаємодії із солями кобальту (II) утворюється інтенсивно-червоний осад тривалентного кобальту:
ОН+02 (повітря)
4СоС!2 + 12
N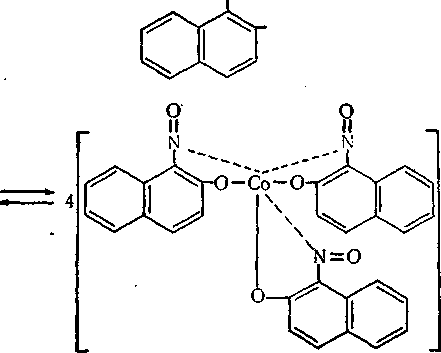 = 0
= 0
+ 8НС1 + 2Н20.
Двовалентний кобальт окислюється до тривалентного за рахунок частково кисню повітря і частково самого реактиву. У цій сполуці кобальт заміщає водень гідроксильних груп і, крім того, координаційно зв'язується з нітрозогрупами (пунктирна лінія).
При кількісному визначенні кобальту осад відфільтровують, прожарюють до Со304 і зважують.
а-Диметилгліоксим (реактив Чугаєва)
Н3С—C=N-OH
Н3С—C=N—OH являє собою білий кристалічний порошок, який важко розчиняється у воді легко розчиняється в спирті, ефірі і в розчинах лугів. а-Диметилгліоксим
83
утворює важкорозчинні сполуки з іонами нікелю, паладію і деякими іншими іонами, а також дає розчинні комплекси з іонами двовалентного заліза тощо. Цей реактив є основним для виявлення, відокремлення і кількісного визначення нікелю. 8-Оксихінолін (оксин)
он
являє собою жовтувато-білі кристали або кристалічний порошок з характерним запахом. Він практично не розчиняється у воді й ефірі, добре розчиняється в спирті, ацетоні, хлороформі, бензолі, в оцтовій кислоті, та в розведених розчинах мінеральних кислот і основ. 8-Оксихінолін має амфотерні властивості:
НОх + Н+ *± U20x+; /С0 = 8 • 10~6; UOx SH++ Ох~; Кк = 1,4 • ІО-'0.
Температура плавлення 8-оксихіноліну 74—76° С, температура кипіння 267° С. Для аналітичних цілей приготовляють розчин 8-оксихіноліну в оцтовій кислоті.
8-Оксихінолін взаємодіє з більшістю катіонів, утворюючи важкорозчинні сполуки:
Титриметричне визначення металів за допомогою оксихіноліну грунтується на тому, що осаджений і відфільтрований оксихінолінат металу розчиняють у соляній кислоті, а оксихінолін, який при цьому утворюється, титрують броматом у присутності броміду калію і метилоранжу:
84
У
>ч>
,
.N-'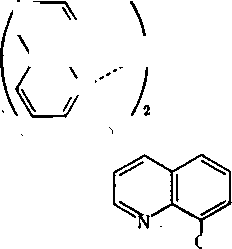

+ 2НВг.
+ 2Вг2:
)Н ОН
Наприкінці титрування оксихіноліну бром взаємодіє з метилоранжем, руйнуючи молекули останнього. Отже, забарвлення індикатора зникає і розчин набуває жовтого кольору від невеликого надлишку брому.
Колориметричне визначення металів у вигляді оксихінолінатів полягає в тому, що оксихінолінати металів розчиняють в органічних розчинниках і вимірюють інтенсивність забарвлення неводного розчину.
Купферон. Амонійна сіль N-нітрозофенілгідроксиламіну являє собою білі або буруваті лусочки, солодкуваті на смак. Реактив добре розчиняється у воді; при зберіганні розкладається і темніє.
aN-N=0 0-NH4 Для аналітичних цілей використовують 6%-й водний розчинкупферону. Баудіш запропонував цю сіль як специфічний реактив для виявлення міді й заліза, від чого і пішла назва купферон. Проте пізніше було виявлено, що купферон взаємодіє з великою кількістю катіонів, утворюючи при цьому важкорозчинні сполуки. Іони металу заміщують іони амонію і, крім того, метал координаційно зв'язується з азотом або киснем нітрозогрупи:
Р V-N-N=0 ^=^ 0-Меп+/п, або
/ V- N-N = 9 ^^ " -Меп+/п.
О-
Осадження купфероном у сильнокислих розчинах дає можливість відокремити залізо, ванадій, цирконій, титан, олово, ніобій, тантал від алюмінію, бору, берилію, фосфору, марганцю, нікелю і урану. Купферонати треба осаджувати при охолодженні, щоб н^ розклався купферон. Осади купферонатів промивають холодним розчином сірчаної або соляної кислот з невеликим вмістом купферону.
Визначають метали за допомогою купферону головним чином гравіметричним методом, зважуючи оксиди металів після прожарювання купферонатів. Відомі також методи амперометричного титрування за допомогою купферону.
Розділяють метали за допомогою купферону осадженням їх при різній кислотності розчину. Купферонати металів добре екстрагуються неводними розчинниками. Отже, для розділення металів краще застосовувати не осадження, а екстракцію різних іонів у вигляді купферонатів.
85
Основним недоліком застосування купферону в аналізі є те, що він легко розкладається (обсмолюється). Через це осади не можна зважувати у вигляді купферонатів, а треба прожарювати до оксидів. Розклад купферону прискорюється під дією світла, тому його зберігають у склянках з чорного скла або в склянках, загорнутих у чорний папір.
Дитизон (дифенілтіокарбазон)
,NH—NH—С„Н5
^N=N—C„H5
являє собою тоненькі голочки синьо-чорного кольору з фіолетовим відтінком. У воді дитизон практично не розчиняється. Порівняно легко розчиняється він у багатьох органічних розчинниках (хлороформ, чотирихлористий вуглець, бензол тощо), а також у розчинах лугів, гідроксиді амонію і в концентрованих кислотах.
Для аналітичних цілей застосовують розчин дитизону в органічних розчинниках (СНС13, СС14 тощо). Розчин дитизону в органічних розчинниках має зелений колір, у водних розчинах лугів — жовтий. При взаємодії з іонами важких металів дитизон утворює комплексні сполуки:
/Vfe'-S^
і ^c=n-nh-c6h5;
C6H5-N = N
C6H5-NH-N = C /We C=N-NH-C6H5.
N=N' N=N
I 1
H5C6 C6HS
Тривалентні метали приєднують три дитизонат-іони. Дитизонати металів практично не розчиняються у воді і добре розчиняються в органічних розчинниках. Комплекси металів з дитизоном мають кольори від жовто-оранжевого до червоно-фіолетового.
Взаємодія дитизону з іонами металів залежить від рН розчину. Так, стійкі комплекси платини, золота, паладію, ртуті й срібла утворюються в кислому середовищі, а менш стійкі комплекси утворюються в слабкокис-лому або лужному середовищі. За зміною рН розчину, а також присутністю різних комплексоутворювачів для зв'язування сторонніх іонів часто можна визначити одні іони в присутності інших.
Дитизон широко використовують у якісному аналізі для виявлення різних металів, а також у колориметричному аналізі для їх кількісного визначення.
Алізарин (1,2-діоксіантрахінон)
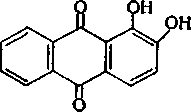
86
являє собою оранжево-червоні голочки або бурувато-жовтий порошок, який погано розчиняється у воді, краще — в спиртах, добре розчиняється в розчинах лугів. В аналізі найчастіше застосовують алізарин S-натрієву сіль 1,2-діоксіантрахіпон-З-сульфокислотіі:
Q ОН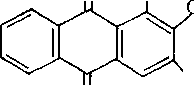 0 S03Na
0 S03Na
Алізарин S являє собою оранжево-жовті голочки або порошок. Водний розчин його забарвлений в бурувато-жовтий колір, а лужний розчин має фіолетовий колір. Для аналізу використовують 0,03%-й водний розчин алізарину S.
Алізарин і алізарин S утворюють забарвлені сполуки з іонами металів. Найчастіше ці реактиви використовують для виявлення і колориметричного визначення іонів алюмінію, рідкісноземельних елементів, торію, цирконію тощо.
Алізарин — це слабка кислота, забарвлення якої змінюється із зміною рН розчину, тобто вона є кислотно-основним індикатором. Це треба мати на увазі при використанні алізарину в аналізі, бо колір алізарину в лужному розчині схожий на колір алізаринатів металів. Забарвлення алізарину змінюється від жовтого до червоно-фіолетового при рН = 5,5, а комплекси з металами утворюються при рН = 4. Тому реакції на іони металів треба виконувати в оцтовокислому середовищі.
Саліцилова кислота
^
4![]() он
он
он
являє собою безбарвні кристали з температурою плавлення 157—159° С, які погано розчиняються у воді, добре розчиняються в спирті, ацетоні, хлороформі та інших органічних розчинниках. Оскільки саліцилова кислота важкорозчинна, в аналізі часто використовують сульфосаліцилову кислоту
HO,S. ^ £'
ОН
![]()
ОН
яка добре розчиняється у воді, спирті й ефірі. Саліцилову кислоту найчастіше використовують для колориметричного визначення заліза, іноді — титану та деяких інших іонів. Дифен і л карбазид
.NH—NH—С„Н.
о=с/
XNM—NH—С6Н6
87
являє собою майже безбарвні або блідо-рожеві дрібні кристали. Реактив погано розчиняється у воді, не розчиняється у хлороформі й ефірі, але добре розчиняється в спирті (при нагріванні), в ацетоні і в льодяній оцтовій кислоті. На повітрі дифенілкарбазид окислюється до дифенілкарбазону:
,NH—NH—QH5 .NH—NH—С„Н5
20=С( + 02 -* 20=С( + 2Н„0.
NNH—NH—CeH5 XN=N—CeH5
Дифенілкарбазид, що є в продажу, містить домішки дифенілкарбазону. Дифенілкарбазид взаємодіє з багатьма катіонами. При цьому утворюються забарвлені сполуки, які екстрагуються неводними розчинниками. Так, ртуть (II) утворює комплекс голубого кольору, мідь (II) і кадмій — червоного; срібло, мідь (II) і магній—фіолетового, свинець — блідо-рожевого, нікель — голубувато-фіолетового, цинк — рожево-фіолетового, залізо (III) — голубувато-червоного. З дифенілкарбазидом взаємодіє оцтова кислота, при цьому утворюється сполука, забарвлена у фіолетово-червоний колір.
Структуру комплексів металів з дифенілкарбазидом можна зобразити так:
/We'-0-C = N-NH-CeH5
HN NH
І
Дифенілкарбазид найчастіше використовують як індикатор при визначенні хлоридів. Дифенілкарбазон
.NH—NH—СвНв 0=С/
\N=N-CeHB
— оранжево-червоні кристали. Реактив не розчиняється у воді, розчиняється в спирті, хлороформі й бензолі. Розчини дифенілкарбазону забарвлені в оранжевий колір.
Структуру комплексів металів з дифенілкарбазоном можна зобразити так:
/°\
Me} C=N-NH-C6H5.
h5c6-Wn \
В аналізі користуються 0,2%-м спиртовим розчино^ реактиву. Дифеиілкарбазон взаємодіє з іонами металів подібно до дифенілкарба-зиду і використовується в аналізі так, як і дифенілкарбазид. Діетилдитіокарбамат натрію
CiiH5\N_c^
С2н/ 4SNa
являє собою білі кристали, легкорозчинні у воді. При взаємодії з важкими металами діетилдитіокарбамат натрію утворює комплексні сполуки, які
88
практично не розчиняються у воді. Більшість їх добре розчиняється в органічних розчинниках. Тому при використанні діетилдитіокарбамату широко застосовуються екстракційні методи розділення іонів, а також екстракційно-фотометричні методи визначення деяких з них.
Структура комплексних сполук металів з діетилдитіокарбаматом натрію така:
сн3-сн2 .SN s4 сн2-сн3
сн3-сн2 \' V^ сн2-сн3
Дієтилдитіокарбамат натрію взаємодіє головним чином з катіонами металів, сульфіди яких погано розчиняються у воді. Неводні розчини діетил-дитіокарбаматних комплексів мають жовтий і жовто-коричневий колір. Діетилдитіокарбамат натрію швидко розкладається в кислих розчинах, що треба мати на увазі при використанні його в аналізі. Найчастіше діетилдитіокарбамат натрію використовують для розділення різних іонів, для концентрування домішок важких металів і для колориметричного визначення міді.
