
- •Головне видавництво видавничого об'єднання «вища школа»
- •Передмова
- •Предмет аналітичної хімії
- •Сучасні завдання аналітичної хімії
- •Методи аналітичної хімії
- •§ 1. Закон діючих мас
- •§ 2. Теорія електролітичної дисоціації
- •§ 3. Концентрація водневих іонів води. Поняття про рН
- •§ 4. Концентрація водневих іонів розчинів кислот і основ
- •§ 5. Гідроліз. Концентрація водневих іонів розчинів солей
- •§ 6. Буферні розчини
- •§ 7. Графічний метод обчислення рН розчину
- •§ 9. Добуток розчинності
- •§ 10. Вплив однойменних іонів на розчинність осадів
- •§ 11. Розчинність осадів у кислотах
- •§ 12. Розчинність осадів при утворенні комплексів
- •§ 13. Осади кристалічні і неявнокристалічні (аморфні)
- •§ 14. Колоїдні розчини
- •Розділ 3. Комплексні сполуки
- •§ 15. Загальні положення
- •§ 16. Комплексні сполуки з неорганічними лігандами
- •§ 17. Комплексні сполуки з органічними лігандами
- •§ 18. Застосування комплексних сполук в аналізі
- •§ 19. Органічні реактиви
- •Розділ 4. Реакції окислення-відновлення
- •§ 20. Загальна характеристика
- •§ 21. Окислювально-відновний потенціал
- •§ 22. Властивості окислювально-відновного потенціалу. Рівняння Нернста
- •§ 23. Окислювальний потенціал і напрям реакцій окислення-відновлення
- •§ 24. Індуктивні реакції окислення-відновлення
- •§ 25. Хроматографічний аналіз. Іонообмінники
- •§ 26. Екстракція. Інші методи розділення
- •§ 27. Аналіз у розчині та сухий метод аналізу
- •§ 28. Макро-, мікро- і напівмікроаналіз. Краплинний, безстружковий і мікрокристалоскопічний методи аналізу
- •§ 29. Чутливість і специфічність реакцій
- •§ Зо. Хімічні реактиви
- •§ 31. Концентрація розчинів
- •§ 32. Техніка роботи в лабораторії якісного аналізу
- •§ 33. Дробний і систематичний методи якісного аналізу
- •§ 34. Класифікація катіонів на аналітичні групи
- •Розділ 7. І аналітична група катіонів
- •§ 35. Загальна характеристика групи
- •§ 36. Натрій
- •§ 38. Амоній
- •§ 39. Магній
- •§ 40. Аналіз суміші катіонів і аналітичної групи
- •Розділ 8. II аналітична група катіонів § 41. Загальна характеристика групи
- •§ 43. Стронцій
- •§ 44. Кальцій
- •§ 45. Аналіз суміші катіонів і і II аналітичних груп
- •Розділ 9. Ill аналітична група катіонів § 46. Загальна характеристика групи
- •§ 47. Алюміній
- •§ 48. Хром
- •§ 50. Марганець
- •§ 51. Цинк
- •§ 52. Кобальт
- •§ 53. Нікель
- •§ 54. Аналіз суміші катіонів III аналітичної групи
- •§ 56. Аналіз суміші катіонів III, II і і аналітичних груп, що містить фосфат-іони
- •Розділ 10. IV аналітична група катіонів
- •§ 57. Загальна характеристика групи
- •Підгрупа срібла
- •§ 59. Свинець
- •§ 60. Ртуть (і)
- •§ 61. Аналіз суміші катіонів підгрупи срібла
- •IV аналітичної групи
- •Підгрупа міді
- •§ 62. Ртуть (II)
- •§ 64. Кадмій
- •§ 65. Вісмут
- •§ 66. Аналіз суміші катіонів IV—і аналітичних груп
- •Розділ 11. V аналітична група катіонів § 67. Загальна характеристика групи
- •§ 69. Сурма
- •§ 70. Олово
- •§ 71. Аналіз суміші катіонів IV і V аналітичних груп
- •Розділ 12. Аналіз рідкісних елементів § 72. Загальна характеристика
- •§ 73. Титан
- •§ 74. Ванадій
- •§ 75. Молібден
- •§ 76. Вольфрам
- •§ 78. Безсірководневі методи якісного аналізу катіонів
- •Розділ 13. Аналіз аніонів § 79. Класифікація аніонів
- •І група аніонів
- •§ 86. Кремнієва кислота і реакції силікат-іонів SiO|—
- •II група аніонів
- •§ 91. Йодистоводнева кислота і реакції йодид-іонів і
- •§ 92. Сірководнева кислота і реакції сульфід-іонів s2-
- •Ill група аніонів
- •§ 94. Азотна кислота і реакції нітрат-іонів імог
- •§ 95. Азотиста кислота і реакції нітрит-іонів n02
- •§ 96. Оцтова кислота і реакції ацетат-іонів сн3соо
- •§ 97. Хлорнувата кислота і реакції гіпохлорат-іонів сюг
- •§ 98. Аналіз суміші аніонів і—III аналітичних груп
- •§ 100. Розчинення речовини і виявлення катіонів
- •§ 101. Виявлення аніонів
- •§ 102. Аналіз металів і сплавів
- •§ 103. Предмет і значення кількісного аналізу
- •§ 104. Визначення основних компонентів і визначення домішок
- •§ 105. Класифікація хімічних методів кількісного аналізу
- •І. Гравіметричий аналіз1
- •§ 106. Суть методу
- •§ 107. Вимоги до осадів у гравіметричному аналізі
- •§ 108. Співосадження
- •§ 109. Умови осадження
- •§ 110. Відокремлення осаду від маточного розчину
- •§ 111. Переведення осаду у вагову форму
- •§ 112. Принцип дії аналітичних терезів
- •§ 113. Правила користування аналітичними терезами і зважування на них
- •Розділ 18. Приклади гравіметричних визначень
- •§ 114. Розрахунки у гравіметричному аналізі
- •0,3115 Г становить 100%;
- •0,5025 Г становить 100%; 0,0874 г » х%,
- •§ 115. Визначення заліза у вигляді оксиду
- •§ 116. Визначення сульфатів у вигляді сульфату барію
- •§ 117. Розділення і визначення кальцію і магнію
- •§ 118. Визначення нікелю в сталях
- •II. Титриметричний аналіз Розділ 19. Загальні положення титриметричного аналізу
- •§ 119. Суть методу
- •§ 120. Концентрація розчинів і розрахунки в титриметричному аналізі
- •§ 121. Приготування робочих розчинів
- •§ 122. Методи непрямого титрування
- •§ 123. Точка еквівалентності
- •§ 124. Установлення точки еквівалентності за допомогою індикаторів
- •§ 125. Мірний посуд
- •§ 126. Перевірка мірного посуду
- •§ 127. Титрування кислотами та основами
- •§ 128. Індикатори методу кислотно-основного титрування (методу нейтралізації)
- •§ 129. Вибір індикаторів при титруванні кислотами та основами
- •§ 130. Криві титрування
- •§ 131. Помилки титрування
- •2NaHc03 ї± н20 -f- c02 -f Na2c03.
- •§ 132. Робочі розчини методу кислотно-основного титрування
- •§ 133. Приклади застосування методу кислотно-основного титрування (методу нейтралізації)
- •§ 134. Криві титрування
- •§ 135. Індикатори методів окислення-відновлення
- •§ 136. Еквівалент у реакціях окислення-відновлення
- •Розділ 22. Перманганатометрія
- •§ 137. Загальна характеристика методу. Приготування робочого розчину перманганату калію
- •§ 138. Визначення заліза
- •§ 139. Визначення пероксиду водню
- •§ 140. Визначення нітритів
- •Розділ 23. Йодометрія
- •§ 141. Загальна характеристика методу
- •§ 142. Приготування робочих титрованих розчинів
- •§ 143. Йодометричне визначення міді
- •§ 144. Йодометричне визначення активного хлору в хлорному вапні
- •B/r. WNa,s203l/NaliS!03јCl " 10°
- •§ 145. Йодометричне визначення сірки
- •Розділ 24. Метод осадження § 146. Загальна характеристика методу
- •§ 147. Індикатори
- •§ 148. Помилки титрування в методі осадження
- •§ 149. Робочі розчини і вихідні речовини методу осадження
- •§ 150. Визначення галогенід-іонів
- •Розділ 25. Методи комплексоутворення
- •§ 151. Загальні положення методів комплексоутворення
- •§ 152. Меркуриметричне визначення хлоридів
- •§ 153. Комплексонометричне визначення твердості води
- •III. Спектрофотометричний і колориметричний методи аналізу Розділ 26. Загальні положення
- •§ 154. Суть методів
- •§ 155. Загальні умови колориметричного визначення
- •§ 156. Закон Бугера—Ламберта—Бера
- •§ 157. Методи вимірювання інтенсивності забарвлення
- •§ 159. Визначення міді в грунтах
- •§ 160. Загальні положення
- •§ 161. Наближене визначення рН
- •§ 162. Безбуферні методи визначення рН
- •§ 163. Буферний метод визначення рН
- •IV. Аналіз різних матеріалів Розділ 29. Аналіз продуктів харчування § 164. Визначення кислотності хліба і молока
- •§ 165. Аналіз грунту і води
- •§ 166. Визначення оксидів кальцію і магнію в доломіті
- •Розділ 31. Аналіз добрив
- •§ 167. Визначення фосфору в суперфосфаті
- •§ 168. Визначення калію в калійних добривах
- •§ 169. Визначення азоту в аміачних добривах
- •Додатки
- •Кислоти
- •Густина розчинів їдких калі і натру
§ 17. Комплексні сполуки з органічними лігандами
Органічні кислоти взаємодіють з багатьма іонами з утворенням солей. Деякі з них являють собою прості солі, а інші — комплексні сполуки. Так, важкорозчинний сульфат свинцю легко розчиняється в ацетаті амонію: PbS04 + 4CH3COONH4 <± (NH4)2 [Pb (CH3COO)4] + (NH4)2 S04.
77
Розчинення відбувається тому, що в результаті реакції утворюється комплексна сполука ацетату свинцю, який у водних розчинах слабко дисоціює, тобто утворює менше іонів порівняно з насиченим розчином сульфату свинцю.
Органічні реактиви при взаємодії з неорганічними іонами утворюють комплексні сполуки за рахунок електровалентних зв'язків, заміщуючи водень органічного реактиву на метал, і за рахунок координаційних зв'язків. До складу органічних реактивів, в яких водень може заміщуватись на метал, входять солетворні групи: —СООН (карбоксильна група), —ОН (спиртова або фенольна гідроксильна група), =С—SH (сульфгідрильна група) тощо. Координаційні зв'язки між металом і органічним реактивом утворюються тоді, коли до складу органічного реактиву входить оксимна
/R І
-N—, карбонільна група
-N-
\н
2>
група =КОН, амінний азот — NH.
=СО, тіонна группа =C=S тощо.
Отже, органічна сполука може бути хорошим реактивом у тому разі, коли до її складу входить солетворне і комплексотворне угруповання. Велике значення має розташування цих груп, тобто структура реактиву. Найбільш стійкі комплекси утворюються тоді, коли ці угруповання розташовані в ортоположенні (рядом).
Якщо органічний реактив може приєднуватись до іонів металу не одним зв'язком, а двома або більше, то в таких комплексах метал (центральний атом) бере участь в утворенні циклів (кілець). Типовими прикладами є: етилендіамінний комплекс кобальту
сн2-сн2
"J1 NH2 NH2
CH,-N
 LCH2-N'
LCH2-N'
/\
н н
>Со' " І
^NH2-CH2
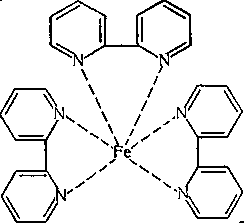
комплекс заліза (II) з а.а'-дипіридилом
21+
78
комплекс
саліцилату заліза (III)![]()
ТОЩО.
З цих прикладів видно, що координовані групи — молекули реактиву приєднуються до центрального іона — металу не одним, а кількома атомами, утворюючи конфігурацію молекули, схожу на клешні рака. Такі комплекси називають клешнеподібними, хелатними. Назва ця походить від грецького слова «ХіЬр, що означає клешня (рака або краба). Отже, хелатні сполуки утворюються лише лігандами, які мають дві або більше точок приєднання до іона металу.
Хелатними (циклічними) комплексними сполуками називаються комплекси, в яких метал бере участь в утворенні циклів незалежно від того, якими зв'язками він зв'язаний з лігандом: електровалентними чи додатковими (побічними валентностями за Вернером). При написанні структурних формул головні зв'язки позначають рисками, а додаткові — пунктиром або стрілками, напрямленими від атома ліганда-донора загальної електронної пари до центрального іона (металу).
Сполуки, в яких іон металу зв'язаний головним і додатковим зв'язками з тією самою молекулою реактиву (ліганду), називаються внутрішньокомп-лексними сполуками. У таких комплексах метал з реактивом утворює один або кілька цгклів. Прикладом внутрішньокомплексних сполук можуть бути етилендіамінтетраацетатні (трилонатні) комплекси металів:
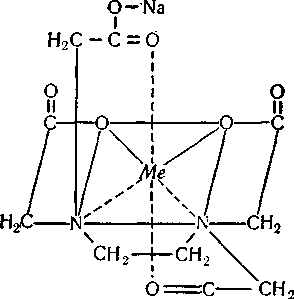
У цих сполуках метал з лігандом утворює три п'ятичленних цикли.
Отже, всі внутрішньокомплексні сполуки є хелатними сполуками. Це поняття включає і внутрішньокомплексні сполуки. Таким чином, виділяти внутрішньокомплексні сполуки серед хелатних немає підстав, бо всі хелатні сполуки мають ідентичні властивості незалежно від того, в результаті яких зв'язків утворюється цикл. У більшості випадків у літературі цілком справедливо ототожнюють поняття внутрішньокомплексних і хелатних сполук, тобто розглядають їх як синоніми.
79
Утворення циклів (кілець) збільшує стійкість комплексів. Серед хелатних сполук особливо стійкі сполуки, які утворюють п'яти- и шестичленні кільця (правило Л. О. Чугаєва). Відомо багато досить стійких хелатних сполук і з чотиричленними циклами.
Стійкість хелатних комплексів, як і звичайних комплексних сполук, характеризується константою нестійкості.
