
- •Головне видавництво видавничого об'єднання «вища школа»
- •Передмова
- •Предмет аналітичної хімії
- •Сучасні завдання аналітичної хімії
- •Методи аналітичної хімії
- •§ 1. Закон діючих мас
- •§ 2. Теорія електролітичної дисоціації
- •§ 3. Концентрація водневих іонів води. Поняття про рН
- •§ 4. Концентрація водневих іонів розчинів кислот і основ
- •§ 5. Гідроліз. Концентрація водневих іонів розчинів солей
- •§ 6. Буферні розчини
- •§ 7. Графічний метод обчислення рН розчину
- •§ 9. Добуток розчинності
- •§ 10. Вплив однойменних іонів на розчинність осадів
- •§ 11. Розчинність осадів у кислотах
- •§ 12. Розчинність осадів при утворенні комплексів
- •§ 13. Осади кристалічні і неявнокристалічні (аморфні)
- •§ 14. Колоїдні розчини
- •Розділ 3. Комплексні сполуки
- •§ 15. Загальні положення
- •§ 16. Комплексні сполуки з неорганічними лігандами
- •§ 17. Комплексні сполуки з органічними лігандами
- •§ 18. Застосування комплексних сполук в аналізі
- •§ 19. Органічні реактиви
- •Розділ 4. Реакції окислення-відновлення
- •§ 20. Загальна характеристика
- •§ 21. Окислювально-відновний потенціал
- •§ 22. Властивості окислювально-відновного потенціалу. Рівняння Нернста
- •§ 23. Окислювальний потенціал і напрям реакцій окислення-відновлення
- •§ 24. Індуктивні реакції окислення-відновлення
- •§ 25. Хроматографічний аналіз. Іонообмінники
- •§ 26. Екстракція. Інші методи розділення
- •§ 27. Аналіз у розчині та сухий метод аналізу
- •§ 28. Макро-, мікро- і напівмікроаналіз. Краплинний, безстружковий і мікрокристалоскопічний методи аналізу
- •§ 29. Чутливість і специфічність реакцій
- •§ Зо. Хімічні реактиви
- •§ 31. Концентрація розчинів
- •§ 32. Техніка роботи в лабораторії якісного аналізу
- •§ 33. Дробний і систематичний методи якісного аналізу
- •§ 34. Класифікація катіонів на аналітичні групи
- •Розділ 7. І аналітична група катіонів
- •§ 35. Загальна характеристика групи
- •§ 36. Натрій
- •§ 38. Амоній
- •§ 39. Магній
- •§ 40. Аналіз суміші катіонів і аналітичної групи
- •Розділ 8. II аналітична група катіонів § 41. Загальна характеристика групи
- •§ 43. Стронцій
- •§ 44. Кальцій
- •§ 45. Аналіз суміші катіонів і і II аналітичних груп
- •Розділ 9. Ill аналітична група катіонів § 46. Загальна характеристика групи
- •§ 47. Алюміній
- •§ 48. Хром
- •§ 50. Марганець
- •§ 51. Цинк
- •§ 52. Кобальт
- •§ 53. Нікель
- •§ 54. Аналіз суміші катіонів III аналітичної групи
- •§ 56. Аналіз суміші катіонів III, II і і аналітичних груп, що містить фосфат-іони
- •Розділ 10. IV аналітична група катіонів
- •§ 57. Загальна характеристика групи
- •Підгрупа срібла
- •§ 59. Свинець
- •§ 60. Ртуть (і)
- •§ 61. Аналіз суміші катіонів підгрупи срібла
- •IV аналітичної групи
- •Підгрупа міді
- •§ 62. Ртуть (II)
- •§ 64. Кадмій
- •§ 65. Вісмут
- •§ 66. Аналіз суміші катіонів IV—і аналітичних груп
- •Розділ 11. V аналітична група катіонів § 67. Загальна характеристика групи
- •§ 69. Сурма
- •§ 70. Олово
- •§ 71. Аналіз суміші катіонів IV і V аналітичних груп
- •Розділ 12. Аналіз рідкісних елементів § 72. Загальна характеристика
- •§ 73. Титан
- •§ 74. Ванадій
- •§ 75. Молібден
- •§ 76. Вольфрам
- •§ 78. Безсірководневі методи якісного аналізу катіонів
- •Розділ 13. Аналіз аніонів § 79. Класифікація аніонів
- •І група аніонів
- •§ 86. Кремнієва кислота і реакції силікат-іонів SiO|—
- •II група аніонів
- •§ 91. Йодистоводнева кислота і реакції йодид-іонів і
- •§ 92. Сірководнева кислота і реакції сульфід-іонів s2-
- •Ill група аніонів
- •§ 94. Азотна кислота і реакції нітрат-іонів імог
- •§ 95. Азотиста кислота і реакції нітрит-іонів n02
- •§ 96. Оцтова кислота і реакції ацетат-іонів сн3соо
- •§ 97. Хлорнувата кислота і реакції гіпохлорат-іонів сюг
- •§ 98. Аналіз суміші аніонів і—III аналітичних груп
- •§ 100. Розчинення речовини і виявлення катіонів
- •§ 101. Виявлення аніонів
- •§ 102. Аналіз металів і сплавів
- •§ 103. Предмет і значення кількісного аналізу
- •§ 104. Визначення основних компонентів і визначення домішок
- •§ 105. Класифікація хімічних методів кількісного аналізу
- •І. Гравіметричий аналіз1
- •§ 106. Суть методу
- •§ 107. Вимоги до осадів у гравіметричному аналізі
- •§ 108. Співосадження
- •§ 109. Умови осадження
- •§ 110. Відокремлення осаду від маточного розчину
- •§ 111. Переведення осаду у вагову форму
- •§ 112. Принцип дії аналітичних терезів
- •§ 113. Правила користування аналітичними терезами і зважування на них
- •Розділ 18. Приклади гравіметричних визначень
- •§ 114. Розрахунки у гравіметричному аналізі
- •0,3115 Г становить 100%;
- •0,5025 Г становить 100%; 0,0874 г » х%,
- •§ 115. Визначення заліза у вигляді оксиду
- •§ 116. Визначення сульфатів у вигляді сульфату барію
- •§ 117. Розділення і визначення кальцію і магнію
- •§ 118. Визначення нікелю в сталях
- •II. Титриметричний аналіз Розділ 19. Загальні положення титриметричного аналізу
- •§ 119. Суть методу
- •§ 120. Концентрація розчинів і розрахунки в титриметричному аналізі
- •§ 121. Приготування робочих розчинів
- •§ 122. Методи непрямого титрування
- •§ 123. Точка еквівалентності
- •§ 124. Установлення точки еквівалентності за допомогою індикаторів
- •§ 125. Мірний посуд
- •§ 126. Перевірка мірного посуду
- •§ 127. Титрування кислотами та основами
- •§ 128. Індикатори методу кислотно-основного титрування (методу нейтралізації)
- •§ 129. Вибір індикаторів при титруванні кислотами та основами
- •§ 130. Криві титрування
- •§ 131. Помилки титрування
- •2NaHc03 ї± н20 -f- c02 -f Na2c03.
- •§ 132. Робочі розчини методу кислотно-основного титрування
- •§ 133. Приклади застосування методу кислотно-основного титрування (методу нейтралізації)
- •§ 134. Криві титрування
- •§ 135. Індикатори методів окислення-відновлення
- •§ 136. Еквівалент у реакціях окислення-відновлення
- •Розділ 22. Перманганатометрія
- •§ 137. Загальна характеристика методу. Приготування робочого розчину перманганату калію
- •§ 138. Визначення заліза
- •§ 139. Визначення пероксиду водню
- •§ 140. Визначення нітритів
- •Розділ 23. Йодометрія
- •§ 141. Загальна характеристика методу
- •§ 142. Приготування робочих титрованих розчинів
- •§ 143. Йодометричне визначення міді
- •§ 144. Йодометричне визначення активного хлору в хлорному вапні
- •B/r. WNa,s203l/NaliS!03јCl " 10°
- •§ 145. Йодометричне визначення сірки
- •Розділ 24. Метод осадження § 146. Загальна характеристика методу
- •§ 147. Індикатори
- •§ 148. Помилки титрування в методі осадження
- •§ 149. Робочі розчини і вихідні речовини методу осадження
- •§ 150. Визначення галогенід-іонів
- •Розділ 25. Методи комплексоутворення
- •§ 151. Загальні положення методів комплексоутворення
- •§ 152. Меркуриметричне визначення хлоридів
- •§ 153. Комплексонометричне визначення твердості води
- •III. Спектрофотометричний і колориметричний методи аналізу Розділ 26. Загальні положення
- •§ 154. Суть методів
- •§ 155. Загальні умови колориметричного визначення
- •§ 156. Закон Бугера—Ламберта—Бера
- •§ 157. Методи вимірювання інтенсивності забарвлення
- •§ 159. Визначення міді в грунтах
- •§ 160. Загальні положення
- •§ 161. Наближене визначення рН
- •§ 162. Безбуферні методи визначення рН
- •§ 163. Буферний метод визначення рН
- •IV. Аналіз різних матеріалів Розділ 29. Аналіз продуктів харчування § 164. Визначення кислотності хліба і молока
- •§ 165. Аналіз грунту і води
- •§ 166. Визначення оксидів кальцію і магнію в доломіті
- •Розділ 31. Аналіз добрив
- •§ 167. Визначення фосфору в суперфосфаті
- •§ 168. Визначення калію в калійних добривах
- •§ 169. Визначення азоту в аміачних добривах
- •Додатки
- •Кислоти
- •Густина розчинів їдких калі і натру
§ 12. Розчинність осадів при утворенні комплексів
Зміна розчинності осадів часто пов'язана з утворенням комплексних сполук. Буває багато випадків, коли осаджувані іони здатні до взаємодії з різними лігандами \ внаслідок чого останні впливають на стан рівноваги між осадом і розчином. Так, іони винної кислоти та інших органічних сполук заважають осадженню заліза у формі гідроксиду. Розчинність осаду PbS04 в присутності Pb (N03)2 збільшується в зв'язку з утворенням комплексних катіонів [PbS04]2+, [Pbs (S04)2]2+ тощо. При осадженні іонів срібла надлишком соляної кислоти або хлориду натрію частина осаду хлориду срібла
переходить в розчин у формі комплексних аніонів [AgCl2]~ або [AgCl3]2_. Зміщення рівноваги між осадом і розчином у бік розчинення осаду залежить від величини добутку розчинності осаду, концентрації ліганду, кислотності розчину та ряду інших умов.
Розчинність осадів у присутності сторонніх лігандів. Утворення комплексних сполук у процесі осадження є в багатьох випадках небажаним, бо призводить до збільшення розчинності осадів. Але комплексоутворення має також дуже велике позитивне значення. На основі реакцій комплексоутворення створена нова галузь хімії — хімія комплексних сполук. В останні роки комплексні сполуки застосовуються в різних галузях хімічної технології, біології, у медицині тощо.
Електролітичне покриття металів, добування рідкісних і рідкісноземельних металів, виробництво ряду барвників, зм'якшення води, розчинення каменів у нирках та багато інших процесів грунтуються на реакціях комплексоутворення. Особливо широко використовуються реакції комплексоутворення в аналітичній хімії для розділення різних елементів. Наприклад, для розділення іонів міді й вісмуту до розчину солей обох металів доливають надлишок аміаку, причому мідь утворює розчинний аміа-кат, а вісмут осаджується у вигляді гідроксиду. Залізо можна відокремити від титану сірководнем в аміачному розчині. Для цього до розчину добав-
1 Ліганди — це молекули або іони, безпосередньо зв'язані з центральним атомом в комплексі.
62
ляють винної кислоти, яка в аміачному розчині зв'язує (маскує) іони титану в стійку розчинну комплексну сполуку. Іони міді й кадмію утворюють з ціанідом калію комплексні сполуки різної стійкості. При обробці такої суміші сірководнем кадмій осаджується у формі сульфіду, а мідь залишається в розчині. Для розділення заліза і кальцію можна застосувати оксалат калію. Іони С2ОЇ~ зв'язують (маскують) іони заліза так міцно, що вони навіть не дають реакції з гексаціано-(II) фератом калію. Кальцій осаджується у формі СаС204. AgCl можна відокремити від йодиду, обробляючи обидва осади розчином аміаку; хлорид срібла, який є більш розчинною сполукою, ніж йодид, переходить у розчин у вигляді аміакату срібла:
AgCl + 2NH3 = [Ag (NH3)2] CI.
За допомогою лігандів можна зв'язати різні іони, які заважають аналізу методом осадження. По суті цей прийом відповідає операції розділення без фільтрування, промивання тощо, які забирають багато часу.
Обчислення розчинності осадів при комплексоутворенні пов'язане з певними труднощами. Зумовлено це тим, що для багатьох комплексних сполук не відомі константи дисоціації (константи нестійкості). Крім того, комплексні іони, аналогічно до багатоосновних кислот, утворюються й дисоціюють ступінчасто. Стан рівноваги між окремими формами комплексних груп залежить від концентрації ліганду і кислотності розчину.
Розглянемо кілька прикладів обчислення розчинності осадів при комплексоутворенні. Приклади.
1. Обчислити розчинність хлориду срібла в 1 М розчині N'H4OH за умови, що після досягнення рівноваги концентрація аміаку [NH3] = 0,1 М.
Розчинність хлориду срібла в аміаку зв'язана з утворенням аміакатного комплекс}':
AgCl + 2NH3 = [Ag (NH3)2] CI.
Ця сполука являє собою сильний електроліт і добре дисоціює на іони [Ag (NH3)2]"*" і С1—. Отже, комплексним є катіон [Ag (NH3)2]+, який дуже слабко дисоціює. Тому розчинення в цьому випадку зумовлюється сполученням іонів срібла з аміаком за рівнянням
Ag+ + 2NH3=[Ag(NH3)+]. (1)
Константа нестійкості комплексу має такий вигляд:
^Ag(NH)l+='fAg+HNH3i2 =9,3-UH> (2)
[Ag(NH3)2r [Ag(NH3)+] W
Добуток розчинності хлориду срібла
ДРаєсі = [Ag+] [С1~] = 1 • 10-'°. (3)
Рівняння реакції між хлоридом срібла та аміаком можна записати так:
AgCl + 2NH3 ?± [Ag (NH,)+] + СГ. (4)
Константа рівноваги цієї реакції
[Ag (NHa)+) [C1-]
р [ЩР ' (5)
63
Якщо формулу (5) помножити і поділити на величину концентрації іонів срібла [Ag+] і підставити відповідні значення з формул (2) і (3), то
[Ag (NH3)+] [C1-] [Ag+] _ ДРАесі
Кр~ [NH3]2 [Ag+] ^Ag(NH3)j]+
Стан рівноваги реакції (4) зміщується вправо тим більше, чим більша величина розчинності осадів і чим менша константа дисоціації комплексу, тобто чим він стійкіший.
Згідно з рівнянням (4) при розчиненні осаду кількість іонів СГ~ і [Ag (NH3)2]+ буде однакова, тобто [С1~] = [Ag (NH3)2]+. Тоді рівняння (6) можна записати так:
[Ag (NH3)+] [Ag (NH3)+] ДРАеС, 1-Ю-10
К,
p №Р ^Ag(NH8)2]+ 7 • 10-8
= 1,4 • I0~3. (7)
Звідси
[Ag (NH3)+j = У Кр [NH3]2 =
= Vl,4 ■ І0-3 • l2 = 3,7 • ІО-2 (моль/л).
Отже, розчинність AgCl, яка у воді дорівнює 10~~ , у 1 М розчині аміаку зростає до 3,7 • 10-"2, тобто осад практично повністю переходить у розчин.
2. Обчислити розчинність йодиду срібла в умовах, наведених для хлориду срібла. Добуток розчинності йодиду срібла
ДРАї,і =- [Ag+][I-]= 1,7 • 10-16.
Згідно З рівняннями (6) і (7) дістаємо:
*р = |
ДРдеІ __ 1,7- 10-16 П1 |
^[Ag(NH,)s]+ 7-Ю-8 |
|
|
[Ag(NH3)^] = y^p[NH3]2 = |
|
= К 2,4 - ІО-9 • 12 = |
і 7 . іл—І6
10-9. (8)
J4Ag(NH,)s]+ і ■ 10 "
Звідси
= 5-1(3 (моль/л).
Розчинність йодиду срібла значно зросла в присутності 1 М розчину аміаку. Проте знайдена величина показує, що Agl практично повністю залишається в осаді.
Наведені обчислення показують, що за допомогою аміаку як ліганду можна розділити іони хлору і йоду. Ці обчислення обґрунтовують той відомий експериментальний факт, що коли до суміші цнх іонів і аміаку добавити нітрату срібла, то іони хлору залишаються в розчині, а іони йоду випадають в осад у вигляді Agl.
Розчинність осадів внаслідок утворення комплексу з надлишком осаджувана. З якісного аналізу відомо, що є багато таких осадів, які з надлишком осаджувача утворюють розчинні комплексні сполуки. Наприклад, коли до розчинів солей цинку, кобальту, нікелю і срібла добавити еквівалентну кількість ціаніду калію, то катіони перелічених солей осаджуються у вигляді ціанідів. Проте ці осади при дальшому добавлянні осаджувача (KCN) розчиняються внаслідок утворення ціанідних комплексів. Аналогічне
64
явище утворення комплексних сполук спостерігається при взаємодії рода-нідів, йодидів і хлоридів багатьох металів з надлишком осаджувача.
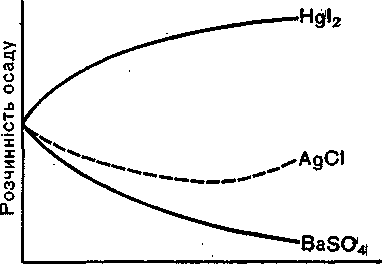
Концентрація осаджувачаї
Рис. 4. Залежність розчинності осадів від надлишку осаджувача.
Відомо багато осадів, розчинність яких при добавлянні невеликого надлишку осаджувача спочатку зменшується. Але із збільшенням концентрації однойменних іонів починається реакція комплексоутворення і розчинність осаду збільшується. Отже, у таких випадках треба мати на увазі, що звичайний метод обчислення розчинності прп надлишку однойменних іонів дає неправильний результат. Правило добутку розчинності грунтується на тому, що із зростанням концентрації однойменних іонів збільшується ймовірність їхніх зустрічей з протилежно зарядженими іонами, за яких іони елемента з'єднуються і переходять в осад. Внаслідок цього процесу концентрація осаджуваних іонів і розчинність осаду зменшуються. При комплексоутворенні концентрація осаджуваних іонів також змент шується, але в результаті цієї реакції розчинність осаду збільшується. Ось чому правило добутку розчинності не можна застосовувати механічно.
Відомі й такі осади, розчинність яких при надлишку осаджувача зменшується.
Отже, існує кілька типів осадів. Залежність розчинності осадів різних типів від концентрації однойменних іонів характеризується кривими (рис. 4), де на осі ординат відкладені значення розчинності осаду, а на осі абсцис — величини концентрації однойменних іонів (узятих в надлишку). Для сполук типу BaSO,, надлишок осаджувача зменшує розчинність осаду. Для сполук типу Hgl2 надлишок спільних іонів (іонів І- або іонів
Hg ') збільшує розчинність осаду в результаті утворення комплексних іонів:
Hgl2 + 21- |
** [Hgi4f- |
Осад |
Комплекс |
|
у розчині |
HgI2+Hg2+ = 2[HgI+].
Криві для осадів типу BaS04 і Hgl2 є крайніми випадками. Більшість осадів, що використовуються в аналізі, за відношенням до надлишку спільних іонів займають проміжне місце. Розчинність цих осадів при добавлянні надлишку однойменних іонів спочатку зменшується. Коли надлишок осаджувача стане досить великим, починає переважати процес утворення комплексних сполук і розчинність осаду збільшується. Прикладом такого типу осадів може бути хлорид срібла. Розчинність хлориду срібла в роз-
3 1-1946 . 65
чинах хлориду натрію різної концентрації характеризується такими даними:
Концентрація хлориду натрію, моль/л 0 0,0039 0,0092 0,036 0,35 0,9 2,9
Розчинність хлориду срібла
[AgCl]-10~5, моль/л 1,3 0,07 0,009 0,19 1,7 10 1000
Наведені дані показують, що розчинність хлориду срібла спочатку зменшується, а із збільшенням концентрації хлориду натрію зростає.
Найменша розчинність AgCl спостерігається при концентрації хлориду натрію 0,0039 моль/л. Потім вона збільшується, і при 0,35 моль/л хлориду натрію розчинність AgCl більша, ніж у чистій воді, а з підвищенням концентрації іонів хлориду зростає ще більше.
З розглянутих вище положень можна зробити такі загальні висновки: при осаджуванні не слід брати дуже великий надлииюк осаджувана. Не можна механічно обчислювати розчинність за правилом добутку розчинності. За цим правилом правильні дані дістають тільки для випадку, коли реакція між іонами дає лише одну нерозчинну сполуку.
