
- •Головне видавництво видавничого об'єднання «вища школа»
- •Передмова
- •Предмет аналітичної хімії
- •Сучасні завдання аналітичної хімії
- •Методи аналітичної хімії
- •§ 1. Закон діючих мас
- •§ 2. Теорія електролітичної дисоціації
- •§ 3. Концентрація водневих іонів води. Поняття про рН
- •§ 4. Концентрація водневих іонів розчинів кислот і основ
- •§ 5. Гідроліз. Концентрація водневих іонів розчинів солей
- •§ 6. Буферні розчини
- •§ 7. Графічний метод обчислення рН розчину
- •§ 9. Добуток розчинності
- •§ 10. Вплив однойменних іонів на розчинність осадів
- •§ 11. Розчинність осадів у кислотах
- •§ 12. Розчинність осадів при утворенні комплексів
- •§ 13. Осади кристалічні і неявнокристалічні (аморфні)
- •§ 14. Колоїдні розчини
- •Розділ 3. Комплексні сполуки
- •§ 15. Загальні положення
- •§ 16. Комплексні сполуки з неорганічними лігандами
- •§ 17. Комплексні сполуки з органічними лігандами
- •§ 18. Застосування комплексних сполук в аналізі
- •§ 19. Органічні реактиви
- •Розділ 4. Реакції окислення-відновлення
- •§ 20. Загальна характеристика
- •§ 21. Окислювально-відновний потенціал
- •§ 22. Властивості окислювально-відновного потенціалу. Рівняння Нернста
- •§ 23. Окислювальний потенціал і напрям реакцій окислення-відновлення
- •§ 24. Індуктивні реакції окислення-відновлення
- •§ 25. Хроматографічний аналіз. Іонообмінники
- •§ 26. Екстракція. Інші методи розділення
- •§ 27. Аналіз у розчині та сухий метод аналізу
- •§ 28. Макро-, мікро- і напівмікроаналіз. Краплинний, безстружковий і мікрокристалоскопічний методи аналізу
- •§ 29. Чутливість і специфічність реакцій
- •§ Зо. Хімічні реактиви
- •§ 31. Концентрація розчинів
- •§ 32. Техніка роботи в лабораторії якісного аналізу
- •§ 33. Дробний і систематичний методи якісного аналізу
- •§ 34. Класифікація катіонів на аналітичні групи
- •Розділ 7. І аналітична група катіонів
- •§ 35. Загальна характеристика групи
- •§ 36. Натрій
- •§ 38. Амоній
- •§ 39. Магній
- •§ 40. Аналіз суміші катіонів і аналітичної групи
- •Розділ 8. II аналітична група катіонів § 41. Загальна характеристика групи
- •§ 43. Стронцій
- •§ 44. Кальцій
- •§ 45. Аналіз суміші катіонів і і II аналітичних груп
- •Розділ 9. Ill аналітична група катіонів § 46. Загальна характеристика групи
- •§ 47. Алюміній
- •§ 48. Хром
- •§ 50. Марганець
- •§ 51. Цинк
- •§ 52. Кобальт
- •§ 53. Нікель
- •§ 54. Аналіз суміші катіонів III аналітичної групи
- •§ 56. Аналіз суміші катіонів III, II і і аналітичних груп, що містить фосфат-іони
- •Розділ 10. IV аналітична група катіонів
- •§ 57. Загальна характеристика групи
- •Підгрупа срібла
- •§ 59. Свинець
- •§ 60. Ртуть (і)
- •§ 61. Аналіз суміші катіонів підгрупи срібла
- •IV аналітичної групи
- •Підгрупа міді
- •§ 62. Ртуть (II)
- •§ 64. Кадмій
- •§ 65. Вісмут
- •§ 66. Аналіз суміші катіонів IV—і аналітичних груп
- •Розділ 11. V аналітична група катіонів § 67. Загальна характеристика групи
- •§ 69. Сурма
- •§ 70. Олово
- •§ 71. Аналіз суміші катіонів IV і V аналітичних груп
- •Розділ 12. Аналіз рідкісних елементів § 72. Загальна характеристика
- •§ 73. Титан
- •§ 74. Ванадій
- •§ 75. Молібден
- •§ 76. Вольфрам
- •§ 78. Безсірководневі методи якісного аналізу катіонів
- •Розділ 13. Аналіз аніонів § 79. Класифікація аніонів
- •І група аніонів
- •§ 86. Кремнієва кислота і реакції силікат-іонів SiO|—
- •II група аніонів
- •§ 91. Йодистоводнева кислота і реакції йодид-іонів і
- •§ 92. Сірководнева кислота і реакції сульфід-іонів s2-
- •Ill група аніонів
- •§ 94. Азотна кислота і реакції нітрат-іонів імог
- •§ 95. Азотиста кислота і реакції нітрит-іонів n02
- •§ 96. Оцтова кислота і реакції ацетат-іонів сн3соо
- •§ 97. Хлорнувата кислота і реакції гіпохлорат-іонів сюг
- •§ 98. Аналіз суміші аніонів і—III аналітичних груп
- •§ 100. Розчинення речовини і виявлення катіонів
- •§ 101. Виявлення аніонів
- •§ 102. Аналіз металів і сплавів
- •§ 103. Предмет і значення кількісного аналізу
- •§ 104. Визначення основних компонентів і визначення домішок
- •§ 105. Класифікація хімічних методів кількісного аналізу
- •І. Гравіметричий аналіз1
- •§ 106. Суть методу
- •§ 107. Вимоги до осадів у гравіметричному аналізі
- •§ 108. Співосадження
- •§ 109. Умови осадження
- •§ 110. Відокремлення осаду від маточного розчину
- •§ 111. Переведення осаду у вагову форму
- •§ 112. Принцип дії аналітичних терезів
- •§ 113. Правила користування аналітичними терезами і зважування на них
- •Розділ 18. Приклади гравіметричних визначень
- •§ 114. Розрахунки у гравіметричному аналізі
- •0,3115 Г становить 100%;
- •0,5025 Г становить 100%; 0,0874 г » х%,
- •§ 115. Визначення заліза у вигляді оксиду
- •§ 116. Визначення сульфатів у вигляді сульфату барію
- •§ 117. Розділення і визначення кальцію і магнію
- •§ 118. Визначення нікелю в сталях
- •II. Титриметричний аналіз Розділ 19. Загальні положення титриметричного аналізу
- •§ 119. Суть методу
- •§ 120. Концентрація розчинів і розрахунки в титриметричному аналізі
- •§ 121. Приготування робочих розчинів
- •§ 122. Методи непрямого титрування
- •§ 123. Точка еквівалентності
- •§ 124. Установлення точки еквівалентності за допомогою індикаторів
- •§ 125. Мірний посуд
- •§ 126. Перевірка мірного посуду
- •§ 127. Титрування кислотами та основами
- •§ 128. Індикатори методу кислотно-основного титрування (методу нейтралізації)
- •§ 129. Вибір індикаторів при титруванні кислотами та основами
- •§ 130. Криві титрування
- •§ 131. Помилки титрування
- •2NaHc03 ї± н20 -f- c02 -f Na2c03.
- •§ 132. Робочі розчини методу кислотно-основного титрування
- •§ 133. Приклади застосування методу кислотно-основного титрування (методу нейтралізації)
- •§ 134. Криві титрування
- •§ 135. Індикатори методів окислення-відновлення
- •§ 136. Еквівалент у реакціях окислення-відновлення
- •Розділ 22. Перманганатометрія
- •§ 137. Загальна характеристика методу. Приготування робочого розчину перманганату калію
- •§ 138. Визначення заліза
- •§ 139. Визначення пероксиду водню
- •§ 140. Визначення нітритів
- •Розділ 23. Йодометрія
- •§ 141. Загальна характеристика методу
- •§ 142. Приготування робочих титрованих розчинів
- •§ 143. Йодометричне визначення міді
- •§ 144. Йодометричне визначення активного хлору в хлорному вапні
- •B/r. WNa,s203l/NaliS!03јCl " 10°
- •§ 145. Йодометричне визначення сірки
- •Розділ 24. Метод осадження § 146. Загальна характеристика методу
- •§ 147. Індикатори
- •§ 148. Помилки титрування в методі осадження
- •§ 149. Робочі розчини і вихідні речовини методу осадження
- •§ 150. Визначення галогенід-іонів
- •Розділ 25. Методи комплексоутворення
- •§ 151. Загальні положення методів комплексоутворення
- •§ 152. Меркуриметричне визначення хлоридів
- •§ 153. Комплексонометричне визначення твердості води
- •III. Спектрофотометричний і колориметричний методи аналізу Розділ 26. Загальні положення
- •§ 154. Суть методів
- •§ 155. Загальні умови колориметричного визначення
- •§ 156. Закон Бугера—Ламберта—Бера
- •§ 157. Методи вимірювання інтенсивності забарвлення
- •§ 159. Визначення міді в грунтах
- •§ 160. Загальні положення
- •§ 161. Наближене визначення рН
- •§ 162. Безбуферні методи визначення рН
- •§ 163. Буферний метод визначення рН
- •IV. Аналіз різних матеріалів Розділ 29. Аналіз продуктів харчування § 164. Визначення кислотності хліба і молока
- •§ 165. Аналіз грунту і води
- •§ 166. Визначення оксидів кальцію і магнію в доломіті
- •Розділ 31. Аналіз добрив
- •§ 167. Визначення фосфору в суперфосфаті
- •§ 168. Визначення калію в калійних добривах
- •§ 169. Визначення азоту в аміачних добривах
- •Додатки
- •Кислоти
- •Густина розчинів їдких калі і натру
§ 155. Загальні умови колориметричного визначення
Щоб провести колориметричне визначення, треба визначувані іони перевести в забарвлену сполуку, а потім виміряти інтенсивність забарвлення (оптичну густину) утвореного розчину. Техніка вимірювання оптичної густини розчинів тепер досить досконала. Промисловість випускає багато приладів, які дають можливість вимірювати оптичну густину розчину з точністю до 0,05—1 відносного процента. Таким чином, головне завдання хіміка-аналітика полягає у виборі найбільш придатного реактиву для колориметричного визначення і в створенні сприятливих умов для повного переведення визначуваного компонента в забарвлену сполуку. При виборі реактивів треба враховувати такі характеристики: величину хімічного споріднення між іонами, які реагують, сталість складу забарвлених сполук, спектр поглинання й інтенсивність забарвлення, віднесену до 1 моль речовини.
479
Величина хімічного споріднення речовин. У колориметричному аналізі застосовують головним чином забарвлені комплексні сполуки. Тому величину хімічного споріднення між іонами, які взаємодіють, можна характеризувати константою нестійкості або константою стійкості (див. розділ 3) комплексу. Чим більша константа нестійкості комплексу, тим менш стійкий комплекс, і, навпаки, мале значення константи характеризує велику енергію споріднення між компонентами. Велика енергія споріднення між визначуваними іонами і іонами реактиву зумовлює перехід визначуваних іонів в комплексну сполуку без надлишку реактиву. Навпаки, мала енергія зв'язку між іонами потребує великого надлишку реактиву для повного зв'язування визначуваного компонента в комплекс.
Пояснимо це на прикладі роданідного і саліцилатного комплексів заліза. Так, при взаємодії іонів заліза (III) з іонами родану утворюються комплексні іони:
Fe3+ + SCN- <=> FeSCN2+.
Ці забарвлені у червоний колір іони здатні дисоціювати за такою схемою:
FeSCN2+ т± Fe3+ + SCN-. (1)
Згідно з законом діючих мас константу рівноваги цієї реакції можна подати такою формулою:
_ [Fe3+][SCN~] з (2)
*F*CN*+- [FeSCN2+] ==5-10 • (2)
Ця константа залежить лише від температури і називається константою нестійкості комплексі/ (в цьому разі константою нестійкості монороданідного комплексу заліза).
Припустимо, що визначувана концентрація іонів заліза дорівнює 10~4 моль/л, а концентрація реактиву (роданіду калію) дорівнює 0,1 моль/л. За цими даними та за величиною константи нестійкості комплексу легко обчислити, яка частина іонів заліза переведена в роданідний комплекс1:
[Fe3+]0,1 5 10-3 АРе5С№+- [FeSCN2+] Звідси
[Fe3+] = 5- 10-2 [FeSCN2+],
тобто 95% заліза перебуває у вигляді монороданідних іонів, а 5% — у вигляді вільних іонів заліза 2.
Таким чииом, залізо не повністю переведене в монороданідний комплекс навіть стократним надлишком реактиву, внаслідок чого може бути помилка при колориметричному його визначенні. Нижче буде показано, як треба вести визначення, щоб забезпечити максимальну точність.
Знаючи константу нестійкості комплексу, можна обчислити, який треба взяти надлишок реактиву, щоб визначувані іони практично повністю перевести в забарвлену сполуку.
При колориметричних визначеннях допускають помилку величиною 1%. Обчислимо, яку треба взяти концентрацію роданіду, щоб залізо практично повністю перевести в монорода-
1 Насправді розрахунок буде складніший, тому що залізо з роданідом утворює ряд комплексів: Fe (SCN)2+, Fe(SCN)+, Fe (SCN)3, Fe (SCN)~, Fe (SCN)2~, Fe (SCN)3~ які у розчині перебувають у рівновазі; для простоти розрахунку взято до уваги утворення лише найстійкішого монороданідного комплексу заліза.
2 Насправді вільних іонів заліза в розчині немає, а є гідратовані іони.
480
нідннії комплекс. У нашому прикладі початкова концентрація іонів заліза 10 * моль/л. Після добавляння реактиву концентрація їх становитиме 10~' • 1/100= 10"~6 моль/л; концентрація іонів монороданіду заліза дорівнюватиме І0~4 моль/л — \0~~6 моль/л да яг 10~4 моль/л. Підставляючи ці значення у вираз для константи нестійкості монороданід-ного комплексу заліза, матимемо
_ [Fe2+] [SCN-] 10-6[SCN~1 _ з
AFeSCN2+ [FeSCN2+] 10-4 '
Звідси [SCN—] = 5 • 10 = 0,5моль/л. Отже, щоб практично повністю перевести залізо в монороданідний комплекс, треба взятн досить великий надлишок реактиву. Залізо можна визначити також у вигляді саліцилатного комплексу:
О
~^€
Fe3++C6H4( _^ І II
соо ^Ч/^о'
/О— Для спрощення іони саліцилату СвН4 далі позначатимемо через Sal2
\С—О—
II О
Комплексні іони FeSal"'" незначною мірою також дисоціюють на іони:
FeSal+ <± Fe3+ + Sal2".
Константа рівноваги цієї реакції буде така:
[Fe^+] [Sal^-] = 4 > 10_17_ (4)
гг
FeSai+ [FeSal+]
Розрахуємо, який треба взяти надлишок іонів саліцилату, щоб 99% заліза перевести в саліцилатний комплекс. Беручи до уваги попередні умови, напишемо рівняння (4) в такому вигляді:
10-6[Sal2-] I7
*FeSal+ ^ -410 '
звідки
[Sal2-]
=
*•
'0 "•
'О""4
=
4
. іо-15
(моль/л).
10-6
Таким чином, щоб залізо практично повністю перевести в забарвлений комплекс, треба взяти надлишок саліцилату в 0,5/4 • 10-15= 1,25 • 1014 раз менший порівняно з надлишком іонів роданіду.
Енергія споріднення між визначуваними іонами та іонами реактиву має також велике значення для колориметричних реакцій, які грунтуються на руйнуванні забарвлених сполук. Як приклад цього типу реакцій розглянемо колориметричне визначення фториду. Фторид утворює стійкі комплекси з багатьма катіонами. Проте всі вони в розчинах безбарвні і не можуть бути застосовані в колориметрії. Тому для колориметричного визначення фтори-
16 і-і9« 481
дів використовують реакції, в яких фторид зв'язує катіон забарвленої комплексної сполуки, внаслідок чого інтенсивність забарвлення розчину зменшується. Так, наприклад, при дії фториду на жовтий розчин пероксидновод-невого комплексу титану реакція відбувається за таким рівнянням:
ТіО (Н2о2)2+ + F- ?± TiOF+ + Н2о2.
Внаслідок такої реакції інтенсивність жовтого забарвлення розчину зменшується пропорційно концентрації фторидів. Тому, вимірявши інтенсивність забарвлення до і після добавляння фториду, можна знайти його вміст. Реакції такого типу використовують для визначення не лише фторидів, а й сульфатів, фосфатів і деяких інших іонів.
Для застосування цього типу реакцій у колориметрії треба, щоб стійкість фторидного комплексу була більша від стійкості забарвленого комплексу, тобто
Kmr > KMFn>
Де Л'лія — константа нестійкості забарвленого комплексу; Kmf — константа нестійкості фторидного комплексу.
З наведених прикладів видно, яке важливе значення має величина константи нестійкості комплексу; вона дає змогу розрахувати концентрацію реактивів і оцінити точність методу.
Сталість складу забарвлених сполук. Для колориметричного аналізу, як і для гравіметричного, треба, щоб продукт реакції мав певний склад, тобто відповідав певній хімічній формулі. Зміна складу забарвлених сполук, які застосовуються в колориметрії, може відбуватись внаслідок багатьох причин. Головні з них — це ступінчастий характер утворення забарвлених сполук і нестійкість забарвленої сполуки в часі. Перше можна пояснити на прикладі утворення роданіду заліза. Вище було сказано, що при взаємодії іонів заліза (III) і роданіду може утворюватись ряд комплексів від FeSCN до Fe (SCN)i5~. Кожний з цих комплексів має відмінний від інших колір. У розглядуваному випадку розчини комплексів з більшим числом лігандів забарвлені інтенсивніше, ніж розчини комплексів з меншим координаційним числом. Тому інтенсивність забарвлення розчину залежить від співвідношення концентрації комплексів різного складу. Отже, у таких випадках при колориметричних визначеннях треба так вести процес, щоб у стандартному і в досліджуваному розчинах утворювались комплекси однакового складу.
Склад забарвленої сполуки може змінюватись також з часом. Зміна складу з часом зумовлюється розкладанням забарвленої сполуки під впливом світла в результаті реакцій окпслення-відиовлення та інших причин. Так, при взаємодії іонів заліза (III) і роданіду утворюється забарвлена сполука роданіду заліза, але разом з цим між іонами заліза і роданідом може відбуватись і процес окнслепия-відновлення. У цьому процесі залізо (III) відіграє роль окислювача, а родаиід — відновника. Залізо при цьому відновлюється до заліза (II), а родапід окислюється до різних форм: вільного родану та
* Значок > означає: значно більше.
482
інших продуктів, аж до сульфату. Тому розчин роданіду заліза з часом зне-барвнюється.
Спектр поглинання. Забарвлені розчини нерівномірно поглинають світло різної довжини хвилі, від чого й залежить їх колір. Для повної характеристики кольору розчину користуються спектрами поглинання, або, інакше кажучи, кривими світлопоглинання (кривими абсорбції). Криві світлопогли-нання характеризують розподіл поглинальної здатності розчину залежно від довжини хвилі. Для побудови таких кривих вимірюють оптичну густину
5-Ю4 ^^
4.0- • / ■ \ / \
з,о-- / \ І \
1 =—h-^— 1 1 —^—=—
350 300 350 400 450 Л,нм
Рис. 46. Крива світлопоглинання розчину К2СгС>4.
розчину при різних довжинах хвиль, тобто при освітленні розчину світлом з різною довжиною хвилі, і на осі абсцис відкладають довжину хвилі в на-нометрах (нм), а на осі ординат — оптичну густину розчину, або молярний коефіцієнт поглинання. На рис. 46 наведено криві світлопоглинання розчину хромату калію, а на рис. 47 — водно-ацетонового розчину роданідного комплексу кобальту.
З цих рисунків видно, що розчин хромату найбільше поглинає в ультрафіолетовій частині спектра, а розчин роданідного комплексу кобальту — при довжині хвилі 600 нм. Таким чином, при колориметричному визначенні хрому у вигляді хромату оптичну густину розчину треба вимірювати при 400 нм, а при визначенні кобальту у вигляді роданідного комплексу — при 600 нм.
Отже, знаючи спектр поглинання, можна вибрати максимально чутливу довжину хвилі для вимірювання оптичної густини розчину. Для колориметричного аналізу має велике значення також ширина половини максимумів спектра поглинання (рис. 48). Вузький спектр поглинання розчину значно кращий для колориметриного визначення, тому що в такому випадку часто можна вимірювати оптичну густину розчину цієї речовини навіть у присутності інших забарвлених сполук.
Крім ширини спектра поглинання, у колориметрії велике значення має інтенсивність поглинання розчину, віднесена до одного моль речовини, або так званий молярний коефіцієнт поглинання. Молярним коефіцієнтом
16*
483
поглинання називають оптичну густину одномолярного розчину при товщині шару 1 см.
Чутливість колориметричного методу пропорційна величині молярного коефіцієнта поглинання, подібно до того, як у гравіметричному аналізі відносна точність зважування пропорційна молекулярній масі вагової форми. Правда, молекулярна маса речовин, які застосовуються у граві-
метричному аналізі, може відрізнятися в десятки разів, а молярний коефіцієнт поглинання речовин, які використовуються в колориметрії, — у сотні і тисячі разів. Тому в колориметричному аналізі є більші можливості вибрати кращий реактив, ніж у гравіметричному.
\MSCN~
Г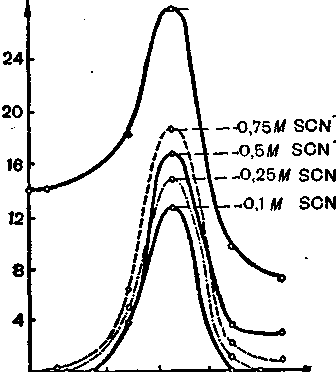 'іо3
'іо3
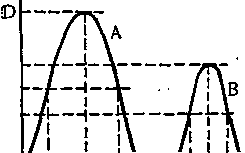
.
Мі) 11
\ і
І
) і
І
1 \ Х.НМ
500 550 600 650 700Х,нм
400/450/500X550,600* \650 1~макс Хмакс ^макс Цмакс ХмаксЙмакс
Рис. 47. Крива світлопоглинання водно-ацетонового розчину роданідного комплексу кобальту.
Рис. 48. Спектр поглинання розчинів речовин А і В.
