
- •Головне видавництво видавничого об'єднання «вища школа»
- •Передмова
- •Предмет аналітичної хімії
- •Сучасні завдання аналітичної хімії
- •Методи аналітичної хімії
- •§ 1. Закон діючих мас
- •§ 2. Теорія електролітичної дисоціації
- •§ 3. Концентрація водневих іонів води. Поняття про рН
- •§ 4. Концентрація водневих іонів розчинів кислот і основ
- •§ 5. Гідроліз. Концентрація водневих іонів розчинів солей
- •§ 6. Буферні розчини
- •§ 7. Графічний метод обчислення рН розчину
- •§ 9. Добуток розчинності
- •§ 10. Вплив однойменних іонів на розчинність осадів
- •§ 11. Розчинність осадів у кислотах
- •§ 12. Розчинність осадів при утворенні комплексів
- •§ 13. Осади кристалічні і неявнокристалічні (аморфні)
- •§ 14. Колоїдні розчини
- •Розділ 3. Комплексні сполуки
- •§ 15. Загальні положення
- •§ 16. Комплексні сполуки з неорганічними лігандами
- •§ 17. Комплексні сполуки з органічними лігандами
- •§ 18. Застосування комплексних сполук в аналізі
- •§ 19. Органічні реактиви
- •Розділ 4. Реакції окислення-відновлення
- •§ 20. Загальна характеристика
- •§ 21. Окислювально-відновний потенціал
- •§ 22. Властивості окислювально-відновного потенціалу. Рівняння Нернста
- •§ 23. Окислювальний потенціал і напрям реакцій окислення-відновлення
- •§ 24. Індуктивні реакції окислення-відновлення
- •§ 25. Хроматографічний аналіз. Іонообмінники
- •§ 26. Екстракція. Інші методи розділення
- •§ 27. Аналіз у розчині та сухий метод аналізу
- •§ 28. Макро-, мікро- і напівмікроаналіз. Краплинний, безстружковий і мікрокристалоскопічний методи аналізу
- •§ 29. Чутливість і специфічність реакцій
- •§ Зо. Хімічні реактиви
- •§ 31. Концентрація розчинів
- •§ 32. Техніка роботи в лабораторії якісного аналізу
- •§ 33. Дробний і систематичний методи якісного аналізу
- •§ 34. Класифікація катіонів на аналітичні групи
- •Розділ 7. І аналітична група катіонів
- •§ 35. Загальна характеристика групи
- •§ 36. Натрій
- •§ 38. Амоній
- •§ 39. Магній
- •§ 40. Аналіз суміші катіонів і аналітичної групи
- •Розділ 8. II аналітична група катіонів § 41. Загальна характеристика групи
- •§ 43. Стронцій
- •§ 44. Кальцій
- •§ 45. Аналіз суміші катіонів і і II аналітичних груп
- •Розділ 9. Ill аналітична група катіонів § 46. Загальна характеристика групи
- •§ 47. Алюміній
- •§ 48. Хром
- •§ 50. Марганець
- •§ 51. Цинк
- •§ 52. Кобальт
- •§ 53. Нікель
- •§ 54. Аналіз суміші катіонів III аналітичної групи
- •§ 56. Аналіз суміші катіонів III, II і і аналітичних груп, що містить фосфат-іони
- •Розділ 10. IV аналітична група катіонів
- •§ 57. Загальна характеристика групи
- •Підгрупа срібла
- •§ 59. Свинець
- •§ 60. Ртуть (і)
- •§ 61. Аналіз суміші катіонів підгрупи срібла
- •IV аналітичної групи
- •Підгрупа міді
- •§ 62. Ртуть (II)
- •§ 64. Кадмій
- •§ 65. Вісмут
- •§ 66. Аналіз суміші катіонів IV—і аналітичних груп
- •Розділ 11. V аналітична група катіонів § 67. Загальна характеристика групи
- •§ 69. Сурма
- •§ 70. Олово
- •§ 71. Аналіз суміші катіонів IV і V аналітичних груп
- •Розділ 12. Аналіз рідкісних елементів § 72. Загальна характеристика
- •§ 73. Титан
- •§ 74. Ванадій
- •§ 75. Молібден
- •§ 76. Вольфрам
- •§ 78. Безсірководневі методи якісного аналізу катіонів
- •Розділ 13. Аналіз аніонів § 79. Класифікація аніонів
- •І група аніонів
- •§ 86. Кремнієва кислота і реакції силікат-іонів SiO|—
- •II група аніонів
- •§ 91. Йодистоводнева кислота і реакції йодид-іонів і
- •§ 92. Сірководнева кислота і реакції сульфід-іонів s2-
- •Ill група аніонів
- •§ 94. Азотна кислота і реакції нітрат-іонів імог
- •§ 95. Азотиста кислота і реакції нітрит-іонів n02
- •§ 96. Оцтова кислота і реакції ацетат-іонів сн3соо
- •§ 97. Хлорнувата кислота і реакції гіпохлорат-іонів сюг
- •§ 98. Аналіз суміші аніонів і—III аналітичних груп
- •§ 100. Розчинення речовини і виявлення катіонів
- •§ 101. Виявлення аніонів
- •§ 102. Аналіз металів і сплавів
- •§ 103. Предмет і значення кількісного аналізу
- •§ 104. Визначення основних компонентів і визначення домішок
- •§ 105. Класифікація хімічних методів кількісного аналізу
- •І. Гравіметричий аналіз1
- •§ 106. Суть методу
- •§ 107. Вимоги до осадів у гравіметричному аналізі
- •§ 108. Співосадження
- •§ 109. Умови осадження
- •§ 110. Відокремлення осаду від маточного розчину
- •§ 111. Переведення осаду у вагову форму
- •§ 112. Принцип дії аналітичних терезів
- •§ 113. Правила користування аналітичними терезами і зважування на них
- •Розділ 18. Приклади гравіметричних визначень
- •§ 114. Розрахунки у гравіметричному аналізі
- •0,3115 Г становить 100%;
- •0,5025 Г становить 100%; 0,0874 г » х%,
- •§ 115. Визначення заліза у вигляді оксиду
- •§ 116. Визначення сульфатів у вигляді сульфату барію
- •§ 117. Розділення і визначення кальцію і магнію
- •§ 118. Визначення нікелю в сталях
- •II. Титриметричний аналіз Розділ 19. Загальні положення титриметричного аналізу
- •§ 119. Суть методу
- •§ 120. Концентрація розчинів і розрахунки в титриметричному аналізі
- •§ 121. Приготування робочих розчинів
- •§ 122. Методи непрямого титрування
- •§ 123. Точка еквівалентності
- •§ 124. Установлення точки еквівалентності за допомогою індикаторів
- •§ 125. Мірний посуд
- •§ 126. Перевірка мірного посуду
- •§ 127. Титрування кислотами та основами
- •§ 128. Індикатори методу кислотно-основного титрування (методу нейтралізації)
- •§ 129. Вибір індикаторів при титруванні кислотами та основами
- •§ 130. Криві титрування
- •§ 131. Помилки титрування
- •2NaHc03 ї± н20 -f- c02 -f Na2c03.
- •§ 132. Робочі розчини методу кислотно-основного титрування
- •§ 133. Приклади застосування методу кислотно-основного титрування (методу нейтралізації)
- •§ 134. Криві титрування
- •§ 135. Індикатори методів окислення-відновлення
- •§ 136. Еквівалент у реакціях окислення-відновлення
- •Розділ 22. Перманганатометрія
- •§ 137. Загальна характеристика методу. Приготування робочого розчину перманганату калію
- •§ 138. Визначення заліза
- •§ 139. Визначення пероксиду водню
- •§ 140. Визначення нітритів
- •Розділ 23. Йодометрія
- •§ 141. Загальна характеристика методу
- •§ 142. Приготування робочих титрованих розчинів
- •§ 143. Йодометричне визначення міді
- •§ 144. Йодометричне визначення активного хлору в хлорному вапні
- •B/r. WNa,s203l/NaliS!03јCl " 10°
- •§ 145. Йодометричне визначення сірки
- •Розділ 24. Метод осадження § 146. Загальна характеристика методу
- •§ 147. Індикатори
- •§ 148. Помилки титрування в методі осадження
- •§ 149. Робочі розчини і вихідні речовини методу осадження
- •§ 150. Визначення галогенід-іонів
- •Розділ 25. Методи комплексоутворення
- •§ 151. Загальні положення методів комплексоутворення
- •§ 152. Меркуриметричне визначення хлоридів
- •§ 153. Комплексонометричне визначення твердості води
- •III. Спектрофотометричний і колориметричний методи аналізу Розділ 26. Загальні положення
- •§ 154. Суть методів
- •§ 155. Загальні умови колориметричного визначення
- •§ 156. Закон Бугера—Ламберта—Бера
- •§ 157. Методи вимірювання інтенсивності забарвлення
- •§ 159. Визначення міді в грунтах
- •§ 160. Загальні положення
- •§ 161. Наближене визначення рН
- •§ 162. Безбуферні методи визначення рН
- •§ 163. Буферний метод визначення рН
- •IV. Аналіз різних матеріалів Розділ 29. Аналіз продуктів харчування § 164. Визначення кислотності хліба і молока
- •§ 165. Аналіз грунту і води
- •§ 166. Визначення оксидів кальцію і магнію в доломіті
- •Розділ 31. Аналіз добрив
- •§ 167. Визначення фосфору в суперфосфаті
- •§ 168. Визначення калію в калійних добривах
- •§ 169. Визначення азоту в аміачних добривах
- •Додатки
- •Кислоти
- •Густина розчинів їдких калі і натру
§ 130. Криві титрування
Точність титрування зумовлена не тільки відповідністю між величинами рТ індикатора і рН точки еквівалентності, а й характером зміни рН розчину біля точки еквівалентності. Різка зміна рН біля точки еквівалентності при-ззодить до значної зміни співвідношення концентрації молекулярної та іонної форм індикатора і, отже, до чіткої зміни забарвлення. Для загальної характеристики зміни рН біля точки еквівалентності розглянемо криві титрування. Криві титрування являють собою графічне зображення зміни рН розчину в процесі титрування. Для простоти розрахунків припустимо, що в усіх випадках об'єм 0,1 н. розчину при титруванні не змінюється і дорівнює 100 мл.
Перед тим як накреслити криву титрування, треба скласти таблицю, яка характеризувала б послідовний хід титрування.
Титрування сильної кислоти сильною основою. При взаємодії сильної кислоти і лугу утворюється сіль, розчин якої має нейтральну реакцію (рН = = 7). Для розрахунку рН у процесі титрування, поки не досягнуто точки еквівалентності, треба враховувати концентрацію розчину невідтнтрова-ної сильної кислоти, а після точки еквівалентності — концентрацію розчину сильної основи, яку добавлено в надлишку.
В табл. 27 подано значення рН розчину при титруванні сильної кислоти лугом.
За даними табл. 27 і рис. 39 побудовано криву титрування. З цього рисунка видно, що при титруванні сильної кислоти сильною основою (або
412
навпаки) біля точки еквівалентності спостерігається різка зміна рН розчину. Припустимо, що для титрування взято індикатор з рГ =^ 4. Тоді, як видно з табл. 27, розчин буденедотитровано на 0,1%. Якщо ж узяти індикатор з рГ = 10, то розчин буде перетитровано на 0,1%. Отже, хоч різниця між рН розчину точки еквівалентності і рТ індикатора і велика (7—4 і Ю—7), проте помилка титрування в обох цих випадках цілком допустима.
Таблиця 27. Зміна рН розчину при
титруванні 0,1 н. розчину
соляної кислоти 0,1 н. розчином лугу
Відтнтровано кислоти, % |
гн+j |
рН |
0 |
0,1 |
1 |
10 |
0,09 |
1,05 |
20 |
0,08 |
1,10 |
ЗО |
0,07 |
1,15 |
40 |
0,06 |
1,22 |
50 |
0 05 |
1,30 |
60 |
0,04 |
1,40 |
70 |
0,03 |
1,53 |
80 |
0,02 |
1,70 |
90 |
0,01 |
2 |
99 |
10_3 |
3 |
99,9 |
10~4 |
4 |
99,99 |
10~5 |
5 |
99,999 |
ю-6 |
6 |
100,000 |
ю-7 |
7 |
100,001 |
10~8 |
8 |
100,01 |
ю-9 |
9 |
100,1 |
,0-ю |
10 |
101 |
Ю-" |
11 |
по |
ю-12 |
12 |
Тому ирп титруванні сильної кислоти сильною основою можна користуватися сильними або слабкими індикаторами, а також індикаторами проміжної сили, рп
1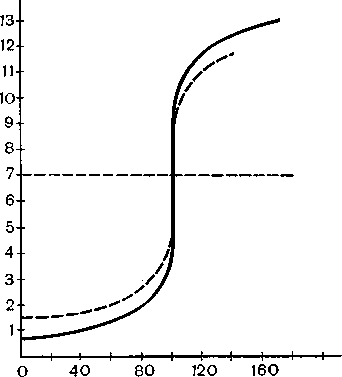 4--
4--
•0,1 н.НС1 „^—0,01 н. НСІ
200 мл NaOH
Рис. 39. Крива титрування 0,1 н. розчину соляної кислоти 0,1 н. розчином лугу.
Титрування слабкої кислоти лугом. При взаємодії слабкої кислоти з лугом у точці еквівалентності утворюється сіль слабкої кислоти і сильної основи. До точки еквівалентності в розчині є суміш слабкої кислоти і солі цієї кислоти, тобто буферна суміш. Тому в цих умовах обчислювати рН треба за формулою для обчислення рН розчину буферної суміші. У точці еквівалентності обчислюють рН розчину солі сильної основи і слабкої кислоти. При добавлянні лугу після точки еквівалентності в розчині буде надлишок лугу. У цьому разі обчислюють рН надлишку сильної основи.
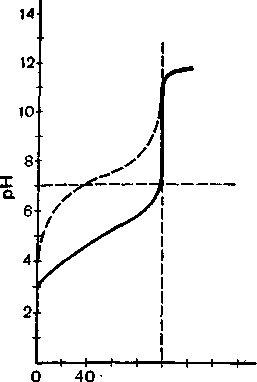
У табл. 28 подано значення рН розчину в процесі титрування слИбкої кислоти сильною основою. На підставі цих даних побудована крива титрування (рис. 40). Характер кривої титрування показує, що при титруванні немає різкої зміни рН біля точки еквівалентності. Отже, розбіжність між рН розчину точки еквівалентності і рТ індикатора повинна бути мінімальною.
413
Припустимо, що в цьому разі, як і у випадку титрування сильної кислоти сильною основою, рГ індикатора відрізняється від рН точки еквівалентності на 3 одиниці, тобто рГшД = 8,87 — 3 — 5,87. З табл. 28 видно, що рН розчину в точці еквівалентності дорівнює 8,87 і що помилка титрування за цих умов становить близько 10%. Таким чином, при тій самій різниці між рН розчину точки еквівалентності і рТ індикатора помилка титрування
Таблиця 28. Зміна рН розчину при Таблиця 29. Зміна рН розчину при
титруванні 0,1 н. розчину оцтової титруванні 0,1 н. розчину оцтової
кислоти 0,1 н. розчином лугу кислоти 0,1 и. розчином гідроксиду амонію
Відтнт- |
рН роз- |
|
ровано кислоти. |
Формула для обчислення рН |
|
% |
чину |
|
0 |
2,87 |
Рн= -LpK—i-igcK |
10 |
3,8 |
рн = Рк + ig -% |
20 |
4,15 |
Те саме |
ЗО |
4,37 |
» » |
40 |
4,57 |
» » |
50 |
4,75 |
» » |
60 |
4,93 |
» » |
70 |
5,12 |
» » |
80 |
5,35 |
» » |
90 |
5,70 |
» » |
99,0 |
6,75 |
» » |
99,9 |
7,75 |
PH = pK-flg Сс- 1"к |
100 |
8,87 |
pH = 7 + ±-pK+-^-\gCc |
100,01 |
9 |
рН= 14 — рОН= 14-f~lgC0 |
100,1 |
10 |
Те саме |
101 |
11 |
» » |
ПО |
12 |
» » |
Відтит- |
|
|
ровано кислоти, |
рН |
Формула для обчислення рН |
% |
|
|
0 |
2,87 |
РН = -і-рК ^-lgCK |
10 |
3,8 |
рН = рК + Ig -% |
20 |
4,15 |
Те саме |
ЗО |
4,37 |
» 3 |
40 |
4,57 |
» » |
50 |
4,75 |
» » |
60 |
4,93 |
» » |
70 |
5,12 |
» » |
80 |
5,35 |
» » |
90 |
5,70 |
» » |
99,0 |
6,75 |
» » |
100 |
7 |
рН = 7 + -±-рК,~-^рК0 |
101 |
7,25 |
рН= 14 —р/Со + Ig-^- |
по |
7,25 |
Те саме |
120 |
8,65 |
» » |
різних систем буде різною. У випадку титрування сильної кислоти лугом (і навпаки) ця помилка допустима, а при титруванні слабкої кислоти сильною основою помилка недопустима. Аналогічно можна показати, що при титруванні слабкої основи сильною кислотою (або навпаки) рГ індикатора також повинен наближатись до рН розчину точки еквівалентності.
Титрування слабкої кислоти слабкою основою. У процесі титрування слабкої кислоти слабкою основою утворюється буферна суміш. До точки еквівалентності буферна суміш складається із слабкої кислоти і її солі, а після точки еквівалентності — із слабкої основи і її солі. У табл. 29 наведено результати обчислення зміни рН у процесі титрування 0,1 н. розчину оцтової кислоти 0,1 н. розчином гідроксиду амонію.
414
40
60 80 100 120 140 Добавлено
мл
0,1 h.NH4OH
Рис.
41.
Крива титрування 0,1 н. розчину оцтової
кислоти 0,1 н. розчином NH4OH.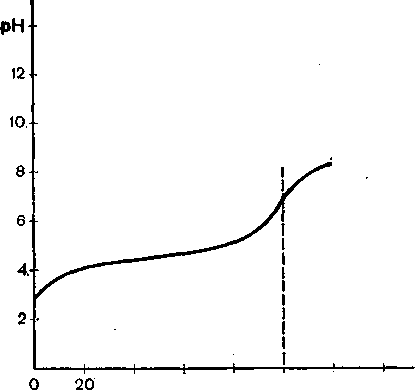
160мл
80 120 NaOH
Рис. 40. Крива титрування 0,1 н. розчину оцтової кислоти 0,1 н. розчином лугу; пунктирна — теж саме, але взяті 0,01 н. розчині.
Дані табл. 29 нанесено на графік (рис. 41), з якого видно, що при зміні рН біля точки еквівалентності на ±1 кислота недотитрована приблизно на 10% і потім перетитрована також приблизно на 10%. Таким чином, від-титрувати слабку кислоту слабкою основою практично неможливо.
