
- •Головне видавництво видавничого об'єднання «вища школа»
- •Передмова
- •Предмет аналітичної хімії
- •Сучасні завдання аналітичної хімії
- •Методи аналітичної хімії
- •§ 1. Закон діючих мас
- •§ 2. Теорія електролітичної дисоціації
- •§ 3. Концентрація водневих іонів води. Поняття про рН
- •§ 4. Концентрація водневих іонів розчинів кислот і основ
- •§ 5. Гідроліз. Концентрація водневих іонів розчинів солей
- •§ 6. Буферні розчини
- •§ 7. Графічний метод обчислення рН розчину
- •§ 9. Добуток розчинності
- •§ 10. Вплив однойменних іонів на розчинність осадів
- •§ 11. Розчинність осадів у кислотах
- •§ 12. Розчинність осадів при утворенні комплексів
- •§ 13. Осади кристалічні і неявнокристалічні (аморфні)
- •§ 14. Колоїдні розчини
- •Розділ 3. Комплексні сполуки
- •§ 15. Загальні положення
- •§ 16. Комплексні сполуки з неорганічними лігандами
- •§ 17. Комплексні сполуки з органічними лігандами
- •§ 18. Застосування комплексних сполук в аналізі
- •§ 19. Органічні реактиви
- •Розділ 4. Реакції окислення-відновлення
- •§ 20. Загальна характеристика
- •§ 21. Окислювально-відновний потенціал
- •§ 22. Властивості окислювально-відновного потенціалу. Рівняння Нернста
- •§ 23. Окислювальний потенціал і напрям реакцій окислення-відновлення
- •§ 24. Індуктивні реакції окислення-відновлення
- •§ 25. Хроматографічний аналіз. Іонообмінники
- •§ 26. Екстракція. Інші методи розділення
- •§ 27. Аналіз у розчині та сухий метод аналізу
- •§ 28. Макро-, мікро- і напівмікроаналіз. Краплинний, безстружковий і мікрокристалоскопічний методи аналізу
- •§ 29. Чутливість і специфічність реакцій
- •§ Зо. Хімічні реактиви
- •§ 31. Концентрація розчинів
- •§ 32. Техніка роботи в лабораторії якісного аналізу
- •§ 33. Дробний і систематичний методи якісного аналізу
- •§ 34. Класифікація катіонів на аналітичні групи
- •Розділ 7. І аналітична група катіонів
- •§ 35. Загальна характеристика групи
- •§ 36. Натрій
- •§ 38. Амоній
- •§ 39. Магній
- •§ 40. Аналіз суміші катіонів і аналітичної групи
- •Розділ 8. II аналітична група катіонів § 41. Загальна характеристика групи
- •§ 43. Стронцій
- •§ 44. Кальцій
- •§ 45. Аналіз суміші катіонів і і II аналітичних груп
- •Розділ 9. Ill аналітична група катіонів § 46. Загальна характеристика групи
- •§ 47. Алюміній
- •§ 48. Хром
- •§ 50. Марганець
- •§ 51. Цинк
- •§ 52. Кобальт
- •§ 53. Нікель
- •§ 54. Аналіз суміші катіонів III аналітичної групи
- •§ 56. Аналіз суміші катіонів III, II і і аналітичних груп, що містить фосфат-іони
- •Розділ 10. IV аналітична група катіонів
- •§ 57. Загальна характеристика групи
- •Підгрупа срібла
- •§ 59. Свинець
- •§ 60. Ртуть (і)
- •§ 61. Аналіз суміші катіонів підгрупи срібла
- •IV аналітичної групи
- •Підгрупа міді
- •§ 62. Ртуть (II)
- •§ 64. Кадмій
- •§ 65. Вісмут
- •§ 66. Аналіз суміші катіонів IV—і аналітичних груп
- •Розділ 11. V аналітична група катіонів § 67. Загальна характеристика групи
- •§ 69. Сурма
- •§ 70. Олово
- •§ 71. Аналіз суміші катіонів IV і V аналітичних груп
- •Розділ 12. Аналіз рідкісних елементів § 72. Загальна характеристика
- •§ 73. Титан
- •§ 74. Ванадій
- •§ 75. Молібден
- •§ 76. Вольфрам
- •§ 78. Безсірководневі методи якісного аналізу катіонів
- •Розділ 13. Аналіз аніонів § 79. Класифікація аніонів
- •І група аніонів
- •§ 86. Кремнієва кислота і реакції силікат-іонів SiO|—
- •II група аніонів
- •§ 91. Йодистоводнева кислота і реакції йодид-іонів і
- •§ 92. Сірководнева кислота і реакції сульфід-іонів s2-
- •Ill група аніонів
- •§ 94. Азотна кислота і реакції нітрат-іонів імог
- •§ 95. Азотиста кислота і реакції нітрит-іонів n02
- •§ 96. Оцтова кислота і реакції ацетат-іонів сн3соо
- •§ 97. Хлорнувата кислота і реакції гіпохлорат-іонів сюг
- •§ 98. Аналіз суміші аніонів і—III аналітичних груп
- •§ 100. Розчинення речовини і виявлення катіонів
- •§ 101. Виявлення аніонів
- •§ 102. Аналіз металів і сплавів
- •§ 103. Предмет і значення кількісного аналізу
- •§ 104. Визначення основних компонентів і визначення домішок
- •§ 105. Класифікація хімічних методів кількісного аналізу
- •І. Гравіметричий аналіз1
- •§ 106. Суть методу
- •§ 107. Вимоги до осадів у гравіметричному аналізі
- •§ 108. Співосадження
- •§ 109. Умови осадження
- •§ 110. Відокремлення осаду від маточного розчину
- •§ 111. Переведення осаду у вагову форму
- •§ 112. Принцип дії аналітичних терезів
- •§ 113. Правила користування аналітичними терезами і зважування на них
- •Розділ 18. Приклади гравіметричних визначень
- •§ 114. Розрахунки у гравіметричному аналізі
- •0,3115 Г становить 100%;
- •0,5025 Г становить 100%; 0,0874 г » х%,
- •§ 115. Визначення заліза у вигляді оксиду
- •§ 116. Визначення сульфатів у вигляді сульфату барію
- •§ 117. Розділення і визначення кальцію і магнію
- •§ 118. Визначення нікелю в сталях
- •II. Титриметричний аналіз Розділ 19. Загальні положення титриметричного аналізу
- •§ 119. Суть методу
- •§ 120. Концентрація розчинів і розрахунки в титриметричному аналізі
- •§ 121. Приготування робочих розчинів
- •§ 122. Методи непрямого титрування
- •§ 123. Точка еквівалентності
- •§ 124. Установлення точки еквівалентності за допомогою індикаторів
- •§ 125. Мірний посуд
- •§ 126. Перевірка мірного посуду
- •§ 127. Титрування кислотами та основами
- •§ 128. Індикатори методу кислотно-основного титрування (методу нейтралізації)
- •§ 129. Вибір індикаторів при титруванні кислотами та основами
- •§ 130. Криві титрування
- •§ 131. Помилки титрування
- •2NaHc03 ї± н20 -f- c02 -f Na2c03.
- •§ 132. Робочі розчини методу кислотно-основного титрування
- •§ 133. Приклади застосування методу кислотно-основного титрування (методу нейтралізації)
- •§ 134. Криві титрування
- •§ 135. Індикатори методів окислення-відновлення
- •§ 136. Еквівалент у реакціях окислення-відновлення
- •Розділ 22. Перманганатометрія
- •§ 137. Загальна характеристика методу. Приготування робочого розчину перманганату калію
- •§ 138. Визначення заліза
- •§ 139. Визначення пероксиду водню
- •§ 140. Визначення нітритів
- •Розділ 23. Йодометрія
- •§ 141. Загальна характеристика методу
- •§ 142. Приготування робочих титрованих розчинів
- •§ 143. Йодометричне визначення міді
- •§ 144. Йодометричне визначення активного хлору в хлорному вапні
- •B/r. WNa,s203l/NaliS!03јCl " 10°
- •§ 145. Йодометричне визначення сірки
- •Розділ 24. Метод осадження § 146. Загальна характеристика методу
- •§ 147. Індикатори
- •§ 148. Помилки титрування в методі осадження
- •§ 149. Робочі розчини і вихідні речовини методу осадження
- •§ 150. Визначення галогенід-іонів
- •Розділ 25. Методи комплексоутворення
- •§ 151. Загальні положення методів комплексоутворення
- •§ 152. Меркуриметричне визначення хлоридів
- •§ 153. Комплексонометричне визначення твердості води
- •III. Спектрофотометричний і колориметричний методи аналізу Розділ 26. Загальні положення
- •§ 154. Суть методів
- •§ 155. Загальні умови колориметричного визначення
- •§ 156. Закон Бугера—Ламберта—Бера
- •§ 157. Методи вимірювання інтенсивності забарвлення
- •§ 159. Визначення міді в грунтах
- •§ 160. Загальні положення
- •§ 161. Наближене визначення рН
- •§ 162. Безбуферні методи визначення рН
- •§ 163. Буферний метод визначення рН
- •IV. Аналіз різних матеріалів Розділ 29. Аналіз продуктів харчування § 164. Визначення кислотності хліба і молока
- •§ 165. Аналіз грунту і води
- •§ 166. Визначення оксидів кальцію і магнію в доломіті
- •Розділ 31. Аналіз добрив
- •§ 167. Визначення фосфору в суперфосфаті
- •§ 168. Визначення калію в калійних добривах
- •§ 169. Визначення азоту в аміачних добривах
- •Додатки
- •Кислоти
- •Густина розчинів їдких калі і натру
§ 128. Індикатори методу кислотно-основного титрування (методу нейтралізації)
При титруванні до розчину одного компонента добавляють розчин другого компонента, поки буде досягнута точка еквівалентності, тобто поки кількості добавленого і взятого компонентів будуть еквівалентними. У методі нейтралізації розчин кислоти титрують розчином основи або навпаки. Для визначення кінця титрування використовують індикатори. Практично майже неможливо підібрати індикатор, який показав би кінець титрування в точці еквівалентності. Тому точку кінця титрування, яку визначають індикатором, називають кінцевою тонкою титрування. Кінцева точка титрування завжди відрізняється від точки еквівалентності. Чим більше ці точки різняться між собою, тим більша помилка титрування.
Індикатори методу нейтралізації є слабкими органічними кислотами або основами, молекулярна форма яких має інше забарвлення, ніж іонна. Індикатори методу нейтралізації бувають одно- і двоколірні. Одноколірні індикатори мають забарвлення лише в одній, звичайно іонній (сольовій) формі. Колір цих форм різний і залежить від рН розчину.
406
У водних розчинах кислотні індикатори дисоціюють на іони:
Піп ?± Н+ + Іп-. (1)
Характеристикою індикатора є його константа кислотної дисоціації:
к
(2)
Шп
- Ін+) У'1~\ [Н/лІ •
Залежно від величини константи дисоціації кислотно-основні індикатори поділяють на сильні, проміжні і слабкі. Сильні індикатори характеризуються величиною Кніп > Ю—7 і змінюють своє забарвлення в кислому середовищі при рН < 7. Типовим представником цієї групи індикаторів є метилоранж, забарвлення якого змінюється в межах рН = = 3,4-4,3.
Метилоранж є амфотерним електролітом, який і в нейтральних, і в лужних розчинах перебуває в іонному стані. Зміна структури метилоранжу при переході з лужних і нейтральних розчинів у кислі характеризується таким рівнянням:
[(CH,)2N-^Vn=N-/' \-S03]Na++ H+ ^ Жовтий; рН = 4,0 і більше
![]()
ҐА
-N—<( 7~S°3 + Na + Н
Червоний
; рН < 4,0
Індикатори
проміжної сили змінюють своє забарвлення
при рН я= 7. До цієї групи індикаторів
належить лакмус,
який змінює своє забарвлення в межах
рН = 6,8—7,2.
Слабкі
індикатори змінюють забарвлення в
слабко лужному середовищі. Типовим
представником цієї групи індикаторів
є фенолфталеїн,
дві
гідроксильні групи якого мають кислотний
характер.
При
переході в сольову форму змінюється
структура фенолфталеїну:
СГ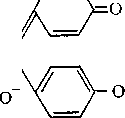 т
т
/\
/![]() >-
>-
/ \
+![]() 2NaOH ^Ј
2NaOH ^Ј
о=с—о
-он
Na""
Безбарвний рН<8
При великій концентрації лугу (рН дить в іншу, безбарвну форму.
+ 2 Н,0 .
С-
и о
Червоний рН>8
13,5—14) фенолфталеїн перехо-
407
Інтервал переходу індикатора. Колір індикатора залежить від концентрації водневих іонів розчину. Розглянемо характер цієї залежності для кислотних індикаторів. Установлені залежності справджуються також для індикаторів інших типів.
З рівняння (1) видно, що стан рівноваги між молекулярною та іонною формами індикатора залежить від величини рН розчину. З константи дисоціації індикатора можна обчислити межі рН, в яких змінюватиметься його
Таблиця 25}
Величина рН . Індикатор 0 2 4 6 8 Ю 12 14 |
|
Метиловий фіолетовий |
"/')(* | І і і | |
Тимоловий синій (1 перехід) |
ч/ж і і і і і |
Метилоранж |
1 Ч/[Ж 1 і 1 1 |
Бромфенол синій |
і жХф і ! і І 1 1 J 1 І 1 |
Метиловий червоний |
\чАж і і |
Лакмус |
цУс\ |
Нейтральний червоний |
і і \ЧЛ і |
Феноловий червоний |
! і і жуАЧ \ І |
Тимоловий синій (//перехід) |
і і J *j/j j |
Фенолфталеїн |
і і і У<\\ |
Тимолфталеін |
І !•! І !*! • |
забарвлення в розчині. При цьому треба мати на увазі, що людське око помічає зміну забарвлення розчину лише в тому випадку, коли не менш як 10% загальної кількості індикатора переходить з однієї забарвленої форми в іншу.
Виходячи з рівняння (2), можна записати:
[III I
(3)
звідки
[Н/л][„J
=
Р*нл.
+ '8 "до"
да
рК™>,
~ •
•
* Позначення в таблиці: ж безбарвний.
жовтий; с
синій; ф — фіолетовий; ч — червоний;
408
або
РН = /»*,„„ +'В-yjj-«P*n/,. + l-
Отже, інтервал кислотності розчину, в межах якого відбувається помітна для людського ока зміна забарвлення індикатора, визначається рівнянням
РИ = РКш„*1- (4)
Таблиця 26. Значення рТ деяких індикаторів
Індикатор
рТ
Метилоранж Метиловий червоний Лакмус Фенолфталеїн Тимолфталеїн
Цей інтервал рН називають інтервалом переходу індикатора. Для переважної більшості індикаторів інтервал переходу за рівнянням (4) лежить у межах двох одиниць рН. Проте треба зазначити, що величина інтервалу переходу до деякої міри залежить також від індивідуальних особливостей індикаторів, зокрема від кольору та інтенсивності забарвлення молекулярної і сольової форм індикатора.
Інтервал переходу кислотно-основних індикаторів, залежно від величини рН, наведено в табл. 25.
Показник титрування індикатора. У межах інтервалу переходу індикатора є значення рН, при якому спостерігається найбільш помітна людським оком зміна кольору індикатора. Це значення рН називають показником титрування індикатора і позначають рТ.
Різка зміна кольору відбувається, як правило, в той момент, коли концентрації іонної і молекулярної форм індикатора стають однаковими; тому показник титрування здебільшого збігається з величиною логарифма константи дисоціації з оберненим знаком —рК. Проте специфічні властивості окремих індикаторів можуть призводити до певної розбіжності величин рТ і рК. У табл. 26 наведено значення рТ деяких індикаторів.
