- •Раздел I. Кинетика ферментативных процессов
- •1.1. Формальная кинетика
- •Закон действующих масс
- •Константа скорости реакции
- •Порядок химической реакции
- •Обратимые химические реакции
- •Влияние температуры на скорость химической реакции
- •Кинетика реакций Реакции первого порядка
- •Кинетическое уравнение реакции второго порядка
- •Метод Гуггенгейма
- •1.2. Кинетика ферментативных реакций Механизм действия ферментов
- •II. Уменьшить энергию активации
- •Уравнение Михаэлиса-Ментен
- •1. Зависимость от концентрации фермента
- •2. Зависимость скорости реакции от концентрации субстрата.
- •2 . Метод Хейнса
- •3 . Метод Скэтчарда (Иди–Хофсти)
- •Ингибирование ферментов
- •Конкурентное ингибирование
- •Графическое определение параметров конкурентного ингибирования
- •Бесконкурентное ингибирование
- •Графические методы определения параметров бесконкурентного ингибирования
- •1. Лайнуивера-Берка
- •2 . Хейнса
- •4. График Диксона
- •Неконкурентное ингибирование
- •1. Метод Лайнуивера-Берка
- •4. График Диксона
- •1. Общие сведения.
- •2. Ввод данных.
- •3. Построение графика.
- •4. Определение параметров поставленной задачи.
- •Лабораторная работа № 2. Определение кинетических параметров ферментативной реакции.
- •Задание для самостоятельной подготовки
- •Задание к работе.
- •Задания к лабораторной работе 2 Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10.
- •Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Р аздел іі. Изучение динамических моделей биологическихпроцессов Общие принципы описания кинетического поведения биологических систем
- •Качественное исследование простейших моделей биологических процессов
- •Простейшие математические модели
- •1. Модель экспоненциального роста популяций
- •Решение представляет собой формулу экспоненциального роста
- •2. Модель сезонного роста
- •3. Модель логистического роста
- •Качественные методы исследования систем дифференциальных уравнений
- •Устойчивость стационарного состояния. Фазовые портреты
- •Модели биологических процессов, описываемые системой дифференциальных уравнений
- •1. Виды конкурируют за одну и ту же пищу, запасы которой ограничены
- •2. Модель логистического роста (модель плотностного давления)
- •3. Модель хищник – жертва Вольтерра
- •4. Биологический метод борьбы с нежелательным видом. Метод Кюрасао.
- •Мы изучаем наиболее простую модель, предложенную Базыкиным.
- •Возможности MathCad, которые можно использовать при изучении темы
- •1. Символьное решение определителя матрицы для нахождения корней характеристического уравнения
- •2. Нахождение частных производных с помощью программы MathCad
- •3. Символьное решение уравнений и систем уравнений
- •Лабораторная работа 1 Численные методы решения дифференциальных уравнений и систем дифференциальных уравнений
- •I. Изменение численности популяции описывается одним дифференциальным уравнением
- •Задание 1
- •Задание 2
- •Изменение численности популяции описывается системой уравнений. Один вид ведет себя по отношению к другому как хищник Задание 3
- •Задание 4
- •Лабораторная работа № 2 Математические модели распространения инфекционных заболеваний Модель 1
- •Модель 2.
- •Модели эпидемий с переносчиками
- •Раздел ііі. Термодинамика биологических процессов обзор по равновесной термодинамике
- •1. Первый и второй законы термодинамики
- •Второй закон термодинамики
- •Энтропия и вероятность состояния
- •2. Характеристические функции
- •Для равновесных процессов:
- •Для неравновесных процессов:
- •Самопроизвольные процессы при постоянных t и p
- •Полезная работа и приращение свободной энергии
- •Выражение для свободной энергии в явном виде
- •Стандартные состояния. Стандартные условия
- •Химический потенциал
- •Электрохимический потенциал
- •Расчеты стандартных энергий биохимических реакций
- •Описание систем в термодинамике неравновесных процессов
- •1. Второй закон термодинамики в открытых системах
- •Особенности открытых систем
- •Возрастание энтропии вследствие необратимых процессов внутри открытых систем
- •Диссипация энергии в скалярных необратимых процессах
- •Диссипация энергии в векторных необратимых процессах
- •Диссипация свободной энергии в сопряженных скалярных и векторных процессах
- •Соотношения между значениями движущих сил и скоростей процессов. Соотношения Онзагера
- •Примеры линейных соотношений
- •– Соответствуют возможной взаимосвязи двух потоков и носят название коэффициентов взаимности Онзагера.
- •Пример:
- •Теорема Пригожина.
- •Список рекомендованной литературы Основная литература
- •Дополнительная литература
1. Зависимость от концентрации фермента
По
уравнению
![]()
Скорость
реакции при определенной концентрации
субстрата должна линейно зависеть от
концентрации фермента. Для большинства
ферментативных реакций это не соответствует
действительности. Нужно учитывать, что
уравнение
![]() приводится для концентрации субстрата,
которая значительно превосходит
концентрацию фермента. Линейная
зависимость будет выполняться, пока
будут соблюдаться эти условия. В случае
значительного повышения концентрации
[E0]
имеет место отклонение от линейности,
а при некоорых концентрациях (E)
скорость реакции повышаться не будет.
Это связано с тем, что концентрация
комплекса (ES) – промежуточного продукта
реакции не будет повышаться в случае
отсутствия достаточного количества
свободного субстрата.
приводится для концентрации субстрата,
которая значительно превосходит
концентрацию фермента. Линейная
зависимость будет выполняться, пока
будут соблюдаться эти условия. В случае
значительного повышения концентрации
[E0]
имеет место отклонение от линейности,
а при некоорых концентрациях (E)
скорость реакции повышаться не будет.
Это связано с тем, что концентрация
комплекса (ES) – промежуточного продукта
реакции не будет повышаться в случае
отсутствия достаточного количества
свободного субстрата.
В
некоторых случаях, даже при соблюдении
условий, когда
![]() ,
линейная зависимость между v
и [E0]
не наблюдается, что может свидетельствовать
о более сложном механизме ферментативной
реакции, по сравнению с тем, который
описывается химическим уравнением
(1.1) и о невозможности применения
уравнения Михаэлиса–Ментен.
,
линейная зависимость между v
и [E0]
не наблюдается, что может свидетельствовать
о более сложном механизме ферментативной
реакции, по сравнению с тем, который
описывается химическим уравнением
(1.1) и о невозможности применения
уравнения Михаэлиса–Ментен.
2. Зависимость скорости реакции от концентрации субстрата.
Зависимость скорости ферментативной реакции от концентрации субстрата при постоянной концентрации фермента определяется гиперболичной функцией:
 V
V
Vmax
![]()
Km S
2.1.
В случае незначительных концентраций
субстрата, когда
![]() ,
можно принять, что,
,
можно принять, что,
![]() ,
тогда
,
тогда
![]() .
.
Скорость реакции линейно зависит от концентрации субстрата.
2.2.
При
![]() ,
,
![]() ,
т.е. скорость реакции не зависит от
концентрации субстрата и равна
максимальной скорости реакции.
,
т.е. скорость реакции не зависит от
концентрации субстрата и равна
максимальной скорости реакции.
Определение параметров Vm и Km из экспериментальных данных
Как правило, из данных по стационарной кинетике величины Vm и Km определяют на основе линеаризации уравнения Михаэлиса–Ментен.
1. Метод двойных обратных координат (Метод Лайнуивера–Берка)
|
|
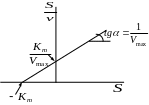
2 . Метод Хейнса
|
|
3 . Метод Скэтчарда (Иди–Хофсти)
![]()
![]()
![]()
Ингибирование ферментов
Исследование кинетики действия ферментов является основой для установления характера действия многих ингибиторов. Ингибиторы можно разделить на две группы –обратимые и необратимые. При действии обратимого ингибитора после его удаления (с помощью диализа) активность фермента восстанавливается (при действии необратимого ингибитора- не восстанавливается). Необратимое ингибирование является прогрессирующим и становится полным в том случае, если весь фермент оказывается связанным с ингибитором, в то время как обратимое ингибирование достигает состояния равновесия, определяемое ингибиторной константой, то есть константой диссоциации комплекса фермент- ингибитор.
Различают
три типа обратимого ингибирования, а
именно: конкурентное,
неконкурентное и бесконкурентное.
При конкурентном и неконкурентном
ингибировании наблюдается изменение
кажущихся величин
![]() и
соответственно.
и
соответственно.
Конкурентный ингибитор- это соединение, которое благодаря большому структурному сходству с истинным субстратом, способно взаимодействовать с активным центром и, следовательно, конкурировать с субстратом за фермент; он увеличивает . Скорость реакции снижается, поскольку комплекс фермент- ингибитор является неактивным, то есть не распадается с образованием продуктов. Степень ингибирования зависит от относительных концентраций субстрата и ингибитора, и при достаточно большой концентрации субстрата ингибирование может быть полностью подавлено.
При
неконкурентном ингибировании
степень обратимого ингибирования
зависит только от концентрации ингибитора
и не изменяется при варьировании
концентрации субстрата. Это свидетельствует
о том, что взаимодействие ингибитора с
ферментом происходит на участке, важном
для активности, но не в самом активном
центре, где связывается субстрат, то
есть сродство фермента к своему субстрату
не изменяется; ингибитор влияет на
![]() .
.
Бесконкурентное ингибирование наблюдается в том случае, когда ингибитор не взаимодействует со свободным ферментом, а способен связываться только с комплексом фермент- субстрат или другими формами фермента, которые не присоединяют субстрат. Поэтому представляется вероятным, что в том случае, когда образование комплекса с субстратом не изменяет конформацию фермента, взаимодействие комплекса с ингибитором должно осуществляться, по крайней мере частично, при участии связанного субстрата. Бесконкурентное ингибирование влияет как на связывание субстрата так и на максимальную скорость, и, как будет показано ниже, характерной чертой для бесконкурентного ингибирования является уменьшение и в одно и то же число раз.
Следует подчеркнуть, что тип ингибирования, наблюдаемый при действии данного соединения, зависит от природы фермента. Например, соединение может действовать как конкурентный ингибитор по отношению к одному ферменту и как неконкурентный– по отношению к другому.
Установление типа ингибирования (конкурентного, неконкурентного и бесконкурентного) может быть осуществлено экспериментально; при этом используют кинетические уравнения ингибирования.