
- •Лабораторна робота №1 Тема: Визначення величин показників, що характеризують прооксидантно-антиоксидантний гомеостаз
- •Хід роботи:
- •Контрольні питання:
- •Література:
- •Лабораторна робота № 2 Визначення вмісту вторинних продуктів перекисного окиснення біополімерів
- •1. Місця протікання перекисного окиснення. Шляхи перекисного окиснення.
- •Хід роботи:
- •Контрольні питання:
- •Тестові питання:
- •Література:
- •Лабораторна робота № 3 Біоантиоксидантний захист. Визначення активності антиоксидантів ферменту супероксиддисмутази.
- •Хід роботи:
- •Контрольні питання:
- •Тестові завдання:
- •Контрольні питання:
- •Тестові питання:
- •Література:
- •Лабораторна робота №5 Роль вільнорадикального окиснення і ліпідної пероксидації в патогенезі захворювань серцево-судинної системи
- •Хід роботи:
- •Контрольні питання:
- •Тестові питання:
- •Література:
- •Лабораторна робота №6 Стрес. Окислювальний стрес
- •Хід роботи:
- •Методика визначення активності лдг
- •Контрольні питання
- •Тестові питання
- •Література:
- •Лабораторна робота №7 Роль вільнорадикального окиснення і ліпідної пероксидації у патогенезі захворювань мозку та онкологічних захворювань
- •Хід роботи:
- •Контрольні питання:
- •Тестові питання:
Лабораторна робота №1 Тема: Визначення величин показників, що характеризують прооксидантно-антиоксидантний гомеостаз
Мета: ознайомитись з процесами перекисного окиснення ліпідів, визначити вміст первинних продуктів перекисного окиснення біополімерів.
Основні поняття: ненасичені жирні кислоти (НЖК), фосфоліпіди, продукти перекисного окиснення, кисневі радикали, омега – 3 жирні кислоти, ейкозаноїди
Питання для теоретичної підготовки:
-
НЖК (будова, біологічне значення)
-
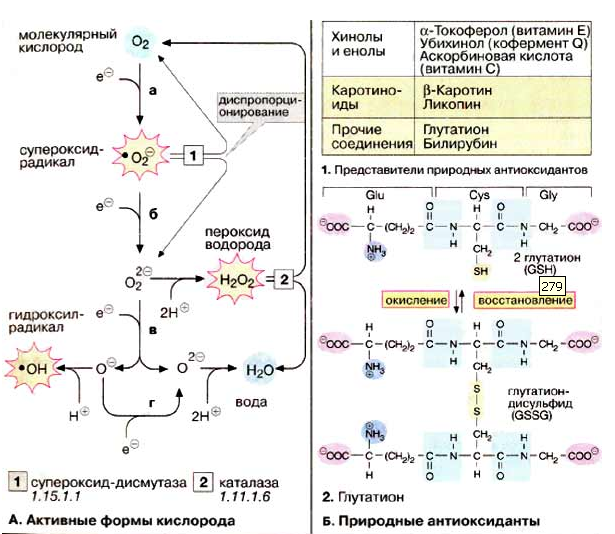
Місця протікання перекисного окиснення. Шляхи перекисного окиснення.
-
Продукти ПО
-
Фізіологічна роль перекисного окиснення НЖК
-
Роль омега-3 жирних кислот.
-
Біологічні ефекти продуктів перекисного окиснення жирних кислот.
Хід роботи:
Розглянути та замалювати схему:
Контрольні питання:
-
Дати визначення поняттям «ненасичені жирні кислоти», «кисневі радикали»
-
Описати основні шляхи окислення жирних кислот.
-
Роль омега-3-жирних кислот.
1. Продукти перекисного окиснення.
2. Роль перекисного окиснення НЖК в організмі.
3. Дати визначення поняттям «омега-3-жирні кислоти», «ейкозаноїди»
Література:
-
Кольман Я., Рем К.Г. Наглядная биохимия: Пер. с нем. Мир, Москва, 2000, 469 с.
-
Ленинджер А. Основы биохимии: В 3-х томах. Т.2. Мир, Москва, 1985, 368 с.
-
Страер Л.С. Биохимия: Пер. с англ. В 3-х томах. Т.1. Мир, Москва,1984, 1232 с.
-
Уайт Л., Хендлер Ф., Смит Э., Хилл Р., Леман И. Основы биохимии: в 3-х томах.
Лабораторна робота № 2 Визначення вмісту вторинних продуктів перекисного окиснення біополімерів
Мета: визначити величини показників, що характеризують прооксидантно-антиоксидантний гомеостаз. Визначити вміст ТБК-реагуючих продуктів (МДА).
Основні поняття: малоновий діальдегід, екстинкція, максимум поглинання, супернатант, тіобарбітурова кислота, вільнорадикальна патологія, антиоксидантний статус організму
Питання для теоретичної підготовки:
1. Місця протікання перекисного окиснення. Шляхи перекисного окиснення.
2 .Біологічні ефекти продуктів перекисного окиснення жирних кислот.
Хід роботи:
У серці тварин визначали вміст вторинних продуктів перекисного окиснення біополімерів, здебільшого ліпідів, за приростом концентрації малонового діальдегіду (МДА) у спонтанних умовах, а також після інкубації гомогенату серця у залізоаскорбінатному буферному розчині (прооксидантна ситуація з аскорбатзалежною пероксидацію) або у буферному розчині, що містить НАДФН (ферментативна пероксидація). МДА визначали за реакцією з 2-тіобарбітуровою кислотою (2-ТБК) у кислому середовищі до (МДА-0) та після 1,5-годинної інкубації (МДА-1,5) гомогенату серця у прооксидантному залізоаскорбатному буферному розчині, з подальшим розрахунком приросту за час інкубації (ΔМДА).
Принцип методу:
при нагріванні розчину альдегідів з
2-ТБК у кислому середовищі утворюється
триметиновий комплекс помаранчевого
кольору з максимумом поглинання при
532 нм, молярний коефіцієнт екстинкції
якого 156000![]() .
.
Хід визначення: 0,5 г серця гомогенізували на холоді у 4,5 мл води. Відбирали 0,5 мл гомогенату та додавали 4,5 мл прооксидантного буферного розчину. Буферний розчин готували так: у мірну колбу місткістю 1000 мл, вносили 500 мл дистильованої води, додавали 1,9 г трис-(окси)-метиламінометану, 50 мл 0,1 н розчину соляної кислоти, 1,4 г аскорбінової кислоти, 0,032 г заліза сірчанокислого семиводного. Реактиви вносили тільки у вказаному порядку, при цьому наступний реактив додавали лише після повного розчинення попереднього. Доливали дистильовану воду майже до мітки на мірній колбі, добре перемішували та залишали суміш у темряві на 1 добу. За цей час колір суміші повинен змінитися з синьо-фіолетового на жовтий. Через добу перевіряли рН суміші та у разі необхідності доводили рН до значення 7,4, обережно невеликими порціями додаючи розчин трис-(окси)-метиламінометану, якщо рН менше 7,4, або розчин соляної кислоти, якщо рН більше 7,4. Відбирали по 2 мл суміші у дві пробірки, одну пробірку ставили у термостат на інкубацію при температурі 37°С протягом 1,5 години. У іншу пробірку що залишилася, додавали 1 мл 30% розчину трихлороцтової кислоти (ТХО), перемішували скляною паличкою та центрифугували при 3000 об/хв. термін 30 хв. Теж саме робили після інкубації. У штатив для пробірок набирали два ряди хімічних пробірок. Кількість пробірок у кожному ряду дорівнювала кількості проб, що аналізуються; крім того, у штатив ставилася ще одна пробірка для контролю на реактиви. Пробірки першого ряду підписували номером проби, другого – номером проби зі штрихом. Відбирали по 2 мл супернатанту та переносили його у хімічну пробірку, позначену відповідним номером. У хімічні пробірки для контролю на реактиви наливали 1,2 мл буферної суміші, 0,7 мл розчину ТХО та 0,1 мл дистильованої води. У всі хімічні пробірки наливали 3 мл розчину ТБК, добре перемішували та переносили їх у круглий металевий штатив. Штатив з пробірками ставили на водяну баню та витримували при температурі кипіння води терміном 50 хв. Пробірки охолоджували водопровідною водою та вимірювали оптичну густину розчинів, що знаходяться у них, на КФК-2 у кюветі з довжиною оптичного шляху 10 мм при довжині хвилі 540 нм (зелений світлофільтр) проти контролю на реактиви. Концентрацію ТБК-активних продуктів у еритроцитах крові обчислювали за формулою:
![]()
де: СМДА – концентрація ТБК-активних продуктів, мкМ;
240,4 – коефіцієнт, що враховує молярний коефіцієнт поглинання розчину, об’єм взятої для аналізу проби, розведення проби у ході аналізу, довжину оптичного шляху;
Е – екстинкція проби
