- •Раздел I. Кинетика ферментативных процессов
- •1.1. Формальная кинетика
- •Закон действующих масс
- •Константа скорости реакции
- •Порядок химической реакции
- •Обратимые химические реакции
- •Влияние температуры на скорость химической реакции
- •Кинетика реакций Реакции первого порядка
- •Кинетическое уравнение реакции второго порядка
- •Метод Гуггенгейма
- •1.2. Кинетика ферментативных реакций Механизм действия ферментов
- •II. Уменьшить энергию активации
- •Уравнение Михаэлиса-Ментен
- •1. Зависимость от концентрации фермента
- •2. Зависимость скорости реакции от концентрации субстрата.
- •2 . Метод Хейнса
- •3 . Метод Скэтчарда (Иди–Хофсти)
- •Ингибирование ферментов
- •Конкурентное ингибирование
- •Графическое определение параметров конкурентного ингибирования
- •Бесконкурентное ингибирование
- •Графические методы определения параметров бесконкурентного ингибирования
- •1. Лайнуивера-Берка
- •2 . Хейнса
- •4. График Диксона
- •Неконкурентное ингибирование
- •1. Метод Лайнуивера-Берка
- •4. График Диксона
- •1. Общие сведения.
- •2. Ввод данных.
- •3. Построение графика.
- •4. Определение параметров поставленной задачи.
- •Лабораторная работа № 2. Определение кинетических параметров ферментативной реакции.
- •Задание для самостоятельной подготовки
- •Задание к работе.
- •Задания к лабораторной работе 2 Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10.
- •Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Р аздел іі. Изучение динамических моделей биологическихпроцессов Общие принципы описания кинетического поведения биологических систем
- •Качественное исследование простейших моделей биологических процессов
- •Простейшие математические модели
- •1. Модель экспоненциального роста популяций
- •Решение представляет собой формулу экспоненциального роста
- •2. Модель сезонного роста
- •3. Модель логистического роста
- •Качественные методы исследования систем дифференциальных уравнений
- •Устойчивость стационарного состояния. Фазовые портреты
- •Модели биологических процессов, описываемые системой дифференциальных уравнений
- •1. Виды конкурируют за одну и ту же пищу, запасы которой ограничены
- •2. Модель логистического роста (модель плотностного давления)
- •3. Модель хищник – жертва Вольтерра
- •4. Биологический метод борьбы с нежелательным видом. Метод Кюрасао.
- •Мы изучаем наиболее простую модель, предложенную Базыкиным.
- •Возможности MathCad, которые можно использовать при изучении темы
- •1. Символьное решение определителя матрицы для нахождения корней характеристического уравнения
- •2. Нахождение частных производных с помощью программы MathCad
- •3. Символьное решение уравнений и систем уравнений
- •Лабораторная работа 1 Численные методы решения дифференциальных уравнений и систем дифференциальных уравнений
- •I. Изменение численности популяции описывается одним дифференциальным уравнением
- •Задание 1
- •Задание 2
- •Изменение численности популяции описывается системой уравнений. Один вид ведет себя по отношению к другому как хищник Задание 3
- •Задание 4
- •Лабораторная работа № 2 Математические модели распространения инфекционных заболеваний Модель 1
- •Модель 2.
- •Модели эпидемий с переносчиками
- •Раздел ііі. Термодинамика биологических процессов обзор по равновесной термодинамике
- •1. Первый и второй законы термодинамики
- •Второй закон термодинамики
- •Энтропия и вероятность состояния
- •2. Характеристические функции
- •Для равновесных процессов:
- •Для неравновесных процессов:
- •Самопроизвольные процессы при постоянных t и p
- •Полезная работа и приращение свободной энергии
- •Выражение для свободной энергии в явном виде
- •Стандартные состояния. Стандартные условия
- •Химический потенциал
- •Электрохимический потенциал
- •Расчеты стандартных энергий биохимических реакций
- •Описание систем в термодинамике неравновесных процессов
- •1. Второй закон термодинамики в открытых системах
- •Особенности открытых систем
- •Возрастание энтропии вследствие необратимых процессов внутри открытых систем
- •Диссипация энергии в скалярных необратимых процессах
- •Диссипация энергии в векторных необратимых процессах
- •Диссипация свободной энергии в сопряженных скалярных и векторных процессах
- •Соотношения между значениями движущих сил и скоростей процессов. Соотношения Онзагера
- •Примеры линейных соотношений
- •– Соответствуют возможной взаимосвязи двух потоков и носят название коэффициентов взаимности Онзагера.
- •Пример:
- •Теорема Пригожина.
- •Список рекомендованной литературы Основная литература
- •Дополнительная литература
1.2. Кинетика ферментативных реакций Механизм действия ферментов
Около 50% белков являются ферментами и могут ускорять ту или иную реакцию. Ускорение достигается за счет улучшения кинетических характеристик реакции.
Рассмотрим, за счет чего, в принципе, может осуществляться этот эффект.
Способы ускорения реакций.
Обратимся, для определенности к двусубстратной реакции вида:
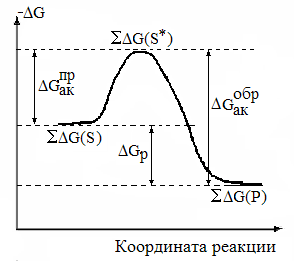
и ее энергетической диаграмме (рис.1.2.1). На диаграмме:
1.
2.
их разница -
3.
4. разница между средней энергией и энергетическим барьером - энергия активации прямой или обратной реакции, если |
Рис.1.2.1. Энергетическая диаграмма реакции вида |
речь идёт о средней энергии, соответственно, субстратов или продуктов:
![]()
![]()
Обе эти величины всегда положительны. Из диаграммы ясна также связь между энергией активации прямой и обратной реакций:
![]()
Для скорости прямого превращения справедливы формулы:
![]() (1)
(1) ![]() (2)
(2)
где
формула (2) – уравнение
Эйринга,
Отсюда ясно, что скорость реакции
определяется лишь следующими параметрами
(не считая температуры) – концентрациями
участников (![]() )
и энергией активации реакции (
)
и энергией активации реакции (![]() ).
).
Это означает, что катализатор любой природы (в т.ч. и фермент) имеет всего три принципиальные возможности ускорить реакцию:
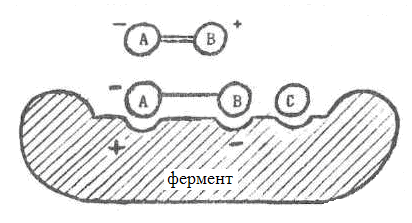
I. увеличить эффективную концентрацию участников. Увеличение эффективной концентрации достигается за счет того, что фермент имеет центры связывания для обоих субстратов, так что при связывании с ними молекулы субстратов во-первых, сильно сближаются, а во-вторых, правильно ориентируются друг относительно друга.
II. Уменьшить энергию активации
А. "снизу", за счет увеличения энергии субстратов .
Суть данного феномена в том, что взаимодействие субстрата с ферментом ведет к созданию в молекуле субстрата напряженной конформации (такой, в которой субстрат легче вступает в реакцию).
Например, как показано на рис.1.2.2, расстояние на ферменте между центрами связывания групп А и В субстрата АВ несколько больше длины молекулы АВ. Поэтому при связывании связь А—В как бы "растягивается", что и означает переход субстрата в возбужденное состояние. Таким образом, здесь имеет место передача некоторого количества энергии от фермента к субстрату. Но потом, когда фермент переходит в начальное состояние, эта энергия ему возвращается за счет выделяющейся энергии реакции.
|
Рис. 1.2.2. Механизм снижения энергии активации за счет увеличения энергии субстратов. |
Б. либо "сверху", за счёт снижения энергетического барьера .
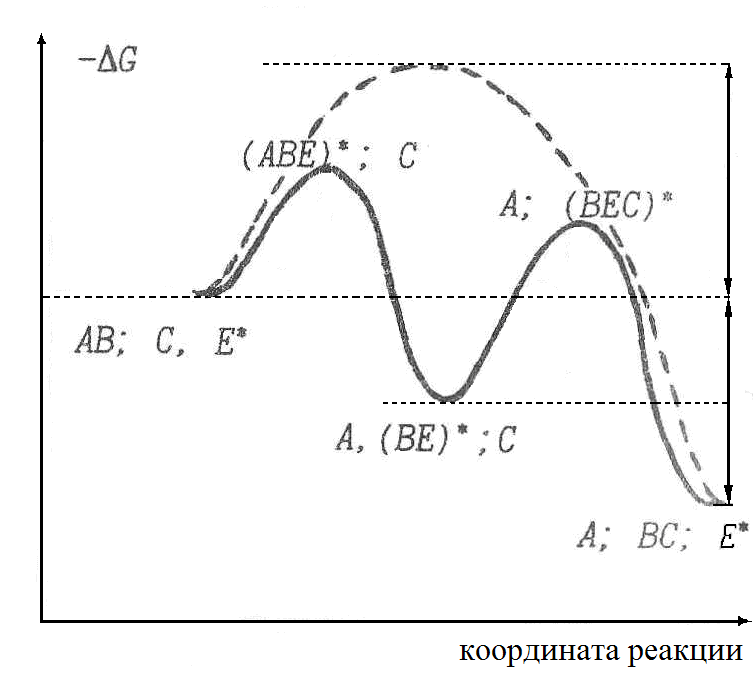
Энергетический барьер обычно снижается путем разбиения исходной реакции на несколько других, причем таких, что энергия активации в каждой из них оказывается меньше, чем в исходной (1.2.3).
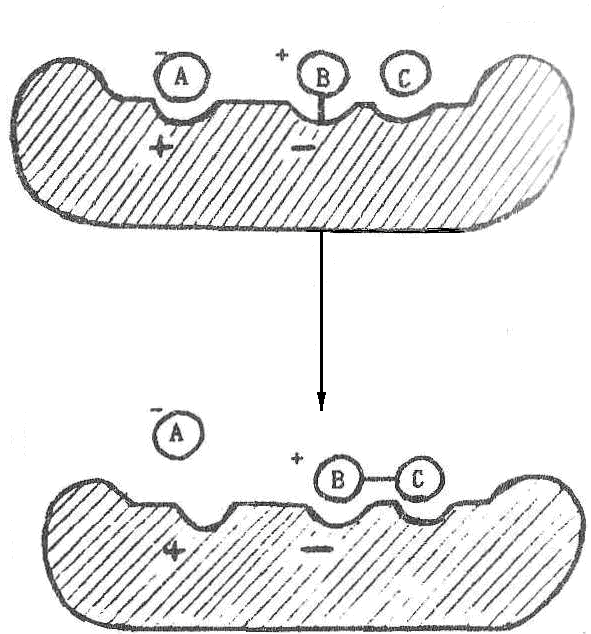
Например, пусть после разрыва связи А—В группа В предварительно образует связь с ферментом (ковалентную или иную) (1.2.3), т.е. вместо реакции (1) получаются реакции:
![]()
![]()
И пусть соответствующая группа фермента, участвующая в образовании связи, находится в возбужденном состоянии (за счет влияния окружающих радикалов).
Тогда энергия активации каждой из промежуточных реакций (рис. 1.2.3) окажется меньше, чем для исходной реакции. В каждой из них энергия требуется для активации только одного из двух участников реакции: в первой - только для АВ, а во второй - только для С. Скорость результирующего процесса будет определяться той из двух промежуточных реакций, у которой энергия активации больше.
|
|
Рис. 1.2.3. Механизм снижения энергии активации за счет снижения энергетического барьера. |
|
Все эти три возможности используются в катализе (как ферментативном, так и неферментативном), причем одни катализаторы реализуют сразу две-три из них, а другие - лишь какую-либо одну.