
- •Раздел I. Кинетика ферментативных процессов
- •1.1. Формальная кинетика
- •Закон действующих масс
- •Константа скорости реакции
- •Порядок химической реакции
- •Обратимые химические реакции
- •Влияние температуры на скорость химической реакции
- •Кинетика реакций Реакции первого порядка
- •Кинетическое уравнение реакции второго порядка
- •Метод Гуггенгейма
- •1.2. Кинетика ферментативных реакций Механизм действия ферментов
- •II. Уменьшить энергию активации
- •Уравнение Михаэлиса-Ментен
- •1. Зависимость от концентрации фермента
- •2. Зависимость скорости реакции от концентрации субстрата.
- •2 . Метод Хейнса
- •3 . Метод Скэтчарда (Иди–Хофсти)
- •Ингибирование ферментов
- •Конкурентное ингибирование
- •Графическое определение параметров конкурентного ингибирования
- •Бесконкурентное ингибирование
- •Графические методы определения параметров бесконкурентного ингибирования
- •1. Лайнуивера-Берка
- •2 . Хейнса
- •4. График Диксона
- •Неконкурентное ингибирование
- •1. Метод Лайнуивера-Берка
- •4. График Диксона
- •1. Общие сведения.
- •2. Ввод данных.
- •3. Построение графика.
- •4. Определение параметров поставленной задачи.
- •Лабораторная работа № 2. Определение кинетических параметров ферментативной реакции.
- •Задание для самостоятельной подготовки
- •Задание к работе.
- •Задания к лабораторной работе 2 Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10.
- •Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Р аздел іі. Изучение динамических моделей биологическихпроцессов Общие принципы описания кинетического поведения биологических систем
- •Качественное исследование простейших моделей биологических процессов
- •Простейшие математические модели
- •1. Модель экспоненциального роста популяций
- •Решение представляет собой формулу экспоненциального роста
- •2. Модель сезонного роста
- •3. Модель логистического роста
- •Качественные методы исследования систем дифференциальных уравнений
- •Устойчивость стационарного состояния. Фазовые портреты
- •Модели биологических процессов, описываемые системой дифференциальных уравнений
- •1. Виды конкурируют за одну и ту же пищу, запасы которой ограничены
- •2. Модель логистического роста (модель плотностного давления)
- •3. Модель хищник – жертва Вольтерра
- •4. Биологический метод борьбы с нежелательным видом. Метод Кюрасао.
- •Мы изучаем наиболее простую модель, предложенную Базыкиным.
- •Возможности MathCad, которые можно использовать при изучении темы
- •1. Символьное решение определителя матрицы для нахождения корней характеристического уравнения
- •2. Нахождение частных производных с помощью программы MathCad
- •3. Символьное решение уравнений и систем уравнений
- •Лабораторная работа 1 Численные методы решения дифференциальных уравнений и систем дифференциальных уравнений
- •I. Изменение численности популяции описывается одним дифференциальным уравнением
- •Задание 1
- •Задание 2
- •Изменение численности популяции описывается системой уравнений. Один вид ведет себя по отношению к другому как хищник Задание 3
- •Задание 4
- •Лабораторная работа № 2 Математические модели распространения инфекционных заболеваний Модель 1
- •Модель 2.
- •Модели эпидемий с переносчиками
- •Раздел ііі. Термодинамика биологических процессов обзор по равновесной термодинамике
- •1. Первый и второй законы термодинамики
- •Второй закон термодинамики
- •Энтропия и вероятность состояния
- •2. Характеристические функции
- •Для равновесных процессов:
- •Для неравновесных процессов:
- •Самопроизвольные процессы при постоянных t и p
- •Полезная работа и приращение свободной энергии
- •Выражение для свободной энергии в явном виде
- •Стандартные состояния. Стандартные условия
- •Химический потенциал
- •Электрохимический потенциал
- •Расчеты стандартных энергий биохимических реакций
- •Описание систем в термодинамике неравновесных процессов
- •1. Второй закон термодинамики в открытых системах
- •Особенности открытых систем
- •Возрастание энтропии вследствие необратимых процессов внутри открытых систем
- •Диссипация энергии в скалярных необратимых процессах
- •Диссипация энергии в векторных необратимых процессах
- •Диссипация свободной энергии в сопряженных скалярных и векторных процессах
- •Соотношения между значениями движущих сил и скоростей процессов. Соотношения Онзагера
- •Примеры линейных соотношений
- •– Соответствуют возможной взаимосвязи двух потоков и носят название коэффициентов взаимности Онзагера.
- •Пример:
- •Теорема Пригожина.
- •Список рекомендованной литературы Основная литература
- •Дополнительная литература
Вариант 6
Метионин образуется при биосинтезе (Escherichia coli) в результате ферментативного метиллрования гомоцистеина 5-метилтетрагидроптероилтриглутаматом. Образование метионина регистрировали микробиологическим методом. Были получены следующие результаты:
Триглутамат, мкмоль/л |
Кол-во образовавшегося метионина, нмоль |
10 |
500 |
12,5 |
526 |
16,7 |
555 |
25 |
589 |
50 |
714 |
Найти константу Михаэлиса и максимальную скорость реакции методами Лайнуивера-Бэрка, Эди-Хофсти и Хейнса. Сравните полученные результаты.
Вариант 7
При изучении зависимости скорости реакции от концентрации субстрата были получены след. данные. Субстратом служил фенолфталеинглюкуронид; скорость реакции выражали в микрограммах фенолфталеина, освобождаемого за 60 минут при 37оС. Найти константу Михаэлиса и максимальную скорость реакции методами Лайнуивера-Бэрка, Эди-Хофсти и Хейнса. Сравните полученные результаты.
Концентрация субстрата, мМ |
Скорость реакции |
1 |
32 |
2 |
43,6 |
3 |
50,4 |
4 |
53 |
5 |
56,5 |
10 |
62,1 |
Вариант 8
Начальная скорость окисления сукцината натрия в фумарат натрия под действием фермента сукциноксидазы была измерена для ряда концентраций субстрата:
[S], моль/л |
0,01 |
0,002 |
0,001 |
0,0005 |
0,00033 |
V·106, моль/(л·с) |
1,17 |
0,99 |
0,79 |
0,62 |
0,50 |
Определите константу Михаэлиса и максимальную скорость данной реакции методами Лайнуивера-Бэрка, Эди-Хофсти и Хейнса. Сравните полученные результаты
Вариант 9
Н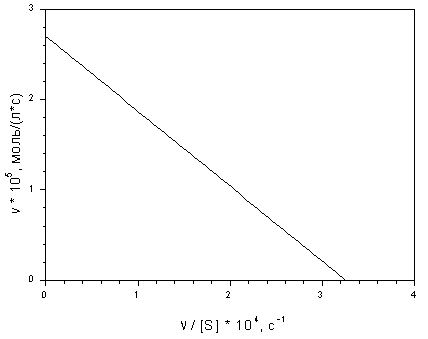 айдите
константу Михаэлиса и максимальную
скорость каталитического разложения
гидроперекиси тетралина по следующим
кинетическим данным:
айдите
константу Михаэлиса и максимальную
скорость каталитического разложения
гидроперекиси тетралина по следующим
кинетическим данным:
Используя уравнение Михаэлиса-Ментен, найдите значения концентрации субстрата для нескольких значений скорости реакции. По полученным данным рассчитайте максимальную скорость реакции и константу Михаэлиса методами Лайнуивера-Бэрка и Хейнса. Сравните полученные результаты.
П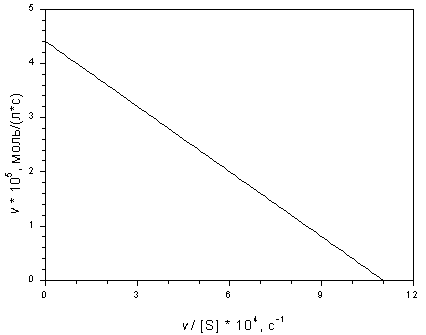 римечание:
Для нахождения концентраций субстрата
выбрать несколько значений скорости
по предложенному графику и записать их
в виде массива. Из уравнения Михаэлиса-Ментен
выразить значение S
через найденные величины V,
Km
и Vmax.
Поскольку полученная формула предполагает
действия с векторами, над выражением
необходимо поставить знак вектора
(панель инструментов Matrix,
кнопка с изображением
).
римечание:
Для нахождения концентраций субстрата
выбрать несколько значений скорости
по предложенному графику и записать их
в виде массива. Из уравнения Михаэлиса-Ментен
выразить значение S
через найденные величины V,
Km
и Vmax.
Поскольку полученная формула предполагает
действия с векторами, над выражением
необходимо поставить знак вектора
(панель инструментов Matrix,
кнопка с изображением
).
Вариант 10.
Найдите константу Михаэлиса и максимальную скорость каталитического окисления циклогексена трет-бутилпероксидом по следующим кинетическим данным:
Используя уравнение Михаэлиса-Ментен, найдите значения концентрации субстрата для нескольких значений скорости реакции. По полученным данным рассчитайте максимальную скорость реакции и константу Михаэлиса методами Лайнуивера-Бэрка и Хейнса. Сравните полученные результаты.
Лабораторная работа № 3.
Влияние ингибиторов на кинетику ферментативных реакций.
Задание для самостоятельной подготовки:
Знать типы ингибирования и соответствующие им уравнения скорости ферментативной реакции.
Уметь по графику в координатах Лайнуивера-Бэрка, Эди-Хофсти, Хейнса и Диксона определять тип ингибирования, константу ингибирования, кинетические параметры ферментативной системы.
Задание к работе.
Определить тип ингибирования и константу диссоциации комплекса фермент ингибитор, исходя из данных таблицы.
Построить точечные графики в координатах Лайнуивера-Бэрка. На одной координатной плоскости расположить графики без и в присутствии ингибитора.
С помощью функций slope и intercept определить тангенсы угла наклона полученных прямых и отрезки, отсекаемые на оси ординат.
На графике Лайнуивера-Бэрка пострить прямые, проходящие через точки, и для определения типа ингибирования полученные прямые продлить до точки их пересечения, как это описано в Лабораторной работе 2.
По виду полученных графиков определите тип ингибирования.
По тангенсам угла наклона и отрезкам, отсекаемым на осях найти константу Михаэлиса, максимальную скорость реакции, константу диссоциации фермент-ингибиторного комплекса.
Построить графики и найти кинетические параметры методами Эди-Хофсти, Хейнса и Диксона. Сравнить полученные результаты.
Примечание.
При нахождении кинетических параметров методом Диксона выполнить следующую последовательность действий:
- ввести вектор значений концентраций ингибитора;
- массивы для скоростей реакции сформировать следующим образом: каждому массиву задается новое имя (например, Vd1, Vd2 …); количество массивов равно числу концентраций субстрата; количество элементов в массиве соответствует количеству концентраций ингибитора. Элементами каждого массива являются значения скоростей реакции для выбранной концентрации субстрата при всех концентрациях ингибитора.
При нахождении константы ингибирования по методу Диксона для решения системы уравнений используется специальный вычислительный блок, состоящий из трех частей, идущих последовательно друг за другом:
Given — ключевое слово;
система уравнений, записанная в виде равенств.
Find(x1... ,хn) — встроенная функция для решения системы относительно переменных х1, ...xn.
Блок Given/Find использует для поиска решения итерационные методы, поэтому перед ключевым словом Given требуется задать начальные значения для всех х. Значение функции Find есть вектор, составленный из решения каждой переменной. Таким образом, число элементов вектора равно числу аргументов Find.
Например, необходимо найти решение системы уравнений:
![]()
В программе MathCad запись решения системы будет выглядеть следующим образом:
Присваиваем начальные значения переменным х и y:
![]()
Вводим операторы блока Given/Find и систему уравнений:
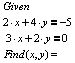
Знак
равенства [![]() ] в системе уравнений вводится с помощью
комбинации клавиш
[Ctrl]+[=]; знак
равенства после оператора
Find
служит для вывода результата на экран
и вводится с клавиатуры нажатием обычного
символа [=].
] в системе уравнений вводится с помощью
комбинации клавиш
[Ctrl]+[=]; знак
равенства после оператора
Find
служит для вывода результата на экран
и вводится с клавиатуры нажатием обычного
символа [=].
