- •Раздел I. Кинетика ферментативных процессов
- •1.1. Формальная кинетика
- •Закон действующих масс
- •Константа скорости реакции
- •Порядок химической реакции
- •Обратимые химические реакции
- •Влияние температуры на скорость химической реакции
- •Кинетика реакций Реакции первого порядка
- •Кинетическое уравнение реакции второго порядка
- •Метод Гуггенгейма
- •1.2. Кинетика ферментативных реакций Механизм действия ферментов
- •II. Уменьшить энергию активации
- •Уравнение Михаэлиса-Ментен
- •1. Зависимость от концентрации фермента
- •2. Зависимость скорости реакции от концентрации субстрата.
- •2 . Метод Хейнса
- •3 . Метод Скэтчарда (Иди–Хофсти)
- •Ингибирование ферментов
- •Конкурентное ингибирование
- •Графическое определение параметров конкурентного ингибирования
- •Бесконкурентное ингибирование
- •Графические методы определения параметров бесконкурентного ингибирования
- •1. Лайнуивера-Берка
- •2 . Хейнса
- •4. График Диксона
- •Неконкурентное ингибирование
- •1. Метод Лайнуивера-Берка
- •4. График Диксона
- •1. Общие сведения.
- •2. Ввод данных.
- •3. Построение графика.
- •4. Определение параметров поставленной задачи.
- •Лабораторная работа № 2. Определение кинетических параметров ферментативной реакции.
- •Задание для самостоятельной подготовки
- •Задание к работе.
- •Задания к лабораторной работе 2 Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10.
- •Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Р аздел іі. Изучение динамических моделей биологическихпроцессов Общие принципы описания кинетического поведения биологических систем
- •Качественное исследование простейших моделей биологических процессов
- •Простейшие математические модели
- •1. Модель экспоненциального роста популяций
- •Решение представляет собой формулу экспоненциального роста
- •2. Модель сезонного роста
- •3. Модель логистического роста
- •Качественные методы исследования систем дифференциальных уравнений
- •Устойчивость стационарного состояния. Фазовые портреты
- •Модели биологических процессов, описываемые системой дифференциальных уравнений
- •1. Виды конкурируют за одну и ту же пищу, запасы которой ограничены
- •2. Модель логистического роста (модель плотностного давления)
- •3. Модель хищник – жертва Вольтерра
- •4. Биологический метод борьбы с нежелательным видом. Метод Кюрасао.
- •Мы изучаем наиболее простую модель, предложенную Базыкиным.
- •Возможности MathCad, которые можно использовать при изучении темы
- •1. Символьное решение определителя матрицы для нахождения корней характеристического уравнения
- •2. Нахождение частных производных с помощью программы MathCad
- •3. Символьное решение уравнений и систем уравнений
- •Лабораторная работа 1 Численные методы решения дифференциальных уравнений и систем дифференциальных уравнений
- •I. Изменение численности популяции описывается одним дифференциальным уравнением
- •Задание 1
- •Задание 2
- •Изменение численности популяции описывается системой уравнений. Один вид ведет себя по отношению к другому как хищник Задание 3
- •Задание 4
- •Лабораторная работа № 2 Математические модели распространения инфекционных заболеваний Модель 1
- •Модель 2.
- •Модели эпидемий с переносчиками
- •Раздел ііі. Термодинамика биологических процессов обзор по равновесной термодинамике
- •1. Первый и второй законы термодинамики
- •Второй закон термодинамики
- •Энтропия и вероятность состояния
- •2. Характеристические функции
- •Для равновесных процессов:
- •Для неравновесных процессов:
- •Самопроизвольные процессы при постоянных t и p
- •Полезная работа и приращение свободной энергии
- •Выражение для свободной энергии в явном виде
- •Стандартные состояния. Стандартные условия
- •Химический потенциал
- •Электрохимический потенциал
- •Расчеты стандартных энергий биохимических реакций
- •Описание систем в термодинамике неравновесных процессов
- •1. Второй закон термодинамики в открытых системах
- •Особенности открытых систем
- •Возрастание энтропии вследствие необратимых процессов внутри открытых систем
- •Диссипация энергии в скалярных необратимых процессах
- •Диссипация энергии в векторных необратимых процессах
- •Диссипация свободной энергии в сопряженных скалярных и векторных процессах
- •Соотношения между значениями движущих сил и скоростей процессов. Соотношения Онзагера
- •Примеры линейных соотношений
- •– Соответствуют возможной взаимосвязи двух потоков и носят название коэффициентов взаимности Онзагера.
- •Пример:
- •Теорема Пригожина.
- •Список рекомендованной литературы Основная литература
- •Дополнительная литература
Министерство образования и науки Украины
Донецкий национальный университет
БИОФИЗИКА
Ферментативная кинетика. Динамические модели и термодинамика биологических процессов.
Теория. Лабораторный практикум.
для студентов специальности «биология»
Донецк 2010
ББК ЕО*71р30–21
Биофизика. Ферментативная кинетика. Динамические модели и термодинамика биологических процессов. Теория. Лабораторный практикум. Для студентов специальностей «биология» //Сост. О.И. Доценко, Г.В. Тарадина.– Донецк, ДонНУ, 2010.– 105 с.
Составители: О.И. Доценко, к.х.н., доцент
Г.В. Тарадина, ст. преподаватель
Раздел I. Кинетика ферментативных процессов
1.1. Формальная кинетика
Чтобы произошла химическая реакция, необходимо взаимодействие между молекулами веществ, вступающих в реакцию. Это взаимодействие происходит из-за столкновения молекул. Однако не каждое столкновение приводит к образованию продуктов реакции; для того чтобы произошла химическая реакция, необходимо, чтобы энергия взаимодействующих молекул была не меньше некоторой критической величины, называемой энергией активации. При этом для каждой химической реакции существует своя энергия активации, зависящая от природы реагирующих веществ.
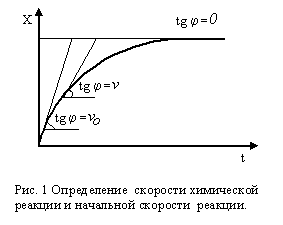
Скорость химической реакции определяется как количество вещества, образующееся (распадающееся) в единицу времени в процессе химической реакции. Размерность скорости химической реакции: концентрация/время. Например, моль/мин.
![]() ,
где X-
субстрат реакции;
,
где X-
субстрат реакции;
![]() ,
где P-
продукт реакции.
,
где P-
продукт реакции.
Рис. 1.1.1. Определение скорости химической реакции и начальной скорости реакции |
Скорость
химической реакции, наблюдающаяся в
начальный момент времени, когда
существенные изменения концентрации
реагирующих веществ не успели произойти,
называется начальной скоростью
химической реакции и обозначается
|
Закон действующих масс
Скорость реакции при постоянной температуре пропорциональна произведению концентраций реагирующих веществ, возведенных в степень, соответствующей их стехиометрическим коэффициентам. Например,
![]()
![]() (1)
(1)
Если
в реакцию вступает несколько веществ
![]() ,
то формально скорость реакции зависит
от их концентрации следующим образом:
,
то формально скорость реакции зависит
от их концентрации следующим образом:
![]() (2),
где
(2),
где
k— коэффициент пропорциональности (константа скорости);
![]() —
стехиометрические
коэффициенты.
—
стехиометрические
коэффициенты.
Уравнения (1) и (2) называют кинетическим законом действующих масс.
Константа скорости реакции
Величину
![]() в уравнениях (1) и (2) называют константой
скорости химической реакции. Константа
скорости тем больше, чем быстрее протекает
реакция. Она не меняется при одних и тех
же условиях проведения эксперимента
и не зависит от концентрации веществ,
вступающих в реакцию. Константа скорости
может изменяться при изменении условий
проведения реакции (температура,
давление, рН).
в уравнениях (1) и (2) называют константой
скорости химической реакции. Константа
скорости тем больше, чем быстрее протекает
реакция. Она не меняется при одних и тех
же условиях проведения эксперимента
и не зависит от концентрации веществ,
вступающих в реакцию. Константа скорости
может изменяться при изменении условий
проведения реакции (температура,
давление, рН).
Константа скорости химической реакции отражает число активных соударений между молекулами веществ, вступающих в химическую реакцию, приводящих к образованию продуктов реакции. Если субстратом реакции является только одно вещество (например, для реакций распада), то константа скорости отражает вероятность химической трансформации молекул исходного вещества.
Размерность
константы скорости реакции зависит от
порядка реакции. Для реакций первого
порядка размерность константы скорости
можно найти из уравнения
![]() .
Размерность скорости —
.
Размерность скорости —![]() ,
концентрации —
,
концентрации —![]() .
Следовательно, размерность константы
скорости первого порядка: —
.
Следовательно, размерность константы
скорости первого порядка: —![]()
![]() .
.
Аналогичным
образом можно показать, что для реакций
второго порядка размерность константы
скорости — произведение обратных
концентрации и времени
![]() .
.