
- •1. Олексій Петровч Остапенко 2. Олексій Миколайович Макаревський (1854—1916) [1863—1842]
- •3. Володимир Іванович Зайцев [1903—1973)
- •4. Антонім Васильович Синьок j1903—1973j
- •Основні методи дослідження
- •8. Техніка дигітальної перкусії
- •Термометрія
- •Глава II
- •Симптоми хвороб
- •Синдроми хвороб
- •Прогноз хвороби
- •Історія хвороби
- •Глава III дослідження загального стану тварин
- •Дослідження габітусу
- •Дослідження шкіри
- •Аналіз результатів термометрії
- •18. Постійна гарячка
- •Глава IV дослідження серцево-судинної системи
- •Тони серця
- •23. Схема тонів серця:
- •Шуми серця
- •Діагностика пороків серця
- •29. Схема електричне? активності Ізольованого м'язового волокна
- •32. Векторелектрокардіограма
- •Вимірювання артеріального кров'яного тиску.
- •Аритмії серця
- •36. Електрокардіограма коня. Шлуночко-•а екстрасистолія (за Судаковим м. О.|
- •Основні синдроми серцево-судинної недостатності
- •Глава V дослідження дихальної системи
- •Дослідження носа
- •42. Огляд слизоіОі оболонки носа у коня
- •Дослідження гортані та трахеї
- •Дослідження грудної клітки
- •49. Збільшення язика при актиномікозі (за Левченком в. І.)
- •Дослідження глотки
- •50. Зовнішня пальпація глотки
- •51. Техніка внутрішньої пальпації глотки
- •52. Зівник і. Д. Ганжі для зонда Хохлова
- •Дослідження черева
- •53. Руменограф 3. С. Горяїнової
- •54. Перкусія і аускультація при зміщенні сичуга (за Dirksen g.)
- •. Дослідження шлунка свиней
- •Дослідження шлунка собак
- •, Дослідження кишечника
- •58. Положення внутрішніх органів коня (вигляд справа]:
- •Цевидна залоза
- •59. Попе перкусії черевних органів у коня (вигляд зліва):
- •Маклака, п - пін,я плечового суглоба; пусті місця поля перкусії - голосний тимпанічний звук- плюси — притуплано-тимпанічний, мінуси — притуплений звук; крапки — тупий звук
- •60. Поле перкусії черевних органів у коня (вигляд справа):
- •61. Положення внутрішніх органів свині (вигляд зліва):
- •63. Грудна та черевна порожнина собаки (з правого боку):
- •Глава VII дослідження печінки
- •' Методи дослідження печінки
- •Загальноклінічні методи дослідження печінки
- •65. Абсцеси печінки (за Лев ченком в. І.
- •Глава VIII дослідження сечової системи
- •Дослідження сечовиділення
- •Дослідження нирок
- •Дослідження сечоводів
- •Дослідження сечового міхура
- •68. Катетеризація сечового міхура у корови
- •Дослідження уретри
- •Дослідження сечі
- •Фізичні властивості сечі
- •Хімічне дослідження сечі
- •Дослідження осаду сечі
- •Глава IX дослідження нервової системи
- •Дослідження поведінки тварин
- •Дослідження черепа та хребта
- •Дослідження органів чуття
- •Дослідження чутливості
- •69. Схрещування передніх кінцівок у корови при гіперестезії внутрішнього боку лівої кінцівки (за Dirksen g., 1990)
- •Дослідження рухової сфери
- •Дослідження рефлексів
- •Дослідження ліквору
- •Глава X дослідження системи крові
- •Методи одержання крові
- •Біохімічне дослідження крові
- •Визначення резервної лужності і кислотної місткості крові
- •Визначення загального білка і білкових фракцій
- •71. Атомний абсорбційний спектрофотомер aas-30
- •11. Вміст загального кальцію та неорганічного фосфору в сироватці крові здорових тварин
- •Визначення мікроелементів
- •Визначення в крові глюкози
- •Визначення кетонових тіл
- •72. Гемоцитометр гцмк-3
- •Дослідження селезінки
- •Дослідження імунної системи
- •Глава XI діагностика порушень обміну речовин
- •Глава XII дослідження залоз внутрішньої секреції
- •Глава XIII особливості дослідження птахів дослідження ембріонів
- •Дослідження птахів
- •Глава XIV основи ветеринарної рентгенології
- •Рентгенівські апарати
- •Техніка безпеки при роботі з рентгенівськими апаратами
- •Застосування рентгенівського дослідження для діагностики захворювань серцево-судинної системи
- •Глава XV
- •Глава VII. Дослідження печінки (Влізло в. В) . ...... 198
- •Глава VIII. Дослідження сечової системи (Коляда м в.,
- •Глава IX. Дослідження нервової системи (Коляда м. В.) . . 234
- •Глава X. Дослідження системи крові (Левченко в. І.) ... 254
- •Глава XII. Дослідження залоз внутрішньої секреції (Кондрахін і. П.) ................... 327
- •Глава XIII. Особливості дослідження птахів (Байдевля-тов а. Б )....................
- •Глава XIV. Основи ветеринарної рентгенології (Коляда м. В.) .................... : 337
- •Глава XV. Ультразвукова діагностика (ехографія, сонографія;
Визначення кетонових тіл
Кетонові тіла (бета-оксимасляна та ацето-оцтова кислоти, ацетон) утворюються головним чином у печінці, менше в нирках, стінках передшлунків, молочній залозі. Вони є звичайними метаболітами обміну вуглеводів, жирів і деяких амінокислот, при розпаді яких утворюється оцтова кислота у вигляді сполуки з коферментом ацетилювання — ацетил ~КоА. Активована оцтова кислота в подальшому окислюється у циклі трикарбонових кислот, початковим етапом якого є реакція конденсації з щавлевооцтовою кислотою (ЩОК). Окислення її блокується нестачею ЩОК, основним джерелом якої є глюкоза. В такому випадку дві молекули ацетил -~ КоА конденсуються з утворенням ацетоацетил ~ КоА,. який є джерелом ацетону, ацетооцтової і бета-оксимасляної кислот.
У крові, сечі та молоці завжди є незначна кількість кетонових тіл. Підвищення їх рівня у крові (кетонемія) супроводжується посиленим виділенням їх через нирки (кетонурія), молочну (кето-нолактія) і потові залози та легені.
Вміст кетонових тіл у крові визначають йодометричним методом (за Енгфельдом у модифікації М. Лейтеса та А. І. Оди-нової), колориметричним методом Нейтельсона, а також експрес-методом з реактивом Лестраде. В нормі, за даними І. П. Кондра-хіна, у здорових тільних сухостійних корів вміст кетонових тіл становить 2,5—б мг/100 мл (0,4—1,03 ммоль/л), у корів через 2—5 днів після отелення — 6—8, а через ЗО днів — 5,5— 7 мг/100 мл. У високопродуктивних корів порівняно з низькопродуктивними вміст кетонових тіл вищий. Основна кількість їх у крові (82—87 %) припадає на частку бета-оксимасляної кислоти.
Експрес-методом з реактивом Лестраде кетонові тіла в крові визначають при їх мінімальному вмісті 10 мг/100 мл (1,72 ммоль/л). Швидкість появи забарвлення і його інтенсивність пропорціональні концентрації кетонових тіл у досліджуваній пробі. Якщо інтенсивне забарвлення з'являється негайно, то це є показником наявності в пробі 50—80 мг/100 мл і більше кетонових
27Г
тіл, через 1 хв — ЗО—50; ледь помітне забарвлення після 3 хв — 10—30 мг/100 мл.
Стійка кетонемія зустрічається у тварин при гострому та під-гострому перебігах кетозу, цукровому діабеті. При цьому змінюється співвідношення між окремими компонентами кетонових тіл у бік збільшення вмісту токсичніших продуктів — ацетону та аце-то-оцтової кислоти. Помірна кетонемія супроводжує різні хвороби: пневмонію, гепатоз і гепатит, міоглобінурію, гнійний мастит, ендометрит, причому підвищення концентрації кетонових тіл переважно відбувається за рахунок бета-оксимасляної кислоти.
ВИЗНАЧЕННЯ БІЛІРУБІНУ В СИРОВАТЦІ КРОВІ
Білірубін є одним з кінцевих продуктів пігментного обміну. Через ряд проміжних стадій з гему зруйнованих еритроцитів утворюється непрямий (вільний, некон'югований, непроведений через лечінку) білірубін, який е нормальною складовою частиною сироватки крові (див. главу VII). Він нерозчинний у воді і тому не виводиться з сечею. У клітинах печінки непрямий білірубін сполучається з глюкуроновою кислотою, утворюється прямий, зв'язаний (кон'югований), проведений через печінку білірубін (холебі-лірубін). Сума вільного та кон'югованого білірубіну становить загальний білірубін.
Вміст білірубіну та його фракцій у сироватці крові визначають за методом Ієндрашика, Клеггорна і Грофа. Проведений через печінку (кон'югований) білірубін реагує безпосередньо з діазо-реактивом (тому його ще називають прямим), а непроведений має аналогічну реакцію лише після дії прискорювачів, до яких •належать кофеїновий або інші реактиви.
Збільшення вмісту білірубіну в сироватці крові більше наведених у таблиці 14 показників називають білірубінемією.
Білірубінемія спостерігається при захворюваннях, які супроводжуються гемолізом еритроцитів за рахунок збільшення у крові яепрямого (вільного або непроведеного через печінку) білірубіну (піроплазмідози, лептоспіроз, отруєння гемолітичними отрутами).
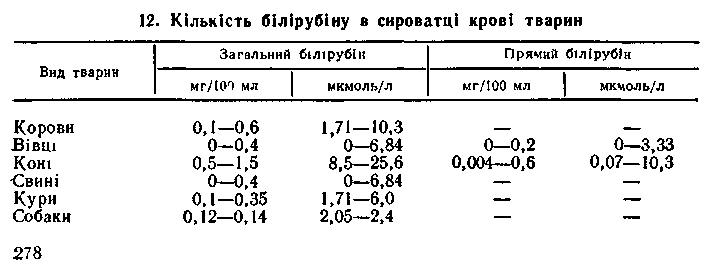
Печінка в таких випадках не встигає переробити в прямий білірубін велику кількість непрямого, який утворився з гемоглобіну зруйнованих еритроцитів. Значне збільшення вмісту прямого білірубіну (проведеного через печінку, зв'язаного) в сироватці крові буває у випадку механічної жовтяниці, коли внаслідок порушення жовчовиділення нагромаджується жовч, підвищується тиск у жовчних шляхах, що зумовлює перехід жовчі в кров'яне русло.
Ураження гепатоцитів порушує перетворення непрямого білірубіну в прямий і подальше виділення останнього в жовчні капіляри, тому в крові підвищується вміст обох фракцій білірубіну (паренхіматозна жовтяниця).
ВИЗНАЧЕННЯ АКТИВНОСТІ ФЕРМЕНТІВ
За останні роки значного розвитку досягла клінічна ферментологія, одним з напрямків якої є визначення активності ферментів з метою діагностики різних хвороб. Основою для цього є органо-специфічність деяких ферментів, тобто локалізація їх лише в одному з органів. При запальних і дистрофічних процесах ферменти з клітин елімінуються (вимиваються) у кров, внаслідок чого активність їх в крові підвищується, що й дає змогу виявляти патологію даного органа. Підвищення активності органоспецифічного ензиму буде патогномічним показником патології. Так, органоспецифіч-ними ферментами печінки є сорбітолдегідрогеназа (СДГ), аргіна-за, орнітинкарбамілтрансфераза (ОКТ), глутаматдегідрогеназа (ГДГ), уроканіназа, п'ята фракція лактатдегідрогенази (ЛДГ5); див. главу VII).
Для міокарда органоспецифічним є перший ізофермент лактатдегідрогенази (ЛДГ), визначення якого можна з успіхом застосовувати для диференціації органічних і функціональних порушень міокарда.
Ряд ферментів локалізується в кількох органах і тому підвищення їх активності є типовим показником патології. Такі ферменти, як і органоспецифічні, називають індикаторними. До їх числа, наприклад, належать аспарагінова (АсАТ) і аланінова (АлАТ) трансамінази, альдолаза, холінестераза, лактатдегідрогеназа, гамма-глутамілтрансфераза, креатинкіназа. Виявивши, наприклад, підвищення активності АсАТ у сироватці крові великої рогатої худоби можна вести мову про порушення структури печінки, міокарда або скелетних м'язів. Активність креатинфосфо-кінази підвищується при білом'язовій хворобі молодняка та інфаркті міокарда.
Визначення активності ферментів дає змогу поставити діагноз на ранній стадії хвороби. Так, при патології печінки активність трансаміназ підвищується значно раніше, ніж з'являються зміни білкових фракцій, кількості білірубіну, а при D-гіповітамінозі най-
27»
«більш раннім показником патології є підвищення активності кісткового (термолабільного) ізоферменту лужної фосфатази. Раніше інших тестів при патології міокарда реагують креатинкіназа і ЛДГ,.
Деякі ферменти та їх ізоферменти локалізуються у цитоплазмі клітини або в різних її органелах та ділянках органа, тому визначення їх активності дає змогу характеризувати ступінь пошкодження паренхіми органа або ж уточняти місце локалізації патологічного процесу. Так, значне підвищення активності ГДГ, поява мітохондріальних ізоферментів АсАТ у сироватці крові є показником глибоких структурних пошкоджень гепатоцитів, оскільки мітохондріальна мембрана щільніша і стійкіша порівняно з клітинною.
Завдяки підвищенню в крові активності гамма-глутамілтранс-ферази (ГГТ) та печінкового ізофермента лужної фосфатази можна уточнити місце локалізації патологічного процесу (запалення жовчних протоків — холангіт), і встановити, чи дане захворювання або інші хвороби печінки (гепатит, гепатоз, цироз) супроводжуються затримкою виділення жовчі (холестазом).
Диференціальна діагностика похожих за клінічними проявами хвороб є нерідко надто важким завданням. Багато біохімічних критеріїв виявилися несприйнятливими для диференціації хвороб. Використання ферментних тестів у таких випадках значно поліпшило діагностичні можливості. Переконливим прикладом може •бути визначення трансаміназ або СДГ і ГГТ для диференціації печінкової і механічної жовтяниць (перші два ферменти змінюються при печінковій, а ГГТ — при механічній). У медицині для диференціації інфаркту міокарда та стенокардії велике значення має визначення активності креатинкінази і аспартат-амінотранс-ферази (КК і АсАТ). Інколи для диференціації патології важливі дані можна одержати при визначенні окремих ізоферментів одного й того ж ферменту. Наприклад, при рахіті у молодняка великої рогатої худоби підвищується активність кісткового ізоферменту, при ураженні печінки — печінкового, кишечника — кишкового (Левченко В. І., 1986). Досить показовими є зміни ізоферментів лактатдегідрогенази (ЛДГ) — активність першої фракції підвищується при ураженні міокарда, а п'ятої — печінки.
Ферменти зарекомендували себе надійними критеріями, які досить чітко характеризують перебіг хвороби (гострий, хронічний) і її можливі загострення. За даними Б. В. Уша, наприклад, активність АсАТ при гострому перебігу гепатиту підвищується у 5— 10 разів, а при хронічному — в 1,5—3 рази.
У клінічній практиці ензими використовують для оцінки ефективності лікування, ступеня видужання, прогнозу. Відсутність змі-яи активності ферментів на фоні застосування лікарських препаратів є показником низької ефективності терапії. Ферменти вияви-
.280
лися інформативнішими показниками порівняно з Іншими біохімічними тестами при оцінці ступеня видужання. Так, визначення активності аспарагінової трансамінази (АсАТ) достовірніше відображає репаративні процеси в печінці при гепатиті та гепатозі,, ніж вміст білірубіну (Головаха В. І., 1994).
Накінець, визначення деяких ферментів застосовують для прогнозування закінчення хвороби. Наприклад, стійке зниження активності холінестерази при хронічному гепатиті є показником прогресуючої патології і несприятливого прогнозу.
Ферментна діагностика у ветеринарній медицині України лише набирає розвитку. Однак, як показує зарубіжний досвід, за нею велике майбутнє.
ДОСЛІДЖЕННЯ МОРФОЛОГІЧНОГО СКЛАДУ КРОВІ
У клінічній практиці дослідження морфологічного складу крові включає підрахунок еритроцитів, лейкоцитів, тромбоцитів, виведення лейкограми, вивчення патологічних змін клітин крові.
Підрахунок кількості еритроцитів. Еритроцити є носіями гемоглобіну, який забезпечує організм киснем, переносить вуглекислий газ із тканин у легені, бере участь в регуляції кислотно-основного балансу (гемоглобіновий буфер) та у ряді ферментативних процесів, транспортує до тканин амінокислоти, ліпіди, адсорбує токсини.
Утворення еритроцитів (еритропоез) відбувається у червоному кістковому мозку. Початковим елементом є еритропоетинчутлива клітина, яка послідовно диференціюється в еритробласт, пронор-моцит (пронормобласт), нормоцити (нормобласти)—базофіль-ний, поліхроматофільний, оксифільний, ретикулоцит і еритроцит. У периферичній крові знаходять лише зрілі еритроцити, але при патології можуть з'являтися і ядерні — нормоцити (нормобласти).
Тривалість життя еритроцитів ПО—130 днів, руйнуються вони (гемолізуються) у фагоцитуючих макрофагах селезінки, печінки, легень, лімфатичних вузлів та інших органів.
Кількість еритроцитів підраховують за допомогою мікроскопа в лічильних камерах, серед яких найбільшого поширення набула камера з сіткою Горяєва, або в лабораторних кюветах, де сітка Горяєва нанесена на накривне скло. Кров попередньо розбавляють у меланжерах (кровозмішувачах) в 200 або 100 разів (кров набирають до мітки 0,5 або 1, а розбавлювач — до мітки 101) або в пробірках (метод П'ятницького). В останньому випадку в пробірку набирають 3,98 мл рідини, а потім капіляром від гемометра вносять 0,02 мл крові (одержують розбавлення у 200 разів). Для розбавлення крові при підрахунку еритроцитів використовують 0,85%- або частіше 3%-ний розчин натрію хлориду. Підрахунок проводять у п'яти великих квадратах, кожний з яких розділений
28)
