
Современные проблемы и методы биотехнологии
.pdf
ГЛАВА 2. СОВРЕМЕННЫЕ УСПЕХИ ГЕНОМИКИ: ТРАНСГЕННЫЕ ОРГАНИЗМЫ
2.3. Трансгенные растения и животные как биореакторы
(сайленсинга, см. п. 2.3.2). РНК-интерференция – консервативный посттранскрипционный регуляторный процесс. Двухцепочечные малые интерферирующие миРНК в 19–23 нуклеотида специфически связываются с комплементарной последовательностью своей матричной мРНК-мишени, направляя ее по пути деградации. РНК-интерференция является составной частью системы генной регуляции, а именно контролирует/супрессирует трансляцию мРНК из эндогенных и экзогенных вирусных элементов и может быть использована для терапевтических целей. Для транзиентного выключения гена синтетические миРНК трансфецируют в клетки или ранние эмбрионы. Для стабильной генной репрессии последовательность миРНК должна быть инкорпорирована в геном в составе экспрессионной генной конструкции. Очень эффективна комбинация лентивирусных векторов с миРНК для интеграции в геном. В противоположность классической нокаут-стратегии, которая требует длительного скрещивания для получения чистой линии с инактивированным геном в обоих локусах диплоидного генома, миРНК при интеграции могут легко выключить целевой ген в любой имеющейся линии животных.
Несмотря на разработанный широкий спектр методик получения трансгенных животных, в настоящее время пока отсутствует надежная и эффективная технология трансгеноза животных. Самые большие проблемы связаны с беспорядочным встраиванием экзогенной ДНК в геном при использовании большинства существующих методов. Так что дальнейшие качественные улучшения технологии необходимы в области разработки прицельной модификации клеточных генов и точного встраивания экзогенной ДНК в геном. Тем более что геномы большинства хозяйственно важных организмов к настоящему времени полностью секвенированы и можно планировать будущую структуру трансгенного организма. Сочетание полностью расшифрованных последовательностей геномов с методами адресной доставки экзогенной ДНК позволит проводить целенаправленное конструирование трансгенных геномов с заранее заданными свойствами.
2.3.7. Применениетрансгенныхживотных
По применению трансгенных животных можно разделить на пять основных категорий: научные модели, модели для изучения болезней человека, источники для производства фармацевтических препаратов, источники ксенотрансплантантов и источники пищи. Большинство из обсуждаемых ниже областей коммерческого применения трансгенных животных в настоящее время находятся на ранних этапах исследований и разработки, за некоторыми исключениями. Так, с 2004 г. в зоомагазинах некоторых стран (США, Тайвань, Китай, Малайзия) продаются декоративные трансгенные рыбки, окраска которых обусловлена присутствием флуоресцентных белков из кораллов. Важной вехой в истории применения трансгенных животных стал 2006 г., когда Европейское медицинское агентство (the European Medicines Agency (EMEA)) выдало первое разрешение на коммерческое использование первого
Современные проблемы и методы биотехнологии. Учеб. пособие |
111 |

ГЛАВА 2. СОВРЕМЕННЫЕ УСПЕХИ ГЕНОМИКИ: ТРАНСГЕННЫЕ ОРГАНИЗМЫ
2.3. Трансгенные растения и животные как биореакторы
рекомбинантного белка из молока трансгенного животного. Им стал рекомбинантный антитромбин III с коммерческим названием ATryn, который предназначен для профилактического лечения пациентов с врожденной антитромбиновой недостаточностью.
Научные модели. Сложность генома млекопитающих, длительные периоды взросления и размножения, трудности изучения большого числа индивидуальных животных с учетом варьирования признаков делают генетический анализ этих систем затруднительным. Трансгенная технология несет в себе большие возможности, в первую очередь, для фундаментальных исследований принципов функционирования геномов и отдельных генов. Например, линии нокаутных мышей, гомозиготных по направленно-инактивированным генам, позволяют изучать детерминируемые данными генами свойства на уровне организма. Регулируемые системы экспрессии трансгенов дают возможность исследовать тонкие механизмы воздействия продуктов того или иного гена на физиологию и эмбриональное развитие животных.
Модельные системы для изучения болезней человека. Используя це-
лых животных, можно моделировать возникновение патологии, исследовать ее развитие и способы лечения. И хотя данные, полученные на трансгенных моделях, не всегда можно экстраполировать на человека в медицинских аспектах, они позволяют выявить ключевые моменты этиологии сложной болезни, ее молекулярные основы и подсказать пути лечения. В настоящее время на мышах смоделированы такие заболевания человека, как СПИД, болезнь Альцгеймера, артрит, мышечная дистрофия, гипертония, образование опухолей, нейродегенеративные нарушения, дисфункция эндокринной системы, сердечно-сосудистые заболевания и многие другие. Получена дрозофила с болезнью Паркинсона.
Источники для производства фармацевтических белков. Сущест-
вующие методы получения в культурах клеток рекомбинантных человеческих протеинов для медицинских целей имеют ряд существенных недостатков и жестких законодательных ограничений. Одной из особенностей таких медицинских препаратов является их крайне высокая цена, обусловленная в том числе высокой стоимостью клеточного культивирования. Преодолеваяэти ограничения, большое количество белков можно получать из молока трансгенных животных, несущих человеческие гены, ответственные за выработку определенного протеина, под контролем промоторов, специфичных для молочных желез. Предполагается, что выход может составить до 35 гбелка из одного литра молока при относительно невысокой стоимости производства и очистки.
Человеческие белки, секретируемые в молоко, гликозилируются соответствующим образом и обладают активностью, близкой к нативным белкам человека. Экспрессия трансгенов в клетках молочных желез овец и коз не оказывала никаких побочных действий ни на самок в период лактации, ни на вскармливаемое потомство. В настоящее время многочисленные белки получены в больших количествах эффективной секрецией в молоко трансгенных мышей, кроликов, овец, свиней, коз и коров. Часть рекомбинантных белковых препаратов из молока трансгенных животных уже готовится к выходу на
Современные проблемы и методы биотехнологии. Учеб. пособие |
112 |
ГЛАВА 2. СОВРЕМЕННЫЕ УСПЕХИ ГЕНОМИКИ: ТРАНСГЕННЫЕ ОРГАНИЗМЫ
2.3. Трансгенные растения и животные как биореакторы
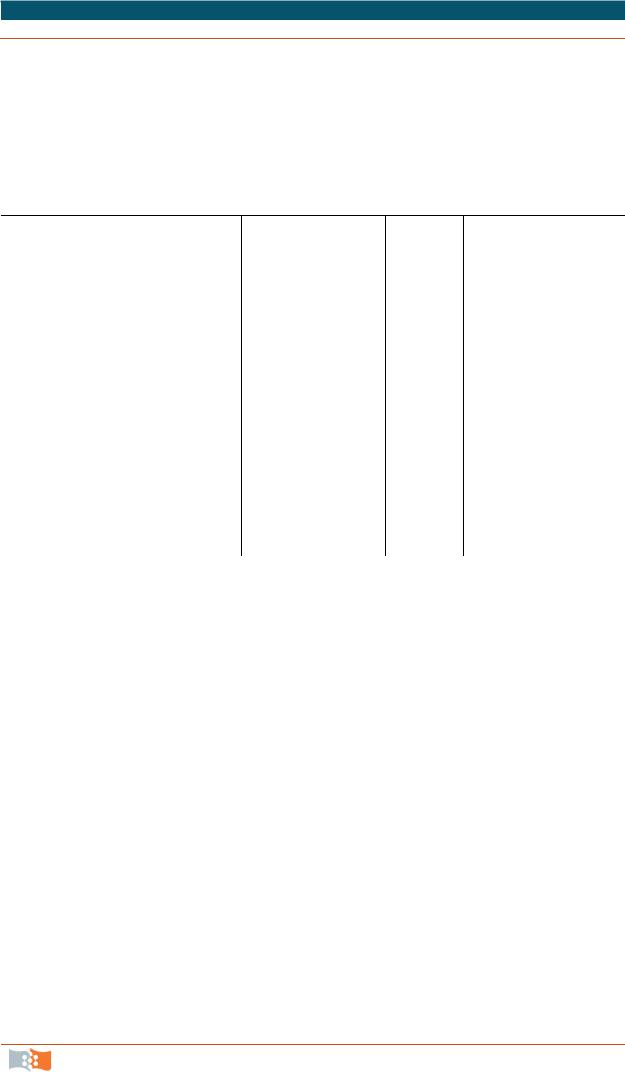
рынок (табл. 2.3). Первым препаратом из молока стал ATryn (человеческий антитромбин III), который в 2006 г. после 3-й фазы клинических испытаний был зарегистрирован как лекарство в Европейском союзе.
Таблица 2.3
Терапевтические белки из молока трансгенных животных, готовящиеся к выпуску на фармацевтический рынок
|
|
Живот- |
|
Продукт |
Компания |
ное- |
Этап выхода на рынок* |
|
|
источник |
|
ATryn, рекомбинантный анти- |
GTC Biotherapeutics |
Коза |
ЕС: выход на рынок |
тромбин III человека |
|
|
США: фаза 3 |
С1 эстеразный ингибитор |
Pharming |
Кролик |
Фаза 3 |
MM-093 (AFP), альфа-фетопротеин |
Merrimack and GTC |
Коза |
Фаза 2 |
|
Biotherapeutics |
|
|
Альфа-глюкозидаза |
Pharming |
Кролик |
Фаза 2, ожидание |
Человеческий гормон роста |
BioSidus |
Корова |
Доклинический |
Альбумин |
GTC Biotherapeutics |
Корова |
Доклинический |
Фибриноген |
Pharming |
Корова |
Доклинический |
Коллаген |
Pharming |
Корова |
Доклинический |
Альфа-1-антитрипсин |
Pharming |
Корова |
Доклинический |
Лактоферрин |
GTC Biotherapeutics |
Коза |
Доклинический |
Малярийная вакцина |
GTC Biotherapeutics |
Коза |
Доклинический |
CD 137 (4–1BB) MAb, монокло- |
GTC Biotherapeutics |
Коза |
Доклинический |
нальные антитела |
|
|
|
* Фазы 2 и 3 – фазы клинических испытаний
Успешная регистрация препарата ATryn продемонстрировала правильность такого подхода к продукции терапевтических белков и облегчила путь на рынок другим рекомбинантным препаратам из молока трансгенных животных, а также стимулировала научную и коммерческую активность в данной области.
Другим источником продукции рекомбинантных белков является кровь трансгенных животных. Получены трансгенные бычки, продуцирующие биспецифичные антитела человека в своей крови. Эти антитела после очистки из сыворотки были очень стабильны и соответствующим образом стимулировали Т-клеточное уничтожение раковых клеток.
Получение трансгенных цыплят открыло возможность использовать яйца, содержащие немало запасных белков для накопления нужных рекомбинантных белков – активных компонентов лекарственных средств. В этом случае белки можно получать в больших количествах, и их производство будет дешевым, так как сырьем для этого является всего лишь птичий корм. В институте Рослин, где была клонирована Долли, разработаны 2 линии трансгенных кур с перспективой на коммерческое применение. Одна из линий несет яйца с антителами miR24 в яичном белке, с помощью которых можно будет лечить злокачественную меланому – форму рака кожи, другая
Современные проблемы и методы биотехнологии. Учеб. пособие |
113 |

ГЛАВА 2. СОВРЕМЕННЫЕ УСПЕХИ ГЕНОМИКИ: ТРАНСГЕННЫЕ ОРГАНИЗМЫ
2.3. Трансгенные растения и животные как биореакторы
производит человеческий интерферон β-1a, который может быть использован для остановки внутриклеточного размножения вирусов. Разрешение на клинические испытания препарата против рака на основе куриных яиц уже получено. В настоящее время продолжаются работы по увеличению выхода рекомбинантных белков, как на стадии производства, так и на стадии очистки.
Чтобы обезопасить рекомбинантные продукты, руководство, разработанное в США и Европейско м союзе для получения ГМ-животных, требует контролировать здоровье трансгенных животных, проверять корректность полученных трансгенных конструкций, характеризовать очищенный рекомбинантный белок, а также провести новую трансгенную линию через несколько поколений.
В России также ведутся разработки в области получения трансгенных животных для биопродукции важных белков. Например, существует государственная программа, нацеленная на создание фармакологического производства человеческого лактоферрина путем секреции в молоко коз. Сильные антибактериальные свойства лактоферрина, содержащегося в грудном молоке, защищают новорожденных детей от инфекций, поэтому получение молока с лактоферрином в больших количествах может стать новой отраслью производства детского питания.
Трансгенные животные как источники ксенотрансплантантов для человека. Хронический дефицит человеческих органов для трансплантации
вынуждает ученых искать другие альтернативные источники тканей. Только в США в базе данных United Network for Organ Sharing на 2006 г. зарегистри-
ровано более 80 тыс. чел., нуждающихся в пересадке органов. Решением этой проблемы могла бы быть пересадка человеку органов животных. Так, например, органы свиньи подходят человеку по своему строению, размеру и многим биохимическим показателям, но такие пересадки невозможны, так как эти органы будут немедленно отторгнуты иммунной системой пациента.
В настоящее время ряд исследовательских центров работают над выведением генетически модифицированных свиней, органы которых могут быть использованы для трансплантации. Необходимыми условиями для успешной ксенотрансплантации являются:
1)преодоление иммунологических барьеров (гистосовместимость),
2)недопущение переноса патогенов от донорного животного человеку,
3)анатомическая и физиологическая совместимость донорного органа
счеловеческим.
С помощью соматического ядерного переноса получены животные, у которых супрессирован пока первый иммунологический барьер – реакция отторжения немедленного типа (гиперактивное отторжение). ГМ-свиньи синтезировали человеческие регуляторы комплемента (RCAs) и/или не имели генов 1,3-α-galactosyltransferase (α-gal), кодирующих фермент, ответственный за выработку на поверхности клеток свиньи углеводных антигенов, которые приводят к гиперактивному отторжению. Первые эксперименты по пересадке свиных трансгенных почек и сердца нечеловекообразным приматам (павиа-
Современные проблемы и методы биотехнологии. Учеб. пособие |
114 |

ГЛАВА 2. СОВРЕМЕННЫЕ УСПЕХИ ГЕНОМИКИ: ТРАНСГЕННЫЕ ОРГАНИЗМЫ
2.3. Трансгенные растения и животные как биореакторы
ны) с иммунной супрессией показали отсутствие реакции отторжения немедленного типа, но выживаемость пересаженных органов составляла всего 2–6 месяцев. Работы по получению свиней-ксенотрансплантеров с множественными трансгенами, критичными для преодоления других иммунологических барьеров, продолжаются.
Недавние исследования показали, что риск передачи человеку свиных ретровирусов чрезвычайно мал, это открывает путь для доклинических испытаний свиных ксенотрансплантантов. Кроме того, этот факт позволяет использовать свиной эндогенный ретровирус (PERV) в качестве вектора для эффективной доставки экзогенной ДНК в клетки. После селекции такиеклетки могут стать родоначальниками трансгенных свиней-ксенотрансплантеров, полученных соматическим ядерным переносом. Также в рамках программы получения свиней для трансплантации несколько компаний занимаются выведением пород свиней с размерами органов, близкими к человеческим.
Следует отметить, что, несмотря на многолетние исследования, пересадка человеку органов свиньи все еще является отдаленным проектом.
Трансгенные животные, служащие источником пищи, еще очень далеки от коммерческого использования, хотя очень много различных вариантов уже создано. Например, в геном свиней удалось встроить несколько ускоряющих рост генов, которые также оказывают влияние на качество мяса, делая его более постным и нежным. Эта работа начата более 10 лет назад, однако в силу определенных негативных морфологических и физиологических изменений, наблюдавшихся у животных, этот вариант не был коммерциализован. Скорее всего, негативные изменения в данных трансгенных свиньях были обусловлены несовершенством использованной генетической конструкции, так что работы в этом направлении продолжаются.
Предложено также большое количество модификаций молока крупного рогатого скота, заключающихся в добавлении новых белков либо в манипуляциях над эндогенными протеинами. Например, были созданы животные, продуцирующие молоко для детского питания, по своему составу максимально приближенное к материнскому молоку человека. Другой пример – недавно ученые из Новой Зеландии получили коров с повышенным содержанием в молоке казеина. Использование такого молока должно повысить продуктивность сыроваренного производства. Еще несколько групп исследователей работают над снижением содержания в молоке лактозы. Конечной целью является создание молока, пригодного для употребления в пищу людьми с лактозной непереносимостью.
Пока ближе всех на пути к коммерциализации находятся фитазные трансгенные свиньи (экосвиньи, enviropigs), целью создания которых было резкое уменьшение навозного загрязнения окружающей среды. Эта линия несет ген бактериальной фитазы под транскрипционным контролем тканеспецифичного промотора слюнных желез. Секретируемая рекомбинантная
Современные проблемы и методы биотехнологии. Учеб. пособие |
115 |

ГЛАВА 2. СОВРЕМЕННЫЕ УСПЕХИ ГЕНОМИКИ: ТРАНСГЕННЫЕ ОРГАНИЗМЫ
2.3. Трансгенные растения и животные как биореакторы
фитаза позволяет свиньям расщеплять растительные фитаты (инозитол гексафосфат, ИГФ – наиболее распространенная нерастворимая форма органического фосфора почвы), что уменьшает выход загрязняющих окружающую среду фекальных токсичных соединений фосфора (до 75 %). Ожидается выход этих свиней на рынок в следующие несколько лет.
С учетом предполагаемого повышения потребности в рыбопродуктах ГМ-рыба может приобрести большое значение как продукт питания. Наиболее вероятно, что первым ГМ-животным на продовольственном рынке станет быстрорастущая семга (Salmo salar), в геном которой встроен ген гормона роста чавычи (Oncorhynchus tschawytscha). Такая семга растет в 3-4 раза быстрее нетрансгенных аналогов, что значительно уменьшает время выращивания. Еще, по крайней мере, 8 искусственно выращиваемых видов рыбы генетически модифицированы с целью ускорения роста. Ген гормона роста в порядке опыта встроили в геномы таких рыб, как белый амур, радужная форель, тиляпия и сом. Во всех случаях трансгены выделяли из геномов рыб других видов.
Трансгенные домашние любимцы. Пока что самым успешным случа-
ем коммерциализации трансгенных животных можно считать декоративных рыбок. Трансгенная аквариумная рисовая рыбка Oryzias latipes, яркая зеленая окраска которой обусловлена встроенным геном зеленого флуоресцентного белка из медуз, продвигается на рынок тайваньской компанией Taikong.
Под торговой маркой GloFish в США продаются (5 дол./шт.) разноцветные рыбки-зебры Danio rerio, окрашенные флуоресцентными белками кораллов. При соответствующем освещении красные, зеленые и желтые рыбки начинают ярко флуоресцировать, хотя природная окраска D. rerio скромного серого цвета. В Европе, Канаде и Австралии трансгенные рыбки запрещены, видимо, вследствие общих предубеждений против трансгенных животных. Дискуссии сторонников и противников трансгенных животных продолжаются.
2.3.8. Перспективыиспользования генетическимодифицированныхорганизмов
В течение последних 50 лет достижения генетической и молекулярной биологии обеспечили возможность создания и коммерческого использования генетически модифицированных организмов, обладающих новыми свойствами за счет преодоления межвидовых барьеров. Присущие ГМО характеристики могут оказать значительное положительное влияние на производство продуктов питания, фармакологических препаратов, ценного сырья для промышленности. Наиболее коммерциализованными из ГМО являются растения, поскольку для них процесс трансгеноза осуществляется гораздо легче и
Современные проблемы и методы биотехнологии. Учеб. пособие |
116 |

ГЛАВА 2. СОВРЕМЕННЫЕ УСПЕХИ ГЕНОМИКИ: ТРАНСГЕННЫЕ ОРГАНИЗМЫ
2.3. Трансгенные растения и животные как биореакторы
быстрее. Это обусловлено способностью растений регенерировать из единственной клетки и возможностью вегетативного размножения. В настоящее время ГМ-культуры занимают около 4 % общей площади возделываемых земель в мире. Среди культивируемых ГМ-растений первое место занимает соя, за которой следуют кукуруза и хлопок. В стадии получения разрешения на культивирование находятся сотни видов растений с измененной пищевой ценностью, повышенной продуктивностью, устойчивостью к внешней среде,
сизмененным внешним видом и т.д.
СГМ-растениями связаны надежды на преодоление дефицита продовольствия и сырья, несмотря на растущее население нашей планеты. Традиционные способы повышения продуктивности сельскохозяйственного производства себя уже исчерпали, а дефицит продуктов питания продолжает нарастать. Единственной альтернативой остается совершить качественный скачок в производстве продуктов питания путем конструирования новых видов растений с резко увеличенной хозяйственной полезностью и устойчивостью к неблагоприятным факторам культивирования.
Вотличие от растений, получение трансгенных животных – очень сложный и длительный процесс, чрезвычайно тесным образом связанный с достижениями в области молекулярных и репродуктивных технологий. В настоящее время подавляющее большинство проектов по созданию трансгенных животных находится на ранних этапах исследований и разработки, за некоторыми исключениями. Необходимость создания таких животных диктуется, в первую очередь, насущными потребностями человека в фармацевтических препаратах из человеческих белков.
Основной платформой для производства таких белков являются клеточные культуры животных и человека. Девять из десяти наиболее популярных биотехнологических лекарственных препаратов, продающихся в США, произведены в клеточной культуре клеток млекопитающих и, по крайней мере, продажи 23 белковых препаратов превышают один биллион долларов.
Появляются новые препараты, которые нужно производить в больших количествах, чтобы удовлетворить растущие потребности общества. Ожидается, что рекомбинантные антитела станут наиболее важным и успешным продуктом, особенно для применения в онкологии. Однако количество этого препарата для удовлетворения потребностей мирового рынка просто огромно– от сотни килограммов до нескольких тонн, что превышает текущие и, вероятно, будущие возможности производства на основе клеточных культур. Установлено, что при индустриальной продукции моноклональных антител в количестве ~100 кг/год стоимость грамма рекомбинантного препарата при использовании трансгенной козы будет в 3-4 раза меньше, чем в культуре CHO-клеток с дальней экономией при увеличении масштабов производства.
Для биоактивности многих человеческих белков требуется соответствующий посттрансляционный процессинг, и это главная причина использо-
Современные проблемы и методы биотехнологии. Учеб. пособие |
117 |

ГЛАВА 2. СОВРЕМЕННЫЕ УСПЕХИ ГЕНОМИКИ: ТРАНСГЕННЫЕ ОРГАНИЗМЫ
2.3. Трансгенные растения и животные как биореакторы
вания для биопродукции животных или культивируемых животных клеток, а не бактерий, дрожжей или растений. Это относится ко многим важным биомедицинским продуктам, таким как факторы свертывания крови и антитела, которые в настоящее время не имеют другой альтернативы, чем продукция в животных клетках. Таким образом, создание трансгенных животных может решить многие проблемы современного общества.
Подтверждением необходимости трансгенных организмов является бурный рост биотехнологических рынков в последние годы. Так, например, продажи на рынке биотехнологических медицинских препаратов в 2007 г. достигли более 75 млрд дол., с общим ростом в 12 ,5 %, что в два раза бол ь- ше, чем рост глобального фармацевтического рынка, согласно докладу IMS Health, из них 56% продаж пришлось на США. В 2006 г. рынок биотехнологических медицинских препаратов вырос на 18,2 % до приблизительно 65 блн дол. (биллионов). Причем основная прибыль в 2007 г. была получена большей частью за счет продаж 22 биотехнологических продуктов, приблизительно по 1 блн дол. за каждый. Для сравнения, в 2002 г. таких «блокбастеров» было только шесть. Десятку самых популярных терапевтических агентов возглавляют эритропоэтины, далее следуют противоопухолевые, антидиабетические препараты, аутоиммунные агенты и интерфероны, согласно IMS Health. В будущем ожидается большое количество противоопухолевых препаратов в сочетании со значительной неудовлетворенной потребностью в них.
Современные проблемы и методы биотехнологии. Учеб. пособие |
118 |

ГЛАВА 3 МЕДИЦИНСКАЯ БИОТЕХНОЛОГИЯ: ОСНОВЫ МОЛЕКУЛЯРНОЙ ТЕРАПИИ
И ДИАГНОСТИКИ СОЦИАЛЬНО ЗНАЧИМЫХ ЗАБОЛЕВАНИЙ
3.1. Геномчеловека
Существует точка зрения, которую разделяет немалое число специалистов, что все заболевания человека за исключением травм связаны с генетическими дефектами. Очевидно, это крайняя точка зрения, тем не менее она отражает важность генетических факторов в определении состоянии здоровья людей. Генетические дефекты бывают разной значимости и состояния. Хотя обычно считают диабет и мышечную дистрофию заболеванием, а расщепление неба или цветовую слепоту – наследственными дефектами – все это является результатом мутаций в генетическом материале. Показано также, что предрасположенность к заболеванию также зависит от генетической конституции.
Генетические дефекты или мутации в последовательности ДНК выражаются в замене одного нуклеотида другим, потере целого фрагмента или его переносе на другое положение в геноме и пр. Такие изменения могут привести к изменениям структуры (и функции) белка, который кодируется данным фрагментом ДНК или к изменению регуляторных участков генов, гибельным для клеток. Говоря о наследственных заболеваниях, мы имеем в виду мутации, которые появляются в половых клетках и передаются потомству. В соматических клетках на протяжении жизни также накапливаются мутации, которые могут стать причиной заболевания, но они по наследству не передаются. Ранее считалось, что все мутации вредны. Это связано с тем, что именно с таких мутаций, вызывающих заболевания, было начато изучение генетических характеристик человека. Но сейчас, когда прочитан практически весь нуклеотидный текст человека, стало ясно, что большая часть мутаций является нейтральной. Вредные мутации, приводящие к грубому нарушению развития организма, отсеиваются отбором – их носители не выживают или не дают потомства.
Огромный прорыв в понимании, как унаследованные гены влияют на физические и психологические особенности человека, произошел за последние десятилетия благодаря открытиям, сделанным при исследовании генома человека. Установлены и диагностируются как целый ряд генетических заболеваний, так и предрасположенность к ним, причем на самых ранних этапах развития эмбриона. Большие надежды на расширение возможностей современной медицины связаны с реализацией проекта «Геном человека».
Современные проблемы и методы биотехнологии. Учеб. пособие |
119 |

ГЛАВА 3. МЕД-Я БИОТЕХНОЛОГИЯ: ОСНОВЫ МОЛЕКУЛ-Й ТЕРАПИИ И ДИАГНОСТИКИ СОЦ. ЗНАЧ. ЗАБОЛЕВАНИЙ
3.1.Геном человека
3.1.1.Реализациянаучногопроекта«Геномчеловека»
Научный проект «Геном человека» – это международная программа, конечной целью которой являлось определение нуклеотидной последовательности (секвенирование) всей геномной ДНК человека, а также идентификация генов и их локализация в геноме (картирование). В 1988 г . Министерство энергетики США и Национальный институт здоровья США представили обширный проект, в задачи которого входило секвенирование геномов человека, а также бактерий, дрожжей, нематоды, плодовой мушки и мыши – организмов, которые широко использовались в качестве модельных систем в изучении генетики человека. На реализацию этого проекта Конгресс выделил 3 млрд дол. (по одному доллару за каждый нуклеотид человеческого генома). Директором проекта был назначен лауреат Нобелевской премии Джеймс Уотсон. К проекту присоединились другие страны – Англия, Франция, Япония и др.
В 1989 г. по инициативе академика А.А. Баева в нашей стране был организован научный совет по программе «Геном человека». В 1990 г. была создана Международная организация по изучению генома человека (HUGO), вице-президентом которой в течение нескольких лет был академик А.Д. Мирзабеков. Независимо от вклада и государственной принадлежности отдельных участников программы с самого ее начала вся получаемая ими в ходе работинформация была открыта и доступна для всех его участников. Двадцатьтри хромосомы человека были поделены между странами-участницами. Российские ученые должны были исследовать структуры 3-й и 19 -й хромосом. Однако вскоре финансирование работ по этому проекту было сильно сокращено, и реального участия в секвенировании наша страна не принимала. Тем не менее работы по геномному проекту в нашей стране не прекратились: программа была пересмотрена и сконцентрирована на развитии биоинформатики – математических методов, вычислительной техники, программного обеспечения, совершенствовании способов описания и храненеия геномной информации, которые бы помогли понять и осмыслить расшифрованную информацию.
На расшифровку генома человека было отведено 15 лет. Однако постоянное развитие технологии секвенирования позволило завершить проект на 2 года раньше. Немалую роль в интенсификации работ сыграла частная американская компания Celera, возглавляемая Дж. Вентером (в прошлом – биолог Национального института здоровья США). Если в начальные годы осуществления проекта по всему миру секвенировали несколько миллионов нуклеотидных пар в год, то в конце 1999 г. Celera расшифровывала не менее 10 млн нуклеотидных пар в сутки. Для этого работы велись круглосуточно в автоматическом режиме 250 роботизированными установками, информация сразу же передавалась в банки данных, где систематизировалась, аннотировалась и выкладывалась в Интернет.
При проведении работ в 1995 г. Вентер с соавторами разработал и опубликовал совершенно новый подход к секвенированию генома, назван-
Современные проблемы и методы биотехнологии. Учеб. пособие |
120 |
