
Современные проблемы и методы биотехнологии
.pdf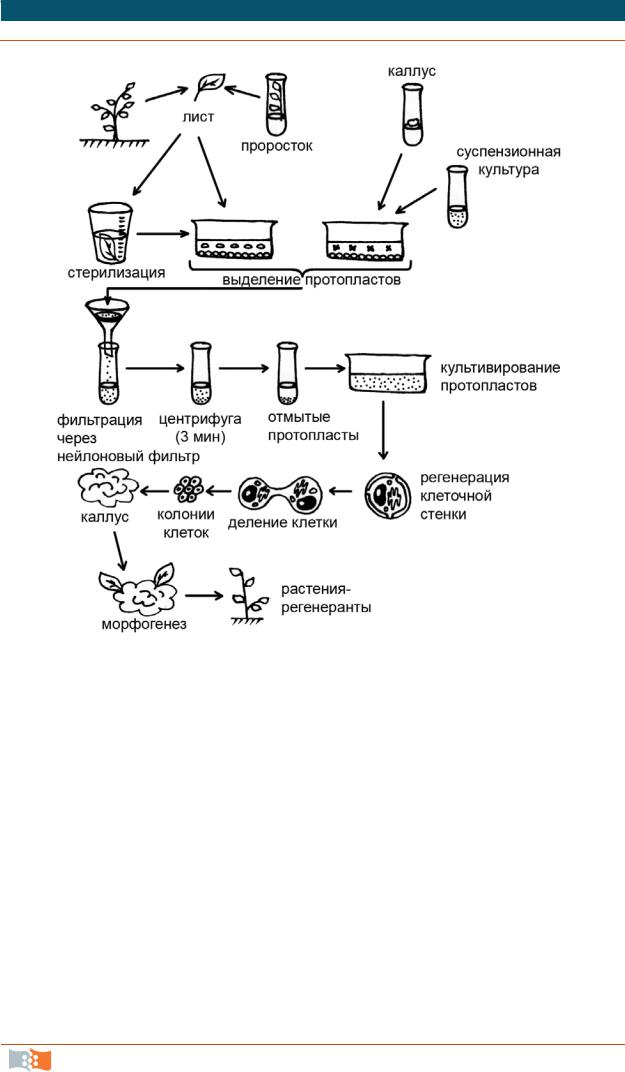
ГЛАВА 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ
4.9. Культура протопластов
Рис. 4.15. Схема получения и культивирования протопластов из клеток растений
Далее протопласты культивируют в тех же условиях, что и клетки. Состав солей может быть несколько изменен. Среда состоит из осмотического стабилизатора, неорганических соединений, источника углерода, азота, витаминов, фитогормонов. Условия культивирования: рН среды – 5,4–5,8, температура – 22–28 оС, невысокая освещенность (не более 2 000 лк).
Общее представление об этапах получения, культивирования in vitro протопластов и регенерации из них растений дано на рис. 4.15.
4.9.2. Тотипотентностьпротопластов
Сразу после того, как отмыты ферменты, протопласты начинают регенерировать клеточную стенку. Отмечается появление целлюлозных микрофибрилл, постепенно организующихся в типичную клеточную оболочку. Че-
Современные проблемы и методы биотехнологии. Учеб. пособие |
211 |

ГЛАВА 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ
4.9. Культура протопластов
рез 2–4 дня протопласт может утратить сферическую форму, и произойдет полное восстановление клеточной стенки. В зависимости от происхождения протопластов и культуральных условий может отмечаться отсутствие синтеза клеточной оболочки в течение нескольких недель или месяцев.
Одним из факторов культуральной среды, обусловливающим синтез клеточной стенки, является сахароза. В ее отсутствие синтеза клеточной стенки не происходит.
Протопласты, не регенерировавшие клеточную стенку, теряют способность к нормальному митотическому делению и образованию клеточных колоний. Такие протопласты или не приступают к делению, или в результате их деления формируются многоядерные структуры, так как кариокинез не сопровождается цитокинезом.
Формирование клеточной стенки не всегда является условием, достаточным для перехода клетки к делению. В зависимости от объекта и условий культивирования к последующему делению может приступить от 0,1 до 80 % восстановивших клеточную стенку протопластов. Первые деления могут происходить через 2–10 дней с начала культивирования протопластов. Образовавшиеся клеточные колонии могут стать источником растенийрегенерантов.
Первое сообщение о регенерации растений в культуре протопластов мезофилла табака было опубликовано в 1971 г. японскими исследователями. Наиболее хорошо отработаны методы изоляции и культивирования протопластов у представителей семейства Solanaceae и отдельных видов Brassica. Трудными объектами для получения протопластов, способных к реализации тотипотентности, являются однодольные растения, в том числе злаки, и хвойные.
4.9.3. Требованияксоставусред прикультивированиипротопластов
Для культивирования протопластов могут быть использованы модификации сред Мурасиге и Скуга или Гамборга (В-5) с добавлением комплекса витаминов и фитогормонов. До того как протопласты синтезируют клеточную стенку, необходимо обеспечить в среде соответствующий уровнь осмотического давления для поддержания стабильности протопластов. В качестве осмотиков используют сахара: глюкозу, маннитол, сорбит, ксилозу, сахарозу или их разные сочетания. После регенерации клеточной стенки и развития клеточных колоний осмотики из среды исключают. Другой важный фактор успешного культивирования протопластов – плотность их высева, которая может составлять 104–103 протопластов на 1 мм среды.
Существуют два способа культивирования протопластов: метод жидких капель и метод платирования.
В первом случае суспензию протопластов в виде капель помещают на пластиковые чашки Петри. Вариацией этого способа является культивирова-
Современные проблемы и методы биотехнологии. Учеб. пособие |
212 |

ГЛАВА 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ
4.9. Культура протопластов
ние единичных изолированных протопластов в микрокаплях объемом 1 мкл, предложенное Ю. Глебой в 1978 г.
Во втором – суспензию протопластов наливают в пластиковые чашки Петри, добавляют равный объем той же среды с 1 %-м агаром при температуре не выше 45 оС. После остывания чашки Петри переворачивают и культивируют при 28 оС. В данном случае протопласты фиксированы в одном положении и физически отделены друг от друга. Это дает возможность наблюдать за развитием интактного протопласта: формированием клеточной стенки, делением, ростом и развитием растения.
Вариантом этой техники является использование кормящих протопластов или клеток, подвергнутых воздействию рентгеновского или γ-излучения, что блокирует их способность к делению. Такие протопласты или клетки смешивают с жизнеспособными протопластами, и они поддерживают и стимулируют их рост.
Сразу после удаления раствора фермента начинается образование клеточной стенки. Труднее добиться деления клеток и регенерации растений. Регенерация растений осуществляется либо через эмбриогенез, либо через развитие каллуса с дальнейшей индукцией морфогенеза. Добиваются этого добавлением в среду ауксинов или сочетания ауксинов с цитокининами.
На пролиферацию клеток, возникших из протопластов, влияет 4 фактора: видовая специфичность и физиологическое состояние исходной ткани растения, способ и условия выделения протопластов, плотность высева протопластов, состав питательной среды.
4.9.4. Использованиекультурыпротопластов
Отсутствие клеточной стенки у протопластов обусловливает им свойства, отличные от целых клеток. Благодаря тому, что протопласты способны поглощать макромолекулы и органеллы, их используют в качестве реципиентов при трансформации, а также в экспериментах по клеточной селекции и мутагенезу. Изолированные протопласты служат источником для выделения неповрежденных и функционально активных субклеточных и цитоплазматических структур и органелл (хлоропластов, ядер, хромосом). Способность протопластов сливаться друг с другом нашла применение для получения соматических гибридов.
И все же проблема соматической гибридизации в норме нескрещивающихся видов растений еще не решена. Даже если будут разработаны удобные методы отбора соматических клеток, останутся проблемы генетической и физиологической несбалансированности. Наиболее вероятно, что слиянием протопластов в практической селекции будут пользоваться только для переноса отдельных хромосом или хромосомных фрагментов, которые удается сохранить после ряда делений и спонтанной элиминации хромосом одного из видов.
Современные проблемы и методы биотехнологии. Учеб. пособие |
213 |

ГЛАВА 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ
4.9. Культура протопластов
Слияние протопластов – парасексуальная гибридизация. Изолиро-
ванные протопласты, еще не образовавшие клеточной стенки, могут сливаться между собой. Слияние протопластов – своеобразный метод гибридизации, так называемая парасексуальная, или соматическая, гибридизация [11]. В отличие от обычной, где сливаются половые клетки (гаметы), в качестве родительских при парасексуальной гибридизации используются диплоидные клетки растений. Внеядерные генетические детерминанты у большинства высших растений наследуются в половом процессе строго одноядерно и матерински. Техника парасексуальной гибридизации может позволить:
–скрещивание филогенетически отдаленных видов растений (организмов);
–получение асимметричных гибридов, несущих генный набор одного из родителей наряду с несколькими хромосомами, органеллами или цитоплазмой другого;
–слияние трех и более клеток;
–получение гибридов, представляющих сумму генотипов родителей;
–перевод мутаций в гетерозиготное состояние, что позволяет получать жизнеспособные формы при слиянии протопластов, поскольку мутагенез довольно часто дает дефектное по морфогенезу растение;
–получение растений, гетерозиготных по внеядерным генам и др. Парасексуальная гибридизация важна для анализа как ядерных генов,
так и внеядерных геномов. Цитоплазматический геном кодирует ряд признаков – скорость фотосинтеза, устойчивость к патогенам, абиотическим факторам и т.д. Наличие косегрегации генов (признаки, контролирующие внеядерный геном, сегрегируют совместно) свидетельствует о физическом сцеплении генов.
Слияние бывает спонтанным (чаще у протопластов из молодых тканей или суспензионных культур) и индуцированным. Для стимуляции слияния протопластов предложен ряд методов, как физических, так и химических.
При физическом способе слияния протопластов, разработанном Г. Циммерманом с сотрудниками в 1981 г., протопласты помещают в камеру с неоднородным электрополем. На электродах формируются агрегаты из 2-3 протопластов либо цепочки из 5-6 протопластов между электродами. Дополнительный единичный импульс постоянного тока приводит к образованию пор в сильно сжатых мембранах, происходит перетекание цитоплазмы, так как переменный ток удерживает протопласты вместе некоторое время, и протопласты в таких агрегатах сливаются. Затухающий ток обуславливает возвращение сферической формы у слившихся протопластов.
В основе слияния лежит различное действие постоянного и переменного электрического тока на плазмалемму. Постоянное эклектическое поле сжимает мембраны, способствуя их локальному разрушению, а переменное электрополе вызывает латеральную диффузию белков мембраны, образуя свободные от гликопротеидов липидные области, где противоположные мембраны могут установить контакт.
Чаще для индукции слияния протопластов используют методику ПЭГ – высокие значения рН – высокая концентрация Са2+, которая дает до 50 %
Современные проблемы и методы биотехнологии. Учеб. пособие |
214 |

ГЛАВА 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ
4.9. Культура протопластов
слившихся протопластов (рН – 9–11, концентрация Са2+ – 100–300 ммоль/л). В присутствии полиэтиленгликоля наблюдается сильная адгезия протопластов, после удаления полиэтиленгликоля и добавления кальция – их слияние. Предполагают, что рН и ионы кальция увеличивают текучесть мембран, что связано с их жидкостно-мозаичной структурой.
При слиянии протопластов различных растений, например, А и В, могут с равной вероятностью образовываться комбинации АА, ВВ и АВ. Желаемый продукт слияния – АВ, поэтому разрабатываются способы увеличения частоты слияния именно такого типа и избирательного выделения только продукта слияния АВ. Один из таких методов заключается в следующем. Поверхность протопласта обычно несет отрицательный заряд. Путем обработки ее фосфолипидом, несущим положительный заряд, можно временно придать поверхности протопласта положительный заряд. Если теперь протопласты А, имеющие положительный заряд, смешать с необработанными протопластами В, несущими отрицательный заряд, то будут в основном образовываться комбинации АВ в результате притяжения разноименных зарядов.
Разработаны также методы маркирования протопластов того или иного растения с помощью разных флуоресцентных красителей. Если обработать протопласты одного растения флуоресцеинизотиоцианатом (FITC), а протопласты другого растения родаминизотиоцианатом (RITC), то можно, не изменяя активности клеток, пометить их желто-зеленой (FITC) или красной (RITC) флуоресценцией. Гибриды, образовавшиеся путем слияния разных типов клеток, будут иметь оба цвета флуоресценции– желто-зеленый и красный.
Протопласты могут сливаться как попарно, так и в большем количестве. Многоядерные продукты слияния, как правило, разрушаются. Первое сообщение о получении соматических гибридов на уровне растений появилось в 1972 г. (Карлсон и коллеги), в нашей стране подобное осуществили в лаборатории Р.Г. Бутенко в 1975 г.
Судьба геномов (ядерного и цитоплазматического) после слияния протопластов может быть различной:
1.Ядерные генетические детерминанты наследуются как дву-, так и однородительски. В последнем случае ядра не сливаются и впоследствии сегрегируют в процессе клеточных делений.
2.Внеядерные генетические детерминанты наследуются двуродительски. При этом в межвидовых комбинациях прослеживается тенденция к соматическому выщеплению и элиминации одного из родительских цитоплазматических геномов.
3.Возникают гибридные клетки и растения в результате слияния более чем двух родительских клеток.
Таким образом, слияние протопластов приводит либо к образованию гибрида, либо к образованию цибрида. Соматический гибрид – продукт
слияния и цитоплазмы, и ядра обоих протопластов. Цибрид (цитоплазматический гибрид) – растение-регенерант, содержащее цитоплазму обоих родителей и ядро одного из них. Цибриды получают, облучая перед слиянием один из протопластов γ-лучами для разрушения ядра. Скрининг таких клеток про-
Современные проблемы и методы биотехнологии. Учеб. пособие |
215 |

ГЛАВА 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ
4.9. Культура протопластов
водится по генам – маркерам ядерного и цитоплазматических (митохондриального и хлоропластного) геномов. Есть указания на рекомбинацию ДНК митохондрий и хлоропластов в гибридных клетках.
При слиянии могут образовываться и так называемые асимметричные гибриды – продукты слияния, имеющие полный хромосомный набор одного из партнеров и часть хромосом другого партнера. Такие гибриды часто возникают при слиянии клеток организмов, филогенетически удаленных друг от друга. В этом случае вследствие неправильных делений клетки, обусловленных некоординированным поведением двух разнородных наборов хромосом, в ряду поколений теряются частично или полностью хромосомы одного из родителей. Асимметричные гибриды бывают устойчивее, плодовитее и жизнеспособнее, чем симметричные, несущие полные наборы генов родительских клеток. В целях асимметричной гибридизации возможна избирательная обработка клеток одного из родителей для разрушения части его хромосом. Возможен прицельный перенос в клетку нужной хромосомы.
Гибриды могут быть получены путем слияния трех и более родительских клеток. Из таких гибридных клеток могут выращены растения-регенеранты.
В результате соматической гибридизации можно получить межвидовые, межродовые, межтрибные, межсемейственные, межцарственные отдаленные гибриды.
Для отдаленных гибридов характерно:
1.Относительная стабильность гибридного состояния, при котором не наблюдается полной элиминации генетического материала одного из родителей.
2.Генетические перестройки (реконструкция и частичная элиминация хромосом).
3.Генетическая разнокачественность клонов гибридных клеток.
4.Ограниченная морфогенетическая способность.
Конструирование клеток. Протопласты широко используются в качестве реципиентов для клеточных органелл. В 1973 г. И. Потрикусс и Ф. Хоффман успешно трансплантировали изолированные ядра петуньи в протопласты табака. Ввести ядро или другие клеточные органеллы в протопласт можно несколькими методами:
–использованим в трансплантации сэндвич-метода в условиях слабого деплазмолиза протопласта;
–переносом клеточных органелл посредством липосом;
–слиянием одно- и многоламелльных частиц с мембранами протопластов, в присутствии таких веществ, как фосфатидилсерин, холистерол и т.д.;
–переносом органелл путем микроинъекций.
Кроме ядра трансплантируют и другие органеллы, такие как митохондрии и хлоропласты. Выбор этих органелл объясняется их полуавтономностью, т.е. наличием собственной ДНК и способностью делиться самостоятельно, независимо от деления самой клетки. Кроме того, эти органеллы контролируют важнейшие физиологические процессы растительной клетки, такие как фотосинтез и дыхание. Например, перенос хлоропластов может ис-
Современные проблемы и методы биотехнологии. Учеб. пособие |
216 |

ГЛАВА 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ
4.9. Культура протопластов
пользоваться для выведения новых форм хозяйственно важных сортов растений. Трансплантация высокоэффективных хлоропластов может способствовать активации фотосинтеза и повышению продуктивности растения.
Одним из важных моментов является сохранение клеточных органелл, поэтому для переноса их в последнее время используются субпротопласты – фрагменты, полученные из протопластов. Они могут содержать большую часть цитоплазмы, но без ядра (цитопласты), ядро с небольшим количеством цитоплазмы (кариопласты), часть хромосом с небольшим количеством цитоплазматического материала (микропротопласты).
Биологическое конструирование на уровне клетки может оказаться полезным и перспективным для создания клеток, клеточных систем и целых растений, удовлетворяющих потребности человека. Под биологическим конструированием следует понимать не только введение отдельных органелл. Аналогичным образом в клетку можно вводить и чужеродный генетический материал, как в виде фрагментов ДНК, так и в виде отдельных хромосом. Кроме того, в изолированные протопласты можно вводить клетки микроорганизмов, создавая таким образом искусственные ассоциации.
Однако необходимо учитывать и следующее явление (по аналогии с сомаклональной изменчивостью): у растений, регенерировавших в результате культивирования протопластов, также проявляется изменчивость. Ее называют протоклональной изменчивостью, а регенерировавшие растения –
протоклонами.
Спектр изменчивости у протоклонов выражен в большей степени, чем у сомаклонов, так как протопласты в большей степени, чем клетки, подвержены воздействиям экзогенных факторов, спектр которых более широк [11].
4.10. Культурагаплоидныхтканей
Гаплоидия является таким уменьшением числа хромосом, при котором в половинном наборе соматической и половой клеток каждая пара гомологичных хромосом представлена лишь одной из них. Гаплоидом или моноплоидом называют организм, имеющий в соматических клетках гаплоидный набор негомологичных хромосом.
Уровень спонтанного возникновения гаплоидов очень низкий – примерно один гаплоид на 105–106 растений. Для повышения частоты образования гаплоидов используют разные приемы:
–воздействуют на процессы опыления и оплодотворения радиационным излучением или химическими веществами;
–опыляют растения чужеродной пыльцой, индуцирующей к развитию неоплодотворенную яйцеклетку;
Современные проблемы и методы биотехнологии. Учеб. пособие |
217 |

ГЛАВА 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ
4.10.Культура гаплоидных тканей
–выполняют отдаленные скрещивания с такими генотипами, когда обеспечивается двойное оплодотворение, но в процессе развития зародышей происходит элиминация хромосом опылителя, что приводит к развитию гаплоидного зародыша материнского генотипа (метод гаплопродюссера);
–культивируют изолированные пыльники;
–культивируют неоплодотворенные завязи и семяпочки.
Генотип гаплоидов имеет характерные особенности. У гаплоидов проявляются рецессивные гены. По внешнему виду гаплоиды сходны с соответствующими диплоидами, но меньше их. Клетки гаплоидов имеют меньший размер, чем клетки диплоидов. Гаплоиды не образуют полноценных гамет. Путем удвоения числа хромосом соматических клеток гаплоида можно получить полностью гомозиготное диплоидное растение.
Гаплоиды получают, используя гаплопродюссеры (отдаленную гибридизацию), партеногенез. Гаплоиды можно получить в культуре тканей из пыльников и клеток зародышевого мешка, гаплоиды в культуре тканей уже получены у 200 видов растений.
Отдаленная гибридизация – важный метод формообразования и улучшения существующих сортов. Основная ее проблема – низкая совместимость или полная несовместимость скрещиваемых видов. Для ее преодоления эффективны различные модификации методов культуры тканей: своевременное изолирование и доращивание гибридных зародышей на питательных средах; каллусогенез при культивировании незрелых гибридных зародышей и регенерация растений из каллусных тканей.
4.10.1. Культурапыльников
Известны несколько методов создания гаплоидов в культуре изолированных тканей растений, имеющих свои преимущества и недостатки:
1) использование (введение в культуру) гаплоидных тканей нативного растения (пыльники, пыльцевые зерна, семяпочки);
2) гаплопродукции – создание условий для получения гаплоидной ткани на интактном растении (отдаленная гибридизация, приводящая к элиминации (абортированию) одного из родительских генотипов), а затем доращивание недоразвитого семени или зародыша.
Гут и Магешвари, впервые занявшиеся культурой пыльников, вызвали рост гаплоидных клеток действием кинетина, а рост диплоидных клеток – включением в среду ауксина, индолилуксусной кислоты (ИУК) с кинетином.
Затем последовали сообщения разных авторов о получении ими гаплоидов риса, рапса, ячменя, паслена черного, томата, эгилопсов, спаржи и других культур. В 70-х гг. из пыльцевых зерен уже получили гаплоиды 23 видов 5 семейств и 4 межвидовых гибрида.
Современные проблемы и методы биотехнологии. Учеб. пособие |
218 |

ГЛАВА 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ
4.10.Культура гаплоидных тканей
Впроцессе культивирования пыльников в условиях in vitro имеет место андрогенез – развитие эмбриоидов, а затем и растений из мужских половых клеток (микроспор).
Для большинства растений оптимальным сроком посадки пыльников на питательные среды является стадия «средних» или «поздних» одноядерных вакуолизированных микроспор. На этой стадии микроспоры высвобождаются из тетрад и готовятся к первому митозу.
Для культивирования пыльников используют среды: Мурасиге-Скуга с 1/2 концентрацией солей, китайские среды, среды с картофельным экстрак-
том, среду Нич. Ауксины либо вообще не добавляют, либо используют 2,4-Д. Из цитокининов применяют кинетин и 6-БАП. Агар-агар тщательно промывают, так как он содержит вещества, неблагоприятно влияющие на развитие пыльников. Для адсорбции метаболитов, ингибирующих ростовые процессы в культуре тканей, в питательные среды добавляют активированный уголь.
Перед культивированием пыльники выдерживают при температуре 4–6 оС в течение 2–8 сут. Изолированные пыльники культивируют либо в темноте, либо при слабом освещении при температуре (25+2) оС.
На питательных средах микроспора может образовать каллус или гаплоидный зародыш (сначала формируется 40–50-клеточный проэмбрио). Зародыш в глобулярной стадии разрывает экзину и проходит стадии, аналогичные развитию зиготического зародыша. Пыльца делится, клетки увеличиваются, экзина разрывается и образуется каллус, на котором, варьируя соотношение фитогормонов, можно получить гаплоидные эмбриоиды. Получение гаплоидов биотехнологическими методами позволяет быстро создавать гомозиготные линии, что делает данную технологию весьма ценной для селекции
игенетики.
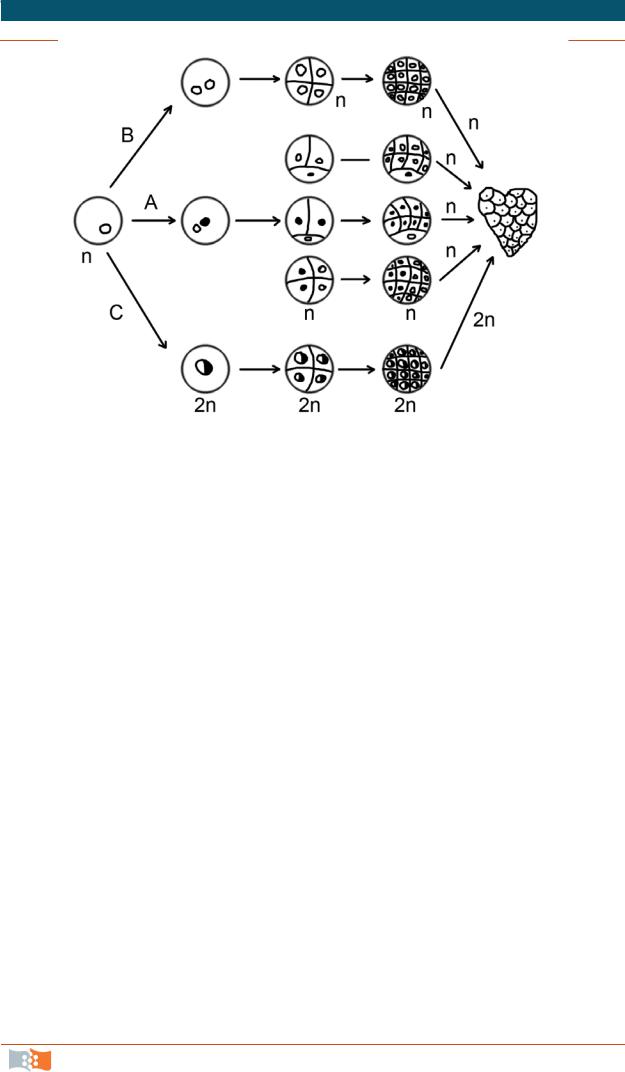
Впроцессе культивирования изолированных пыльников на питательных средах развитие идет двумя путями: либо прямым андрогенезом (образованием эмбриоидов и гаплоидных растений-регенерантов) [10] (рис. 4.16), либо косвенным андрогенезом, когда репродуктивные клетки дедифференцируются и переходят к пролиферации, образуя сначала каллус, а затем при пассировании на специальные среды – морфогенный каллус и регенеранты.
Побеги-регенеранты, полученные из пыльцевых каллусов, неоднородны по ряду морфологических признаков. Это обусловлено гетерогенностью каллусов. Поэтому необходимо проводить цитологическое изучение и каллусов, и растений-регенерантов.
Современные проблемы и методы биотехнологии. Учеб. пособие |
219 |
ГЛАВА 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ
4.10. Культура гаплоидных тканей
Рис. 4.16. Схема формирования андрогенных эмбриоидов
Как показали опыты, таким способом образуются не только гаплоидные, но и диплоидные и полиплоидные растения. Первые формируются из микроспор или из каллуса микроспоры, а диплоиды – из спонтанно удвоенных ядер, из клеток гаплоидного каллуса.
Пыльники капусты благоприятно реагируют на смесь кинетина и 2,4-Д, пыльники риса – на 2,4-Д или 1-нафтилуксусную кислоту (НУК). Исключительно активный рост пыльцы индуцирован у дурмана и рода Brassica кокосовым молоком, а у дурмана – и соком сливы. Эти продукты оказались для названных растений эффективнее, чем какие-либо синтетические индукторы.
У многих видов наилучший выход микроспор обеспечивается при предобработке культивируемых пыльников низкими температурами. У ячменя, например, обработка в течение 7–14 дней при 7 оС дает оптимальные результаты.
4.10.2.Использованиегаплопродюссеров
иотдаленнойгибридизацииприполучениигаплоидныхтканей
Отдаленная гибридизация – важный метод формообразования и улучшения существующих сортов. Основная его проблема – низкая совместимость или полная несовместимость скрещиваемых видов. Для ее преодоления эффективны различные модификации методов культуры тканей: своевременное изолирование и доращивание гибридных зародышей на питательных средах; каллусогенез при культивировании незрелых гибридных зародышей и регенерация растений из каллусных тканей.
Современные проблемы и методы биотехнологии. Учеб. пособие |
220 |
