
Современные проблемы и методы биотехнологии
.pdf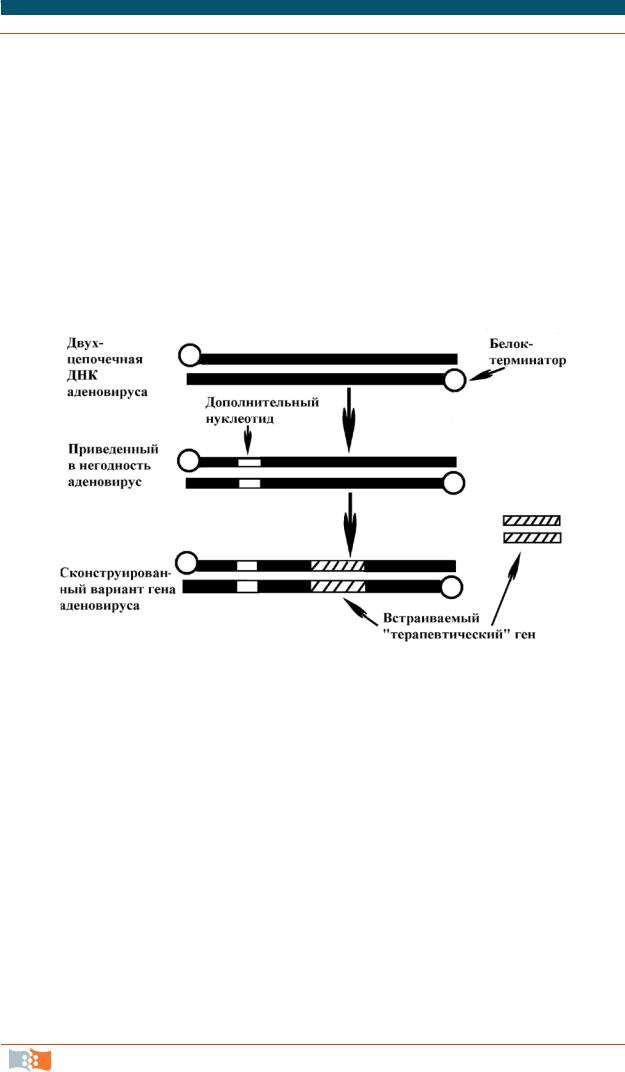
ГЛАВА 3. МЕД-Я БИОТЕХНОЛОГИЯ: ОСНОВЫ МОЛЕКУЛ-Й ТЕРАПИИ И ДИАГНОСТИКИ СОЦ. ЗНАЧ. ЗАБОЛЕВАНИЙ
3.3. Основы молекулярной терапии
принимавший участие в испытаниях препарата. В 2002 г. у двух детей во Франции во время лечения от иммунодефицита (введением терапевтических генов в стволовые клетки с помощью ретровирусов) развилось состояние, похожее на лейкемию. Поэтому разрабатываются невирусные системы доставки генов. Самый простой и неэффективный способ – это инъекция плазмидной ДНК в ткани. Второй подход – это бомбардировка тканей микрочастицами золота (1–3 мкм), конъюгированными с ДНК. При этом терапевтические гены экспрессируются в тканях-мишенях и их продукты – терапевтические белки – поступают в кровь. Основным недостатком этого подхода является преждевременная инактивация или разрушение этих белков компонентами крови.
Рис. 3.19. Схема получения вектора на основе аденовируса
Доставку ДНК можно осуществить, упаковав ее в искусственную липидную оболочку. Полученные таким образом сферические частицы-липосомы легко проникают через клеточную мембрану. Созданы липосомы с самыми разными свойствами, однако пока эффективность такой доставки невысока, поскольку большая часть ДНК подвергается лизосомному разрушению. Также для доставки генетической конструкции синтезируют конъюгаты ДНК с различными молекулами, способными обеспечить ее сохранность, адресную доставку и проникновение в клетку.
В последние годы проводятся интенсивные эксперименты по созданию искусственной 47-й хромосомы, которая позволила бы включить большое количество генетического материала с полным набором регуляторных элементов для одного или нескольких терапевтических генов. Это дало бы возможность использовать геномный вариант терапевтического гена и тем са-
Современные проблемы и методы биотехнологии. Учеб. пособие |
151 |

ГЛАВА 3. МЕД-Я БИОТЕХНОЛОГИЯ: ОСНОВЫ МОЛЕКУЛ-Й ТЕРАПИИ И ДИАГНОСТИКИ СОЦ. ЗНАЧ. ЗАБОЛЕВАНИЙ
3.3. Основы молекулярной терапии
мым обеспечить его стабильность и эффективную длительную экспрессию. Проведенные эксперименты показали, что создание искусственной хромосомы человека, содержащей терапевтические гены, вполне реально, однако пока непонятно, каким образом вводить такую огромную молекулу в ядро клет- ки-мишени.
Основными проблемами, которые стоят перед генной терапией, помимо риска тяжелой иммунной реакции, являются трудности длительного хранения и функционирования терапевтической ДНК в организме пациента, мультигенность многих болезней, делающая их трудной мишенью для генной терапии, а также риск использования вирусов в качестве векторов.
3.3.2. Лекарственныесредстванаосновеолигонуклеотидов
Помимо рассмотренных нами способов лечения генетических заболеваний с помощью введения в дефектную клетку терапевтических генов, активно разрабатываются лекарственные средства на основе нуклеиновых кислот: антисмысловые олигонуклеотиды, РНК-ферменты (рибозимы), олигонуклеотиды, корректирующие мутации in vivo. Эти средства направлены прежде всего на лечение заболеваний, связанных с гиперпродукцией белков (рак, воспаления, вирусные и паразитные инфекции). Уменьшить продукцию можно снижением уровня транскрипции или трансляции. Этого можно достичь несколькими способами: гибридизацией соответствующего олигонуклеотида со специфическим геном или мРНК, блокированием фактора транскрипции белка, уменьшением количества мРНК в результате расщепления РНК-ферментами и т.п. Рассмотрим принципы некоторых из них.
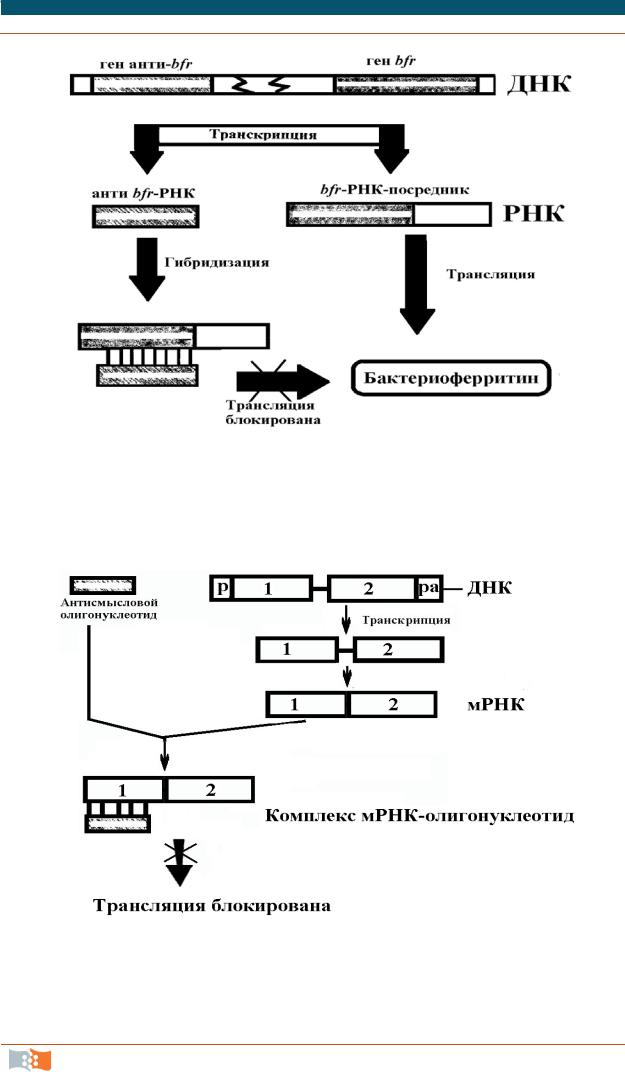
Рибоолигонуклеотид, который связывается с определенной мРНК и тем самым ингибирует трансляцию кодируемого ею белка, называется «антисмысловой» мРНК. Этот механизм используют некоторые бактерии для регулирования генов (рис. 3.20). На практике применяют искусственно сконструированные гены, у которых ДНК-вставка находится в такой ориентации, чтобы их транскрипты были антисмысловыми по отношению к мРНКмишени (рис. 3.21). Было показано, что возможно использование синтетических антисмысловых олигонуклеотидов, однако их терапевтический эффект будет сильно зависеть от их устойчивости к действию клеточных нуклеаз, системы доставки и специфичности их гибридизации. Для определения наиболее эффективных сайтов-мишеней на специфической мРНК производят тестирование набора антисмысловых олигонуклеотидов длиной 15–20 оснований с культурой клеток, синтезирующих мРНК-мишень. Состав синтезированных белков определяют электрофорезом и устанавливают, введение какого олигонуклеотида приводит к снижению синтеза белка-мишени.
Современные проблемы и методы биотехнологии. Учеб. пособие |
152 |
ГЛАВА 3. МЕД-Я БИОТЕХНОЛОГИЯ: ОСНОВЫ МОЛЕКУЛ-Й ТЕРАПИИ И ДИАГНОСТИКИ СОЦ. ЗНАЧ. ЗАБОЛЕВАНИЙ
3.3. Основы молекулярной терапии
Рис. 3.20. Регулирование гена бактериоферритина (bfr) с помощью антисмысловой РНК
Рис. 3.21. Ингибирование трансляции мРНК синтетическим антисмысловым олигонуклеотидом
Современные проблемы и методы биотехнологии. Учеб. пособие |
153 |
ГЛАВА 3. МЕД-Я БИОТЕХНОЛОГИЯ: ОСНОВЫ МОЛЕКУЛ-Й ТЕРАПИИ И ДИАГНОСТИКИ СОЦ. ЗНАЧ. ЗАБОЛЕВАНИЙ
3.3. Основы молекулярной терапии
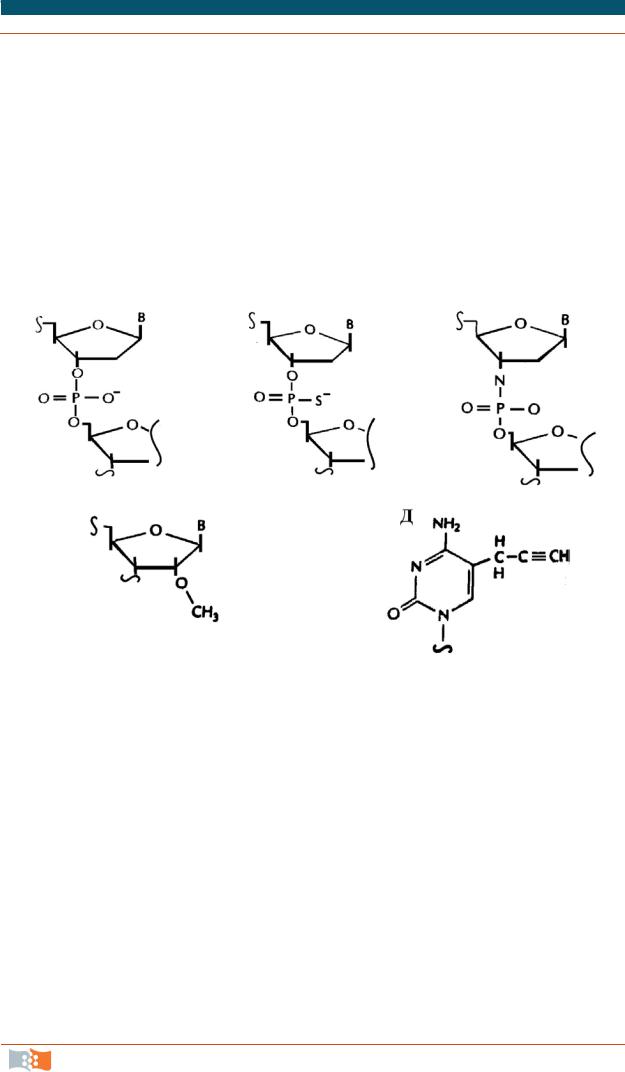
Для защиты от нуклеазного расщепления синтезируются модифицированные олигонуклеотиды, при этом не утратившие способность гибридизоваться. На рис. 3.22 приведены структуры модифицированных нуклеотидов, эффективность которых интенсивно изучается. Например, показано, что олигонуклеотиды с заменой свободного кислорода фосфодиэфирной связи на серу (структура б) эффективно гибридизуются с комплементарной РНК-мишенью и полученные РНК-ДНК дуплексы активируют внутриклеточную рибонуклеазу Н. Этот эндогенный фермент, гидролизует РНК-последовательность в таких гибридах. С такими олигонуклеотидами уже проведены многообещающие клинические испытания, в которых мишенями являлись РНК цитомегаловируса, ВИЧ, некоторых РНК, ответственных за развитие рака.
а |
б |
|
в |
|
|
|
|
г |
д |
Рис. 3.22. Модификации олигонуклеотидов: а – нормальная фосфодиэфирная связь;
б– тиофосфатная связь; в – фосфамидная связь; г – 2'-O-метилрибоза;
д– С-5-пропинилцитозин
Для эффективной доставки антисмысловых олигонуклеотидов их часто пакуют в липосомы, в свою очередь модифицированные специфическими лигандами, обеспечивающими адресную доставку (такой прием мы уже встречали, когда рассматривали способы невирусной доставки терапевтических генов). К настоящему времени проведен ряд испытаний и показана высокая терапевтическая эффективность антисмысловых олигонуклеотидов для подавления нежелательной пролифирации гладкомышечных клеток (осложнения после ангинопластики, коронарного шунтирования, атеросклероз), для лечения вирусных инфекций и малярии.
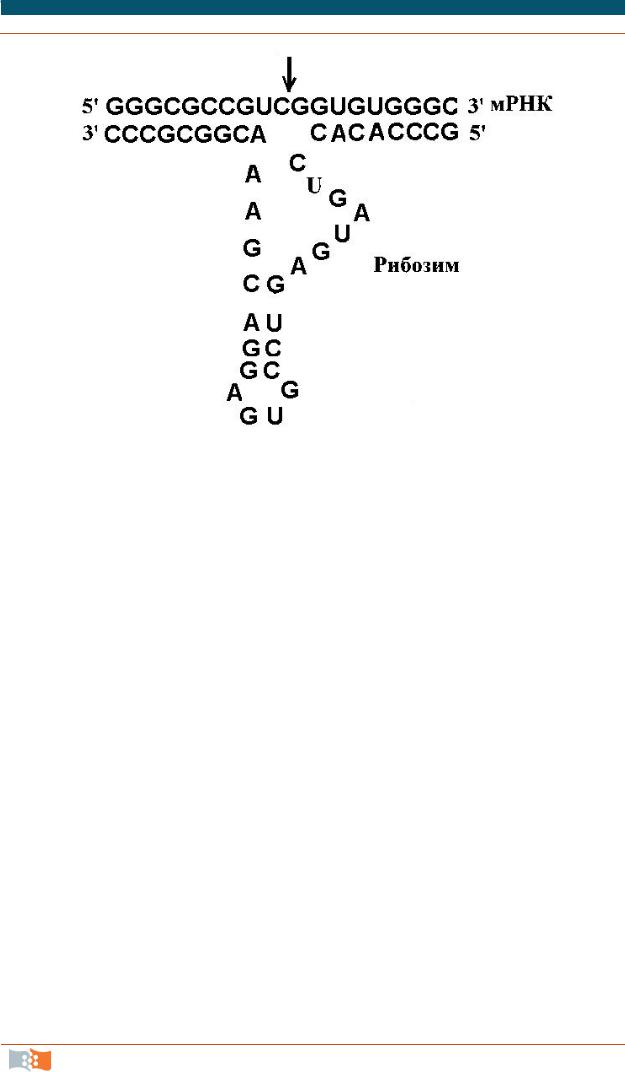
Принцип действия и строение рибозимов – природных РНК, обладающих нуклеазной активностью, показан на рис. 3.23.
Современные проблемы и методы биотехнологии. Учеб. пособие |
154 |
ГЛАВА 3. МЕД-Я БИОТЕХНОЛОГИЯ: ОСНОВЫ МОЛЕКУЛ-Й ТЕРАПИИ И ДИАГНОСТИКИ СОЦ. ЗНАЧ. ЗАБОЛЕВАНИЙ
3.3. Основы молекулярной терапии
Рис. 3.23. Расщепление мРНК под действием рибозимов. Стрелкой показан сайт расщепления
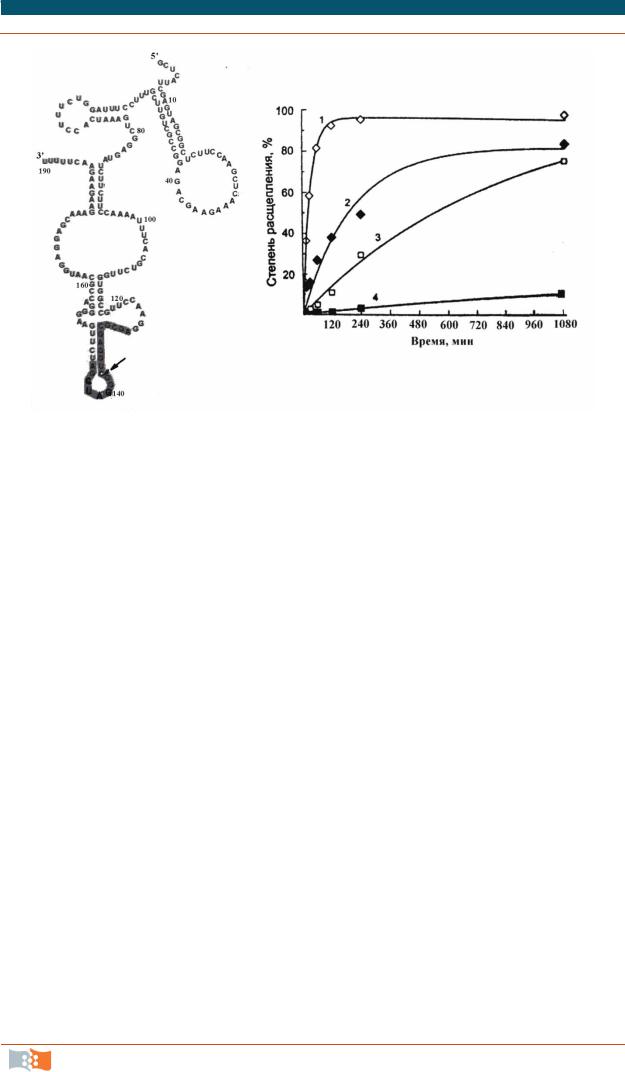
Обнаружено, что эти короткоцепочечные РНК способны эффективно подавлять экспрессию вирусных генов, онкогенов, факторов роста и других терапевтически важных генов, расщепляя их мРНК [8]. Модифицируя суб- страт-связывающую последовательность, можно получать рибозимы, специфичные к определенной мРНК. Рибозимы можно синтезировать непосредственно в клетке транскрипцией синтетического олигодезоксирибонуклеотида, кодирующего каталитический домен и фланкирующие его гибридизующиеся участки. Такой олигонуклеотид встраивают в эукариотический экспрессирующий вектор и помещают в клетку. Образующаяся РНК самопроизвольно приобретает активную конформацию, так называемую форму «головки молотка». Множество рибозимов различной структуры и активности синтезировано химически. Например, в лаборатории нуклеиновых кислот Института химической биологии и экспериментальной медицины СО РАН (Новосибирск) проводятся многолетние исследования по получению синтетических рибозимов, обладающих повышенной активностью и стабильностью. Для повышения защиты от преждевременного расщепления внутриклеточными нуклеазами получают различные производные рибозимов – с метилированными 2'-гидроксильными (см. рис. 3.22, г) группами, бинарные конструкции и т.п. Строение молекулы рибозима существенным образом влияет на его эффективность. На рис. 3.24 показана кинетика расщепления мРНК гена множественной лекарственной устойчивости mdr1 с помощью синтезированных рибозимов разной структуры.
Современные проблемы и методы биотехнологии. Учеб. пособие |
155 |
ГЛАВА 3. МЕД-Я БИОТЕХНОЛОГИЯ: ОСНОВЫ МОЛЕКУЛ-Й ТЕРАПИИ И ДИАГНОСТИКИ СОЦ. ЗНАЧ. ЗАБОЛЕВАНИЙ
3.3. Основы молекулярной терапии
а |
б |
Рис. 3.24. Расщепление 190-звенного 5'-концевого фрагмента MDR1 мРНК модифицированными бинарными (1,3) и полноразмерными (2,4) рибозимами: а – структура РНК с выделенным специфическим сайтом; б – накопление продуктов расщепления (материалы предоставлены А.Г. Веньяминовой, ИБХиФМ, Новосибирск)
Особое место в молекулярной терапии занимают так называемые методы активирования пролекарств. Например, одним из способов генной терапии рака является уничтожение опухолевых клеток с помощью активированного производного ганцикловира (GCV, производное гуанозина), продукта гена тимидинкиназы, из уже упомянутого нами вируса простого герпеса HSVtk. Опухолевые клетки трансфецируют in vivo геном HSVtk под активным промотором и через несколько дней вводят ганцикловир, который фосфорилируется вирусной тимидинкиназой до монофосфата, а затем киназами клетки-хозяина до трифосфата. Это производное ингибирует ДНК-полимеразу и останавливает синтез ДНК, что приводит к гибели пролифилирующих клеток. Через межклеточные контакты ганцикловиртрифосфат проникает в соседние немодифицированные клетки и таким образом уничтожается дополнительно до десятка опухолевых клеток. Ген, приводящей к гибели собственной клетки, называется геном «самоубийства» (в нашем случае это ген тимидинкиназы), а термин «пролекарство» относится к неактивной форме лекарственного вещества (в данном случае это ганцикловир). Этот подход был использован и для создания других вариантов комбинации ген– активатор–пролекарство, но эффективность системы GCV-HSVtk уже доказана рядом доклинических испытаний.
Генная терапия является новой лечебной дисциплиной, становление которой происходит на наших глазах. Несмотря на некоторые успехи и многообещающие перспективны, существует ряд проблем, которые еще пред-
Современные проблемы и методы биотехнологии. Учеб. пособие |
156 |

ГЛАВА 3. МЕД-Я БИОТЕХНОЛОГИЯ: ОСНОВЫ МОЛЕКУЛ-Й ТЕРАПИИ И ДИАГНОСТИКИ СОЦ. ЗНАЧ. ЗАБОЛЕВАНИЙ
3.3. Основы молекулярной терапии
стоит преодолеть. Часть проблем лежит далеко не в плоскости медицины и молекулярной биологии. Речь идет о проблемах этических и политических. Как вы уже заметили, мы рассматривали методы генетической терапии только соматических клеток. Это означает, что произведенные коррекции ограничиваются определенным органом или тканью, «исправленные» гены не будут передаваться следующему поколению. Изменения генотипа зародышевых клеток (сперматозоидов или яйцеклеток) или оплодотворенных клеток должны передаваться из поколения в поколение.
В настоящее время генная терапия соматических клеток отнесена к стандартным методам медицинского вмешательства. В противоположность этому генная терапия зародышевых клеток является технологически гораздо более сложной, проблематичной и непредсказуемой. Поэтому эксперименты
вэтой области во многих странах запрещены.
Вконце 80-х гг. в США были установлены правила, регулирующие испытания в области генетической терапии соматических клеток. Они гаранти-
руют беспристрастный и репрезентативный отбор больных и их информированность (насколько опасно лечение, какова вероятность его успеха и пр.), конфиденциальность сведений о больных и произведенных исследованиях, осуществление всех манипуляций должным образом без причинения вреда, как конкретным больным, так и человеческой популяции в целом.
Поскольку лечение соматических клеток приводит к улучшению состояния и значительному продлению жизни больных с генетическими заболеваниями, но «улучшенный» ген не передается по наследству, существует мнение, что это приведет к накапливанию генетических заболеваний в человеческой популяции. Однако, по данным популяционной генетики, для существенного повышения частоты вредного гена в результате эффективного лечения требуются тысячи лет.
3.3.3. Клонированиечеловека
Вряд ли в наше время найдется человек, незнакомый с фантастическими рассказами и фильмами о человеческих клонах, творящих то добро, то зло, используемых недальновидными политиками или тупыми солдафонами. Современный уровень знаний и методы манипулирования с генетическим материалом, получение различных трансгенных животных создают впечатление, что клонирование человека – дело не столь отдаленного будущего. Привлекательность идеи получения копий животных с улучшенными полезными свойствами или копий гениальных людей, или просто живой копии погибшего дорогого человека подогревает интерес к проблеме. Процедура клонирования млекопитающих в принципе заключается в следующем: в энуклеированную (лишенную ядра) яйцеклетку вводят ядра соматических клеток донора и развивающиеся яйцеклетки на стадии бластоцист вносят в матку суррогатной матери. При этом будет получено потомство с тем же генотипом, что и у донора, или, другими словами, его генетический клон. Именно так была получена клонированная овечка Долли. Однако, как показали многочисленные эксперименты, проблема клонирования не так проста, как пер-
Современные проблемы и методы биотехнологии. Учеб. пособие |
157 |

ГЛАВА 3. МЕД-Я БИОТЕХНОЛОГИЯ: ОСНОВЫ МОЛЕКУЛ-Й ТЕРАПИИ И ДИАГНОСТИКИ СОЦ. ЗНАЧ. ЗАБОЛЕВАНИЙ
3.3. Основы молекулярной терапии
воначально думали, имеется множество «подводных камней» и рано строить рассчитанные под клоны коровники. Разговоры же о клонировании человека лишены оснований и безответственны.
Нерешенными остаются главные вопросы.
1. Способны ли ядра соматических клеток полностью и эквивалентно заменить ядра зародышевых клеток в их функции обеспечения нормального развития зародыша? Соматические клетки – это специализированные клетки, прошедшие определенный цикл развития, затрагивающий, в том числе, и модификацию ДНК (изменения в некодирующих повторах, укорачивание теломер и пр.). Тщательный молекулярно-генетический анализ функционирования ядер пересаженных соматических клеток показал, что 4 % генов работают неправильно, включаются не в том месте, не в то время или не включаются вовсе. Как возвратить изменившиеся ядра клеток в исходное состояние, «поймать» такую соматическую клетку, ядро которой не утратило свой потенциал?
2. Какова вероятность полного сходства потомков? Даже если удастся получить нормально развивающиеся эмбрионы, условия их развития в матке различных приемных матерей будут различаться. Существующие определенные пределы колебаний проявления данного гена в фенотипическом признаке неизбежно приведут к тому, что одинаковые гены будут проявляться поразному и вероятность получения полного сходства потомков крайне мала.
3. Даже если развивающиеся яйцеклетки трансплантировали сотне приемных матерей и получили хотя бы одну-единственную живую и точную копию индивида (процент успеха крайне низок!), встанет вопрос: а что с остальными зародышами? Часть неизбежно погибнет, а остальные– уроды? И как поступить с этими искусственно созданными несчастными? Запрет такого рода исследований как аморальных является вполне естественным. В нашей стране на манипуляции с человеческими зародышами принят мораторий.
Репродуктивное клонирование человека запрещено, но вопрос о терапевтическом клонировании остается открытым. Суть его заключается в следующем: ядро соматической клетки пациента трансплантируется в яйцеклетку донора, выращивается до стадии бластоцисты, внедряется в стенку матки. Внутри содержится так называемая внутренняя клеточная масса из эмбриональных стволовых клеток, из которых развиваются органы и ткани зародыша. Предполагается, что благодаря их колоссальному потенциалу к развитию в разных направлениях, из них можно будет получать «запчасти» для пересадки пациенту – хозяину ядра. Но что это за запчасти, если 4 % генов будут работать неправильно? Ведь известно, что при пересадке эмбриональных стволовых клеток приблизительно у 30 % реципиентов развиваются опухоли. И, кроме того, не надо забывать об этических проблемах, связанных с поисками доноров яйцеклеток и суррогатных матерей. В такой ситуации многие ученые высказываются в пользу проведения масштабных работ в этом направлении на экспериментальных животных и объявлении хотя бы временного моратория на использование этой техники в клинике и призывают проявлять максимум осторожности и аккуратности при решении проблем, связанных с клонированием человека.
Современные проблемы и методы биотехнологии. Учеб. пособие |
158 |

ГЛАВА 4 КУЛЬТУРА РАСТИТЕЛЬНЫХ
КЛЕТОК И ТКАНЕЙ
4.1.Значениеиместокультурытканей
вбиотехнологиирастений
Биотехнология как наука базируется на использовании биологических процессов в технике и промышленном производстве.
В свете современных представлений биотехнология растений – это соединение методов культуры клеток и тканей растений с методами молекулярной биологии и техникой рекомбинантных ДНК. Созданная система – клетки и ткани высших растений, выращиваемые вне организма на искусственных питательных средах в строго контролируемых условиях – позволяет изучать рост, клеточную дифференцировку и развитие растительного организма, разрабатывать новые клеточные технологии для промышленности и сельского хозяйства [6].
Вся сфера научной деятельности по реорганизации геномов обычно называется биотехнологией, хотя этот термин включает в себя более широкий круг понятий, чем культура изолированных тканей, генная и хромосомная инженерия.
Роль биотехнологии и, в частности, культуры изолированных тканей, состоит в решении таких глобальных проблем, как обеспечение населения продовольствием, более эффективная медицина, оптимальная экология.
Несомненно, что в настоящее время наиболее перспективными обсуждаемыми и иногда осуждаемыми направлениями биотехнологии являются генная и хромосомная инженерии, но вытекали они из культивирования изолированных органов, тканей и клеток и немыслимы без него.
4.1.1. Тотипотентностьрастительнойклетки
Методы культивирования изолированных фрагментов растений основаны на использовании важного свойства растительной клетки — тотипотентности [11].
Тотипотентность (лат. Totus – весь, potentia – сила) – это свойство клетки реализовать генетическую информацию, обеспечивающую ее дифференцировку и развитие до целого организма.
Тотипотентностью обладают оплодотворенные яйцеклетка растений и яйцо животных организмов. Что касается дифференцированных клеток, то у животных тотипотентность присуща только некоторым клеткам кишечнополостных. Так, соматические клетки гидры дают начало новому организму.
Современные проблемы и методы биотехнологии. Учеб. пособие |
159 |

ГЛАВА 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ
4.1.Значение и место культуры тканей в биотехнологии растений
Увысших животных с ранних этапов эмбриогенеза, с началом специализации клеток, тотипотентность не реализуется. Однако клетки, изолированные из эмбрионов млекопитающих, в условиях культивирования могут сохранять плюрипотентность – способность дифференцироваться во все типы клеток
как собственно зародыша, так и экстраэмбриональных тканей. Такие клетки получили название эмбриональных стволовых клеток.
У растений в природных условиях (in vivo) тотипотентность могут проявлять и специализированные клетки. Пример тому – вегетативное размножение, в том числе наблюдаемое в результате развития растений из клеток листьев бегонии, узумбарской фиалки или каланхое.
Тотипотентность у растений реализуется и при заживлении ран. В этом случае на раневой поверхности растений в результате неорганизованной пролиферации клеток происходит развитие каллуса (лат. callus – толстая кожа, мозоль).
Образование каллуса можно наблюдать при прививках в местах срастания привоя и подвоя. Каллус способствует заживлению ран и первоначально состоит из недифференцированных клеток, начало которым на раневой поверхности дают клетки тканей, способные к дедифференциации (камбий, флоэма, молодые клетки ксилемы). Впоследствии в каллусе может иметь место вторичная дифференциация с образованием специализированныхтканей и органов.
Однако в природных условиях растения ряда систематических групп тотипотентность не проявляют. Ввиду высокой специализации клеток многие однодольные растения утратили способность к раневой реакции ивегетативному размножению.
Возможность реализации супрессированной in vivo и активной тотипотентности предоставляется в условиях in vitro при выращивании фрагментов тканей, органов или клеток на искусственных питательных средах. Этот переход специализированных клеток к эмбриональным синтезам, последующему делению с образованием недифференцированных клеток, а затем и к повторной дифференциации осуществляется под действием экзогенных фитогормонов.
4.1.2. Историческиеэтапыразвития методовкультивированияin vitro
Образование каллуса впервые описано французским энциклопедистом Дугамелем (1756), опубликовавшим результаты по изучению циркуляции клеточного сока и заживлению ран у растений, срастанию тканей при прививках.
Позже выполненный микроскопический анализ срезов каллуса, индуцированного на стеблях декоративных древесных растений, позволил Трекулу (1853) выявить, что образование каллуса может происходить от разных тканей (камбиальной, флоэмы и очень молодых частей ксилемы).
Современные проблемы и методы биотехнологии. Учеб. пособие |
160 |
