
Современные проблемы и методы биотехнологии
.pdf
ГЛАВА 2. СОВРЕМЕННЫЕ УСПЕХИ ГЕНОМИКИ: ТРАНСГЕННЫЕ ОРГАНИЗМЫ
2.2. Трансгенные микроорганизмы и клеточные культуры
2.2.2.Клеточныекультурыдляпродукциибелков
Впоследнее время все больше растет потребность общества в разнообразных белковых препаратах. Особенно быстрыми темпами увеличивается применение фармацевтических белковых препаратов в диагностике и терапии заболеваний человека и животных. Это не только антитела и их производные, но многие белки из крови человека (цитокины, ростовые гормоны, интерлейкины, интерфероны и др.). На современном рынке присутствует около ста препаратов на основе белков человека, и это количество растет год от года. Все эти белки произведены in vitro при использовании генетически модифицированных клеточных культур, полученных генно-инженерными методами, в основном это бактериальная культура E. coli, дрожжевые
Saccharomyces cerevisiae и Pichia pastoris или культуры клеток млекопитающих.
Пока наиболее экономически эффективной и хорошо охарактеризованной системой остается бактериальная. Однако благодаря прокариотическому типу данной системы эукариотические белки в ней плохо процессируются и продукция в ней ограничивается простыми структурами (пептиды, небольшие белки), где посттрансляционные модификации отсутствуют или не нужны для биологической функции. Кроме того, высокий уровень синтеза часто приводит к аггрегациии рекомбинантных белков в виде плохо растворимых телец включения (inclusion bodies), что делает необходимым этап ренатурации рекомбинантного белка для перевода в биологически активную форму. Также необходимым этапом является удаление бактериальных токсинов, присутствующих в данной системе. При этом общая продуктивность бактериальной системы остается довольно низкой – 0,1–1,5 мг/л [1].
Дрожжи как эукариотический организм не имеют этих недостатков, но практический опыт показывает, что большое количество синтезируемого продукта теряется вследствие деградации целевого белка в среде. Кроме того, в дрожжах, особенно в Saccharomyces cerevisiae, гликопротеины подвергаются гипергликозилированию, в результате которого формируются N-гликаны с очень высоким содержанием маннозы, которые кардинально отличаются от N-гликанов млекопитающих или человека. Ситуация может быть улучшена использованием метилотрофных дрожжей P. pastoris в качестве экспрессионной системы. Белковая продукция в дрожжах может достигать 6,4 г/л, но обычно находится в диапазоне 100–200 мг/л. Несмотря на эти ограничения, 43 % рекомбинантных белков, существующих на рынке, продуцируются в бактериях или дрожжах.
Большинство фармацевтических биотехнологических продуктов, однако, продуцируются в различных культурах клеток млекопитающих, например, NSO, BNK, CHO. Как типы, наиболее близкие человеческим клеткам, эти системы дают высокий уровень продукции функциональных рекомбинантных белков с корректным N-гликозилированием и другими посттрансляционными модификациями. Уровень продукции культур клеток млекопитающих приблизительно составляет 1–3 г/л. Этот «золотой стандарт» требует
Современные проблемы и методы биотехнологии. Учеб. пособие |
81 |

ГЛАВА 2. СОВРЕМЕННЫЕ УСПЕХИ ГЕНОМИКИ: ТРАНСГЕННЫЕ ОРГАНИЗМЫ
2.2. Трансгенные микроорганизмы и клеточные культуры
дорогой инфраструктуры и компонентов сред. Кроме того, существует риск вирусной или онкогенной контаминации. Все это приводит к сверхвысокой стоимости конечного продукта, приблизительно варьирующей от 0,3 до 10 тыс. дол. США за грамм в зависимости от количества синтезируемого белка, и к необходимости искать более дешевые альтернативы продукции целевого белка, которым могут стать целые трансгенные растения или животные.
Растительные клеточные культуры. Растения всегда были основ-
ным источником биопродуктов для человека, снабжая население пищей, волокнами, древесиной и лекарствами. В области фармацевтики растения используют для получения огромного количества вторичных метаболитов с разнообразными терапевтическими эффектами: ранозаживляющие, антимикробные, противовоспалительные, психоактивные и др. Растения выработали эти субстанции в процессе эволюции, чтобы защитить себя от патогенов и хищников или привлекать опылителей. Современные биотехнологические методы позволяют продуцировать эти продукты предсказуемым образом в клеточных культурах из соответствующих лекарственных растений. Иногда это единственный путь производить препараты в промышленных масштабах, например, когда исходное растение сложно для культивирования или очень редко встречается в природе. В качестве успешных примеров можно привести алкалоиды, паклитаксел (противоопухолевый препарат) и шиконин (антимикробный и противовоспалительный).
Растительные клетки как эукариотическая система обладают всеми чертами для продукции биологически активных сложных белков. Как результат, доля биологически активной формы в синтезированном растительными клетками рекомбинантном тотальном белке бывает очень высока. Так, например, в сравнительном исследовании экспрессии анти-CEA scFv, клетки табака синтезировали, несомненно, наибольшее количество функционально активного белка (92 %) от тотального рекомбинантного по сравнению с
E. coli (12 %) и P. pastoris (40 %).
Животные клеточные культуры существуют с 50-х гг. прошлого ве-
ка, когда были выделены в клеточную культуру HeLa клетки и CHO клеточная линия. Больше пятидесяти лет развития позволило производству на основе животных клеточных культур достигнуть выдающихся успехов. По данным за 2007 г . приблизительно шестая часть наиболее популярных лекарств являются биотехнологическими продуктами. Девять из десяти наиболее популярных биотехнологических лекарственных препаратов, продающихся в США, произведены в клеточной культуре клеток млекопитающих и, по крайней мере, продажи 23 белковых препаратов превышают один биллион долларов.
Современные проблемы и методы биотехнологии. Учеб. пособие |
82 |

ГЛАВА 2. СОВРЕМЕННЫЕ УСПЕХИ ГЕНОМИКИ: ТРАНСГЕННЫЕ ОРГАНИЗМЫ
2.2.Трансгенные микроорганизмы и клеточные культуры
2.2.3.Дрожжевыесистемыэкспрессии
Дрожжи являются очень привлекательный системой экспрессии, позволяющей сочетать дешевизну прокариотического культивирования с эукариотическим процессингом белков. Дрожжевая система экспрессии имеет следующие преимущества. Во-первых, дрожжи являются одноклеточным организмом, генетика и физиология которого детально изучены и который можно выращивать как в небольших лабораторных колбах, так и в промышленных культиваторах. Во-вторых, выделены и охарактеризованы несколько сильных промоторов этих дрожжей, а для систем эндогенных дрожжевых экспрессирующих векторов могут использоваться природные так называемые 2 µм-плазмиды. В-третьих, в клетках дрожжей осуществляется большое число посттрансляционных модификаций. В-четвертых, лишь очень немногие из собственных дрожжевых белков секретируются в среду; таким образом, если гетерологичный белок секретируется клеткой, то его очистка не составит большого труда. В-пятых, поскольку дрожжи уже многие годы используют в хлебопечении и пивоварении, Департамент по контролю качества пищевых продуктов, медикаментов и косметических средств (США) включил обычные пекарские дрожжи Saccharomyces cerevisiae в список «организмов, признанных безопасными». Таким образом, использование этих организмов для получения белков, применяемых в медицине, не требует дополнительных экспериментов, необходимых при работе с неразрешенными к применению микроорганизмами. Некоторые белки, синтезированные в S. cerevisiae, уже используются в качестве вакцин и фармацевтических препаратов, а также для диагностики.
В дрожжевых клетках гликозилируются только секретируемые белки, поэтому для получения рекомбинантных белков, которые для перехода в активную форму должны подвергнуться N- или О-гликозилированию, необходимо использовать системы секреции. Для этого перед кДНК, которая кодирует интересующий исследователя белок, нужно поместить так называемый пре-про-α-фактор – лидерную (сигнальную) последовательность гена а1 фактора спаривания дрожжей. Синтезируемый рекомбинантный белок сможет в этом случае эффективно секретироваться дрожжами.
К сожалению, белки млекопитающих подвергаются избыточному гликозилированию в клетках S. cerevisiae, что сильно меняет их иммуногенность. Использование других видов дрожжей, особенно метилотрофных Pichia pastoris иногда помогает решить данную проблему.
2.2.4. Клеткинасекомыхибакуловирусыдлясинтезабелков
Бакуловирусы инфицируют только беспозвоночных, в том числе многих насекомых. В ходе инфекционного процесса образуются две их формы. Одна представлена отдельными вирионами, которые высвобождаются из инфицированной клетки хозяина, как правило, клетки средней кишки, и спо-
Современные проблемы и методы биотехнологии. Учеб. пособие |
83 |

ГЛАВА 2. СОВРЕМЕННЫЕ УСПЕХИ ГЕНОМИКИ: ТРАНСГЕННЫЕ ОРГАНИЗМЫ
2.2. Трансгенные микроорганизмы и клеточные культуры
собны инфицировать другие клетки этого органа. Вторая состоит из множества вирионов, заключенных в белковый матрикс. Белок этого матрикса называется полиэдрином, а сама структура – полиэдроном. Синтез полиэдрина начинается через 36–48 ч после инфекции и продолжается 4-5 сут, пока зараженные клетки не лизируют и хозяйский организм не погибнет. После этого множество таких частиц высвобождается и попадает в среду, где от инактивации их защищает белковый матрикс. Если восприимчивый хозяйский организм проглатывает такую частицу, то полиэдрин солюбилизируется и высвобождаются вирионы, способные инициировать новый инфекционный цикл.
Промотор гена полиэдрина чрезвычайно сильный, а цикл развития вируса не зависит от наличия самого гена. Следовательно, замена последнего генома чужеродного белка с последующей инокуляцией полученным рекомбинантным бакуловирусом культуры клеток насекомого может привести к синтезу большого количества гетерологичного белка, который благодаря сходству систем внесения посттрансляционных модификаций у насекомых и млекопитающих будет близок (а возможно, и идентичен) к нативной форме целевого рекомбинантного белка. Исходя из этого, на основе бакуловирусов были разработаны векторы для экспрессии генов, кодирующих белки млекопитающих и вирусов животных.
Наиболее широко используется вирус множественного ядерного полиэдроза Autographa californica (AcMNPV). Этот бакуловирус инфицирует более 30 других видов насекомых, а также хорошо растет в культуре многих клеточных линий. Линии клеток, обычно использующиеся для работы с рекомбинантным AcMNPV, получают из гусениц Spodoptera frugiperda. Промотор полиэдрина в этих клетках чрезвычайно активен, и при их заражении бакуловирусом дикого типа синтезируются большие количества белка.
Так, полученный в бакуловирусной системе экспрессии поверхностный белок ВИЧ был первым белком, использовавшимся для создания вакцины против СПИДа. Но пока данная система не получила широкого распространения, вероятно, вследствие трудоемкости процедуры и высокой стоимости получаемого продукта.
2.3. Трансгенныерастенияиживотные какбиореакторы
Задачей селекционеров во все времена было получение хозяйственно ценных растений, животных, микроорганизмов. Основными методами традиционной селекции являются отбор, гибридизация, мутагенез, полиплоидия с целью получения нужного признака, который кодируется новым геном или новым комплексом генов. Существенное продвижение в понимании того, как функционируют гены, расшифровка геномов и развитие методологии генной инженерии позволили перейти от длительных и трудоемких методов традиционной селекции к прямому генетическому конструированию нужных при-
Современные проблемы и методы биотехнологии. Учеб. пособие |
84 |

ГЛАВА 2. СОВРЕМЕННЫЕ УСПЕХИ ГЕНОМИКИ: ТРАНСГЕННЫЕ ОРГАНИЗМЫ
2.3. Трансгенные растения и животные как биореакторы
знаков у конкретного организма. При создании трансгенного организма новый генный комплекс конструируется в пробирке и напрямую вводится в организм, фактически таким методом получения нового признака ученые просто ускоряют эволюцию.
Новые методы селекции – это сочетание молекулярных и традиционных методов. Необходимо отметить, что старые методы также остаются широко востребованными при создании новых организмов. Выяснилось, что трансформированные с идентичной конструкцией ДНК трансгенные клоны, полученные параллельно в одном и том же опыте, значительно различаются по уровню экспрессии введенного гена, поскольку работает эффект положения и копийности гена. И необходимо проводить дальнейший отбор с анализом наследования полученного признака, используя традиционные методы селекции. Генно-инженерные манипуляции с геномом, сформировавшимся в процессе длительной эволюции, могут нарушать, в какой-то степени, сбалансированные генные комплексы и, соответственно, жизнеспособность полученных трансгенных организмов. Например, встраивание селективного гена, нужного только для отбора трансгенных растений, может нарушить первичную структуру какого-либо хозяйского гена и тем самым вызвать его инактивацию. Это событие, по-видимому, не так редко, особенно с учетом того, что трансгены чаще встраиваются в транскрибируемые области хроматина (эухроматин). В последующих поколениях такой инактивированный ген может перейти в гомозиготное состояние, выражаясь в непредусмотренной и обычно нежелательной фенотипической мутации. Появляется необходимость дальнейшего скрещивания и отбора для удаления нежелательных побочных мутаций у трансгенов. Иногда имеется необходимость удаления маркерных генов вообще, так что для получения новых организмов применяется сочетание старых и новых методов селекции.
В настоящее время практическая генно-инженерная биотехнология развивается по двум основным направлениям. Первое направление, получившее не очень удачное название «молекулярное разведение (или селекция)» (molecular breeding), специализируется на решении новыми методами традиционных селекционно-генетических проблем повышения продуктивности хозяйственно ценных организмов и их защиты от различных биотических и абиотических стрессовых факторов. Второе направление, названное «молекулярным производством» (molecular farming), специализируется на получении и использовании трансгенных организмов в качестве биореакторов, продуцирующих ценные для промышленности и медицины органические соединения.
Современные проблемы и методы биотехнологии. Учеб. пособие |
85 |

ГЛАВА 2. СОВРЕМЕННЫЕ УСПЕХИ ГЕНОМИКИ: ТРАНСГЕННЫЕ ОРГАНИЗМЫ
2.3.Трансгенные растения и животные как биореакторы
2.3.1.Конструированиетрансгенныхрастений
Возможность получения трансгенных растений основана на тотипотентности их некоторых клеток, т.е. способности в определенных условиях под действием фитогормонов дифференцироваться с образованием полноценного растения. Таким образом, из сконструированных генно-инженерными методами отдельных клеток можно получить фертильные растения, все клетки которых несут чужеродный генный комплекс (трансгенные растения). Если такое растение цветет и дает жизнеспособные семена, то желаемый признак передается последующим поколениям. Кроме того, многие растения легко размножаются вегетативно. Существующими приемами микроклонального размножения in vitro из микроскопических кусочков ткани (эксплантов) можно быстро получить за короткий промежуток времени генетически однородный посадочный материал с высоким коэффициентом размножения, что важно для последующего применения трансгенного организма.
Для создания трансгенного растения необходимо трансформировать культивируемые клетки, их протопласты или клетки в составе органов, отделить от нетрансформированных клеток и получить из отдельных клеток целые трансгенные растения (рис. 2.12). К настоящему времени для трансформации растений разработано несколько эффективных систем переноса рекомбинантной ДНК в клетки и экспрессирующих векторов, которые работают в ряде растительных клеток.
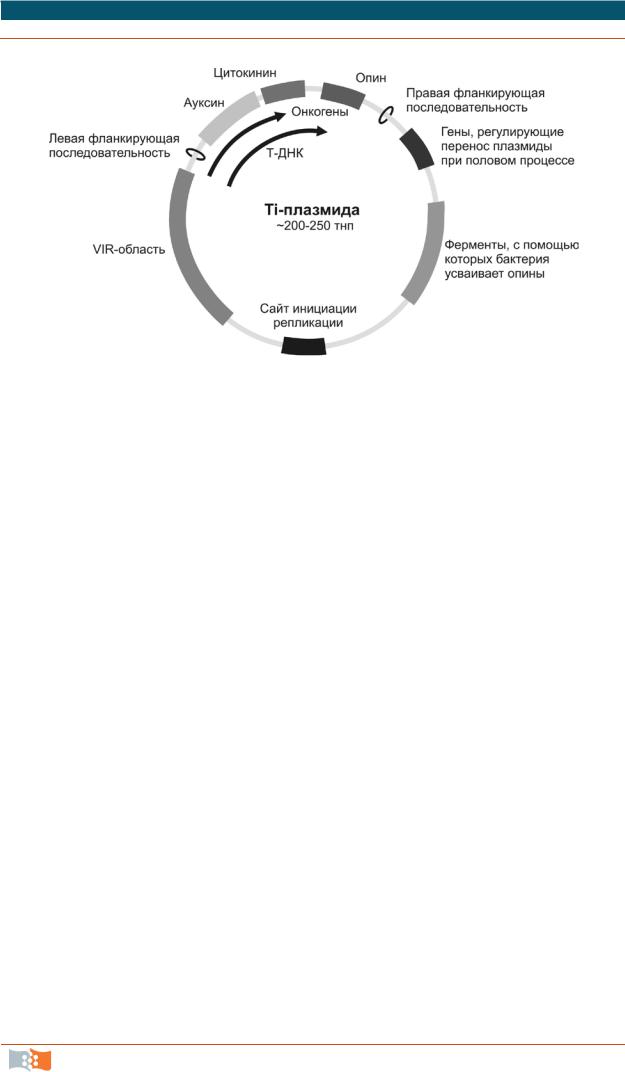
Векторы на основе Ti-плазмид. Бактерии рода Agrobacterium иногда называют природными генными инженерами за их способность переносить свою плазмидную ДНК в клетки зараженных растений, интегрировать ее в геном организма-хозяина и вызывать стабильную трансформацию этих клеток введенными генами. Все они приводят к образованию у двудольных растений корончатых галлов – трансформация индуцирует образование опухолей, похожих на раковые. Инфекционным агентом является так называемая
Ti-плазмида (tumor-inducing plasmid) в 200 –250 тнп (рис. 2.13), которая со-
держит все гены, необходимые для инфекционного процесса.
Рис. 2.12. Схема получения трансгенного растения трансформацией эксплантов (кусочки органа растения, например фрагменты тканей семядоли)
Современные проблемы и методы биотехнологии. Учеб. пособие |
86 |
ГЛАВА 2. СОВРЕМЕННЫЕ УСПЕХИ ГЕНОМИКИ: ТРАНСГЕННЫЕ ОРГАНИЗМЫ
2.3. Трансгенные растения и животные как биореакторы
Рис. 2.13. Схема Ti-плазмиды. Указаны основные гены и их группы. Сайт инициации репликации (ori) обеспечивает удвоение плазмиды при делении клетки Agrobacterium. Колечками обозначены левая и правая фланкирующие последовательности Т-ДНК
После присоединения Agrobacterium, несущей Ti-плазмиду, к растительной клетке, часть плазмиды, индуцирующей развитие опухоли (Т-ДНК (transferred DNA), 12–24 тнп в зависимости от штамма), транспортируется в клетку, по-видимому, с помощью механизма, аналогичного конъюгации. При этом Т-ДНК транспортируется в одноцепочечной форме, и именно в такой форме она встраивается в хромосомную ДНК растения. С переносимойТ-ДНК остаются связанными два кодируемых Ti-плазмидой белка, способствующие ее вырезанию, и третий белок покрывает оболочкой переносимую одноцепочечную ДНК, предохраняя от деградации. Все белки содержат сигнал ядерной локализации (NLS), который обеспечивает перенос Т-комплекса из цитоплазмы в ядро растительной клетки. Введенные гены Agrobacterium активируются в растении, программируя разрастание ткани (формируется галл), которая начинает синтезировать и секретировать опины. Опины – продукты конденсации амино- и кетокислот или аминокислот и сахаров Agrobacterium – используют как источник углерода и азота, причем другие исследованные почвенные микроорганизмы не способны использовать данные соединения. Таким образом, Agrobacterium генетически трансформирует растительные клетки в «биологические фабрики» по производству для себя «продуктов питания».
Введение генов непосредственно с помощью Ti-плазмид не используется, поскольку приводит к образованию опухолевых клеток, из которых невозможно получить целое растение. Для этих целей применяют небольшиевекторные молекулы на основе Ti-плазмид с удаленными онкогенами из переносимой Т-области, которая ограничена 24-нуклеотидными повторами. Вместо
Современные проблемы и методы биотехнологии. Учеб. пособие |
87 |

ГЛАВА 2. СОВРЕМЕННЫЕ УСПЕХИ ГЕНОМИКИ: ТРАНСГЕННЫЕ ОРГАНИЗМЫ
2.3. Трансгенные растения и животные как биореакторы
онкогенов встраивают последовательности клонируемой чужеродной ДНК и селективный маркер. Наличие сайта инициации репликации E. coli в составе Ti-вектора позволяет проводить в кишечной палочке все стадии сборки генетической конструкции. В качестве селективного маркера используют гены устойчивости к антибиотикам или гербицидам, которые дают возможность отбирать трансформированные клетки растений. После введения целевой ДНК рекомбинантным Ti-вектором трансформируют клетки агробактерий, несущих модифицированную Ti-плазмиду-помощницу с удаленной Т-областью, но содержащую все необходимое для переноса в растительные клетки T-ДНК части с рекомбинантной плазмиды. Такие вектора получили название бинарных, поскольку только вместе с плазмидой-помощницей они составляют пару из двух элементов для полноценного функционирования системы переноса генов в растительную клетку с помощью агробактерий.
Генетически модифицированные растения получают простой инкубацией любых частей растения с суспензией рекомбинантных агробактерий. Во всех случаях достигается высокоэффективный перенос рекомбинантной ДНК в геном трансформируемых клеток. Интеграция рекомбинантной ДНК происходит случайным образом с небольшим предпочтением участков активно транскрибируемых генов (эухроматин).
Для внедрения больших фрагментов ДНК в клетки растений путем введения фланкирующих Т-область последовательностей из Ti-плазмиды в состав векторов для клонирования больших фрагментов ДНК получены соответствующие космидные векторы, а также векторы на основе искусственных бактериальных хромосом (ВАС), получившие название TAC (transformationcompetent bacterial artificial chromosomes). ТАС-векторы могут быть репли-
цированы как в клетках Е. coli, так и агробактерий, что позволяет с помощью рекомбинантных агробактерий вводить в клетки растений фрагменты ДНК длиной более 150 тнп.
Другие векторы для конструирования трансгенных растений c пря-
мым введением чужеродных генов в виде очищенной ДНК в растительные клетки также разработаны, поскольку эффективные системы переноса генов в растительный геном с помощью агробактерий работают не для всех видов растений. Эти векторы в основном предназначены для сборки эффективной экспрессионной генной конструкции в E. coli с последующим введением в
растительную в клетку очищенной ДНК. Наиболее известные способы доставки рекомбинантной ДНК в растительные клетки приведены в табл. 2.1 (подробно о способах доставки ДНК в клетки см. п. 2.1.6).
Современные проблемы и методы биотехнологии. Учеб. пособие |
88 |

ГЛАВА 2. СОВРЕМЕННЫЕ УСПЕХИ ГЕНОМИКИ: ТРАНСГЕННЫЕ ОРГАНИЗМЫ
2.3. Трансгенные растения и животные как биореакторы
|
Таблица 2.1 |
Методы введения рекомбинантной ДНК в растительные клетки |
|
|
|
Метод |
Комментарий |
Использование Ti-плазмид |
Высокоэффективная система, но применима не |
|
для всех видов растений |
Бомбардировка микрочастицами |
Эффективный и дешевый способ для широкого |
(биобаллистика) |
круга растений (см. п. 2.1.6) |
Использование вирусных |
Пока неэффективный способ доставки ДНК в |
векторов |
растительные клетки |
Микроинъекции |
Имеют ограниченное применение, поскольку |
|
единовременно можно сделать инъекцию лишь в од- |
|
ну клетку |
Введение ДНК в протопласты с |
Применяются только для введения генов в про- |
трансфекционными реагентами |
топласты (клетки с удаленной клеточной стенкой), из |
Электропорация |
которых могут быть регенерированы жизнеспособ- |
Слияние с липосомами |
ные растения |
Растительные векторы отличаются главным образом различными сигнальными и регуляторными последовательностями, которые обеспечивают эффективную транскрипцию генов в растительных тканях, и различными селективными маркерами. Наиболее важными из регуляторных последовательностей являются проксимальный участок промотора, связывающий РНК-по- лимеразу; участок, кодирующий 5'-конец мРНК, необходимый для связывания с рибосомой и инициации трансляции, и эукариотический сигнал полиаденилирования на 3'-конце мРНК. Среди эукариотических организмов эти конститутивные сигнальные элементы оказались, к счастью, высококонсервативными и достаточно универсальными, так что растительные клетки в основном правильно экспрессируют чужеродные гены не только растений других видов, но и млекопитающих, дрожжей и других эукариот. Но для обеспечения достаточного уровня работы чужеродного гена необходимы сильные регуляторные и сигнальные элементы экспрессии, в которых ключевыми являются промоторы, хорошо работающие именно в клетке-мишени. Как и в других системах, для конструирования растительных векторов популярны элементы экспрессионной системы вирусов. В настоящее время одним из наиболее широко используемых промоторов для двудольных является сильный конститутивный 35S-промотор, выделенный из вируса мозаики цветной капусты (ВМЦК, CaMV) из группы каулимовирусов. Также для двудольных широко используется nos-промотор гена нопалин-синтазы агробактерий, хотя он намного слабее 35S; для однодольных – промоторы гена алкогольдегидрогеназы кукурузы (Adh) и гена актина 1 риса (Act).
Во многих векторах для трансформации растений как селективный, так и целевой гены находятся под контролем все того же классического 35S-промотора. Наличие рядом двух копий 35S-промотора может отрица-
Современные проблемы и методы биотехнологии. Учеб. пособие |
89 |

ГЛАВА 2. СОВРЕМЕННЫЕ УСПЕХИ ГЕНОМИКИ: ТРАНСГЕННЫЕ ОРГАНИЗМЫ
2.3. Трансгенные растения и животные как биореакторы
тельно сказываться на уровне экспрессии, поскольку множественные копии этого вирусного промотора в геноме могут быть одной из причин «замолкания» трансгена (явление сайлесинга (gene silencing) в ряду поколений, см. п. 2.3.3). В этой связи в настоящее время ведется как поиск новых, более эффективных промоторов, так и создание их химерных форм. Особенно нужны эффективные тканеспецифичные и индуцибельные промоторы для тканеспецифичной и/или индуцированной экспрессии трансгена. Экспрессия под сильными конститутивными промоторами, с одной стороны, приводит к большому количеству целевого белка, с другой – к синтезу этого белка во всех тканях растения, что может отрицательно сказаться на жизнеспособности и стабильности трансгенного растения и часто нежелательно для исследователей.
Векторы для трансформации хлоропластов высших растений
(транспластомные векторы) относятся к интегративным векторам. Хлоропласты содержат полноценную генетическую систему, сходную с прокариотическими, т.е. все компоненты, необходимые для экспрессии генетической информации, включая белоксинтезирующий аппарат. Геном хлоропластов (пластом) размером 130–160 тнп заключает в себе более 100 различных генов. Векторы для трансформации хлоропластов предназначены для интеграции чужеродной ДНК в пластом с помощью гомологичной рекомбинации. Представляют собой кольцевые молекулы ДНК, содержащие кроме обычного векторного набора два участка длиной по 1-2 тнп, гомологичные последовательностям ДНК хлоропластов, в которую и происходит встраивание. Экспрессионная кассета между этими гомологичными последовательностями состоит из 5'-некодирующей области с промотором, регулирующим транскрипцию (иногда включает последовательность лидерного пептида перед множественным клонирующим сайтом для целевой ДНК) и 3'-некодирующей регуляторной области с терминатором транскрипции, стабилизирующей структуру мРНК, что является одним из условий достижения высокого уровня экспрессии трансгена в хлоропластах. Для получения эффективной транскрипции клонированного гена часто используют сильный Prrn-промотор оперона рибосомальных рРНК (rrn). В зависимости от размера хлопластной ДНК растения данная векторная система позволяет вводить в геном хлоропластов фрагменты ДНК длиной до 50 тнп, содержащие до 20–30 генов. В геноме хлоропластов описано, по крайней мере, около 20 сайтов, по которым удалось получить продуктивную интеграцию вектора.
Получение транспластомных растений, содержащих генетически измененные хлоропласты, является одним из перспективных направлений, поскольку хлоропласты не переносятся с пыльцой, а значит, устраняется опасность распространения трансгенов с пыльцой среди перекрестно опыляемых растений близких видов. Кроме того, сама пыльца трансгенных растений ме-
Современные проблемы и методы биотехнологии. Учеб. пособие |
90 |
