
Современные проблемы и методы биотехнологии
.pdf
ГЛАВА 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ
4.2. Условия и методы культивирования тканей in vitro
Ауксин играет важную роль в процессах регенерации при размножении каллусных клеток; в процессе образования придаточных и боковых корней, луковиц, при заложении вегетативных почек.
Механизм действия ауксина на рост клетки связывают с активацией Н+ – выкачивающего насоса в плазмолемме. Происходит подкисление клеточной стенки, что приводит к разрыву целлюлозных и пектиновых полимеров. Это облегчает растяжение растущей клетки под действием тургорного давления.
Избыток ауксина разрушается ИУК-оксидазой.
Синтетические ауксины. Для практических целей в сельском хозяйстве часто применяют не ИУК, а синтетические ауксины, так как они в растениях не разрушаются ИУК-оксидазой. Молекулы синтетических ауксинов имеют разную структуру, но содержат ароматическое или гетероциклическое кольцо, боковая часть которого представлена остатком алифатической кислоты. По действию синтетические ауксины относят: к сильным– индолил-3-масляная кислота (ИМК), а-нафтил-1-уксусная кислота (НУК), 2,4-дихлорфеноксиук- сусная кислота (2,4-Д); слабым – фенилуксусная кислота (ФУК), фенилмасляная (ФМК).
Гиббереллины обнаружены в 20-е гг. японскими исследователями в виде продуктов обмена веществ Fusarium moniliforme – конидиальной (споровой) стадии сумчатого гриба (аскомицета) Gibberellafujikuroi.
Гиббереллины – это дитерпеноиды с тетрациклическим гиббереллановым скелетом из 19-20 С-атомов. В тканях растений одновременно встречаются несколько гиббереллинов, а в процессе онтогенеза их набор и соотношение изменяются.
Подобно ауксинам, гиббереллины оказывают множественные действия: стимулируют рост в фазе растяжения и деления клеток (например, камбия), вызывают рост плодов. Рост в фазе растяжения стимулируется одновременно действием гиббереллинов и ауксина. В других случаях гиббереллины могут выступать как антагонисты ауксина, например задерживать рост придаточных корней. Для практических целей наиболее часто используют гибберелловую кислоту (А3).
Цитокинины были открыты как фактор, регулирующий деление клеток в культуре изолированных тканей и названный кинетином (от слова «кинез»– деление). Другой природный цитокинин назван зеатином, так как был выделен из семян кукурузы в стадии молочной спелости.
Сейчас известно еще 12 цитокининов, их химическое строение близко к строению зеатина. Показана высокая кининовая активность и у дифенилмочевины и ряда ее производных. В процессе эволюции этот класс фитогормонов, так же как и ауксины, начал формироваться очень рано. Цитокинины широко распространены в растительном мире: от водорослей до цветковых растений. Соединения с цитокининовой активностью обнаруживаются уже у бактерий.
Цитокинины представляют собой N-замещенные производные аденина и синтезируются в растении из двух главных предшественников — мевало-
Современные проблемы и методы биотехнологии. Учеб. пособие |
171 |

ГЛАВА 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ
4.2. Условия и методы культивирования тканей in vitro
новой кислоты и 5'-АМФ. Возможен синтез цитокининов из продуктов распада некоторых тРНК, содержащих модифицированный аденозин.
Действие цитокининов проявляется прежде всего в ускорении клеточных делений, что опосредуется усилением синтеза ДНК, РНК, белков. Благодаря этому замедляется старение клеток и повышается их устойчивость к неблагоприятным факторам среды. Во многих случаях для проявления действия цитокининов необходимо присутствие ауксина или одновременно и ауксина, и гиббереллинов. Под действием кинетина происходит рост активности многих ферментов.
Применение фиторегуляторов в культуре изолированных тканей
(табл. 4.3). Фитогормоны в культуре изолированных тканей необходимы для дедифференцировки клеток и индукции клеточных делений. Поэтому чтобы получить каллусные ткани, в состав питательных сред обязательно должны входить ауксины, вызывающие клеточную дедифференцировку, и цитокинины, индуцирующие деление клеток. В случае индукции стеблевого морфогенеза содержание ауксинов в среде может быть снижено или они могут быть полностью исключены из питательной среды.
Таблица 4.3
Фитогормоны и их синтетические аналоги, наиболее часто используемые в культуре изолированных тканей (данные Н.В. Зобовой)
Ауксины |
Цитокинины |
2,4-дихлорфеноксиуксусная кислота |
Аденин |
р-хлорфеноксиуксусная кислота |
6-бензиламинопурин |
Индол-3-уксусная кислота |
N-бензил-9(2-тетрагидропиранил)-аденин |
Индол-3-ацетилаланин |
6-γ-γ-диметилаллиламинопурин |
Индол-3-ацетил-аспарагиновая кислота |
1 ,3-дифенилмочевина |
Индол-3-ацетилглицин |
Кинетин |
Индол-3-масляная кислота и ее калиевая соль |
Зеатин |
ά-нафтилуксусная кислота |
|
На безгормональной среде растут опухолевые и «привыкшие» ткани, Автономность этих клеток по отношению к обоим гормонам или к одному из них связана со способностью их продуцировать.
Чаще всего в качестве источника ауксинов в питательных средах используется 2,4-Д (2,4-дихлорфенокисиуксусная кислота), ИУК (индолилуксусная кислота), НУК (ά -нафтилуксусная кислота). Для получения рыхлого, хорошо растущего каллуса чаще применяют 2,4-Д. ИУК почти в 30 раз менее активна, чем 2,4-Д. В качестве источников цитокининов в искусственных питательных средах используется кинетин, 6-БАП (6-бензиламинопурин), зеатин. 6-БАП и зеатин проявляют более высокую активность в поддержании роста изолированных тканей и индукции органогенеза по сравнению с кинетином. Смешанными функциями обладают абсцизовая, коричная и гибберел-
Современные проблемы и методы биотехнологии. Учеб. пособие |
172 |

ГЛАВА 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ
4.2. Условия и методы культивирования тканей in vitro
ловая кислоты, флороглюцинол, 2,2-диметилгидразид янтарной кислоты. Из гиббереллинов в составе культуральных сред используют гибберелловую кислоту как наиболее доступную для индукции побегообразования у цитрусовых и для поддержания роста суспензионных культур.
Цитокинины в состав сред включают для стимуляции клеточного деления в каллусных и суспензионных культурах, в культурах протопластов, при регенерации проростков из соматических эмбриоидов или стеблевых почек. Абсцизовую кислоту применяют при культивировании протопластов.
4.2.3. Стерилизацияпитательныхсред
Богатая питательная среда – прекрасный субстрат для развития в ней микроорганизмов. Для обеззараживания питательных сред используют химическое воздействие (дезинфекция), воздействие температуры и других физических факторов (ультразвук, ультрафиолетовые лучи, ультрафильтрация). Каждый из этих методов весьма избирателен для применения.
В биотехнологии широко используют термические методы обеззараживания (автоклавирование, стерилизацию, кипячение, пастеризацию и др.) [1, 8].
Как известно, отдельные компоненты питательных сред также поразному реагируют на термическое воздействие. Особенно термолабильны органические соединения: витамины, углеводы, гормоны и др. Сложные сахара и полисахариды при автоклавировании частично гидролизуются. Степень гидролиза зависит от источника углерода, температуры и продолжительности автоклавирования. При высоких температурах происходит карамелизация сахаров. Растворы, содержащие аминокислоты и восстанавливающие сахара, при термическом воздействии приобретают коричневатый цвет вследствие сахароаминных реакций.
Все эти процессы сильно зависят от рН используемой среды. Существует сложная зависимость между рН среды, содержанием ионов, температурой, продолжительностью автоклавирования, с одной стороны, и степенью термодеградации питательных сред – с другой.
Во избежание нежелательных деструктивных изменений компонентов питательных сред (субстратов) применяют по возможности более мягкие режимы стерилизации (табл. 4.4) или раздельную стерилизацию компонентов. Высокие, но кратковременные температурные режимы инактивируют споры бактерий, оказывая минимальное влияние на биологически активные компоненты среды. В лабораторных условиях стерилизацию питательных сред и некоторых других объектов проводят в автоклавах паром под давлением, соблюдая необходимые режимы. В отдельных случаях прибегают к сухожаровой стерилизации.
Современные проблемы и методы биотехнологии. Учеб. пособие |
173 |

ГЛАВА 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ
4.2. Условия и методы культивирования тканей in vitro
Таблица 4.4
Режимы стерилизации питательных сред
Температура, °С |
Пар под давлением |
Сухой жар, мин |
||
Время, мин |
Давление, атм |
|||
|
|
|||
121 |
15 |
1 |
– |
|
126 |
10 |
1,4 |
– |
|
134 |
3 |
2 |
– |
|
140 |
– |
– |
180 |
|
150 |
– |
– |
150 |
|
160 |
– |
– |
120 |
|
170 |
– |
– |
60 |
|
Установлено, однако, что температура выше 121 оС может быть причиной нарушения качества сред и, как следствие, плохого роста культур. К тому же в принципе желательна стерилизация автоклавированием небольших объемов питательных сред, что при прочих равных условиях позволяет уменьшать время стерилизации, так как укорачивается период прогрева проб(табл. 4.5).
В последнее десятилетие широкое распространение для получения стерильных воздуха и различных жидкостей приобрела мембранная фильтрация. Это разновидность холодной стерилизации, которая эффективна для стерилизации термолабильных веществ [2, 8].
Таблица 4.5
Рекомендуемые интервалы стерилизации разных объемов сред (t = 121 оС) [8]
Объем среды, мл |
Минимальное время стерилизации, мин |
25 |
20 |
50 |
25 |
100 |
28 |
250 |
31 |
500 |
35 |
1 000 |
40 |
2 000 |
48 |
4 000 |
63 |
Промышленный выпуск мембранных фильтров был начат с конца 40-х гг. прошлого столетия. Согласно Р.Е. Кестингу (1971), наиболее распространенными процессами являются обычная фильтрация (макрофильтрация – 1–103 мкм), микрофильтрация (2·10 –2–10 мкм), ультрафильтрация (10–3– 2·10–2 мкм), диализ (10–3мкм–1 нм). Если для макрофильтрации применяются обычные бумажные или стеклянные фильтры, то для остальных используются нитроцеллюлозные, ацетилцеллюлозные, поливинильные, полиамид-
Современные проблемы и методы биотехнологии. Учеб. пособие |
174 |

ГЛАВА 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ
4.2. Условия и методы культивирования тканей in vitro
ные, фторуглеродные мембраны толщиной менее 0,1 мкм с высокой степенью пористости и с диаметром пор в пределах 10–4–10 мкм. Для стерилиз а- ции в биотехнологических целях достаточно микрофильтрации.
4.2.4. Основныетребованиякусловиямкультивирования
Все манипуляции с культурой изолированных тканей растений проводятся в стерильных условиях. Комплекс мер, обеспечивающих асептику биотехнологических процессов, включает механическую, физическую и химическую защиту биообъекта и среды его обитания, а при необходимости – и конечного продукта [2, 8]. Асептика предусматривает влажную уборку помещений, обработку их ультрафиолетовыми лучами, антисептическими средствами, использование стерильных инструментов, сред, технологической одежды, подачу стерильного воздуха (столы с ламинарным потоком стерильного воздуха в боксированных помещениях, поступление в ферментатор стерильного воздуха через барботер – от франц. barbotage – перемешивание) и пр.
К механической защите относятся удаление механических примесей, например, из воздуха, культиваторов; герметизация оборудования, изоляция узлов и соединений; к физической – обработка воздуха и поверхностей приборов и аппаратов ультрафиолетовыми лучами, кипячение, стерилизация паром под давлением, обработка ультразвуком; к химической – обработка рабочих поверхностей и биообъектов химическими антисептиками.
В производственных условиях источниками микробов-контаминантов могут быть почва, вода, окружающий воздух, люди. Из почвы в сферу биотехнологических процессов попадают спорообразующие палочки-бациллы, конидии грибов, актиномицеты; эти же микроорганизмы с пылью могут попасть в воздух, из которого они способны проникнуть в среду выращивания биообъекта или в конечный продукт производства
Культивирование изолированных тканей растений происходит на свету. Освещенность факторостатной (световой) комнаты должна составлять в зависимости от культуры 1 000–10 000 лк. Необходимо учитывать фотопериод, который требуется для данного культивируемого объекта.
Влажность в световой комнате должна быть 60–70 %. Более сухой воздух способствует усыханию питательной среды в пробирках и колбах, особенно если они закрыты ватными пробками, изменению ее концентрации, а значит, и нарушению условий культивирования. Для повышения влажности в комнате можно использовать поддоны с водой.
Оптимальная температура для большинства культивируемых тканей – 25–26 °С, для культуры тканей тропических растений – 29–30 °С. В случае индукции морфогенеза температуру понижают до 18–20 °С.
Для успешного культивирования изолированных клеток и тканей растений необходимо соблюдать определенные условия. Большинство каллусных тканей не нуждается в свете, так как не имеет хлоропластов и питается
Современные проблемы и методы биотехнологии. Учеб. пособие |
175 |

ГЛАВА 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ
4.2. Условия и методы культивирования тканей in vitro
гетеротрофно. Исключение составляют некоторые зеленые каллусные ткани, такие, например, как ткань мандрагоры. Каллусные ткани получают в темноте или при рассеянном свете, а для успешного морфогенеза их переносят в помещения с интенсивным освещением 1 000–4 000 лк.
Световой и температурный режимы, как и остальные условия, зависят от выполняемых задач. Наилучшие их параметры, а также режим оптимальной влажности можно создать с помощью климатических камер.
4.3. Направленияивозможностииспользования культурыизолированныхтканейрастений
Методы культивирования изолированных клеток, органов и тканей находят широкое применение в экспериментальной биологии и используются во многих биотехнологических процессах, в которые включены высшие растения.
Если биологической основой культуры изолированных тканей является тотипотентность растительных клеток, то обеспечение этого процесса складывается путем подбора питательных сред определенного состава, регуляторов роста и технических (физических) условий введения в культуру и собственно процесса культивирования (выбор экспланта, стерилизация, освещенность, температура и др.).
4.3.1. Основныенаправленияиспользования
Культура клеток и тканей растений может использоваться в двух основных направлениях: 1) размножение или поддержание жизни у неизмененных по сравнению с донорами клеток, тканей, растений; 2) целенаправленное воздействие на изменение генетического статуса клеток и отбор в селективных условиях нужных вариантов.
Возможности культуры изолированных клеток и тканей растений весьма обширны [9–11]:
1)получение вторичных метаболитов, продуцируемых отдельными клетками и тканями некоторых полезных растений (алкалоидов, глюкозидов, стероидов и т.д.), используемых для производства лекарств;
2)клеточная и тканевая селекция форм с полезными хозяйственными свойствами;
3)генетическое улучшение сельскохозяйственных растений;
4)ускоренное (микроразмножение) ценных и уникальных генотипов и поддержание жизнеспособности ослабленных клеток и тканей;
5)освобождение (оздоровление) посадочного материала от вирусной инфекции;
6)сохранение генофонда в условиях криоконсервации.
Современные проблемы и методы биотехнологии. Учеб. пособие |
176 |

ГЛАВА 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ
4.3.Направления и возможности использования культуры изолированных тканей растений
Сиспользованием методов культивирования также решается большое число теоретических проблем, в том числе:
–особенности старения растительной клетки;
–процессы цитодифференцировки и морфогенеза;
–роль фитогормонов, углеводов, витаминов, минеральных веществ при каллусогенезе, органогенезе, морфогенезе;
–взаимоотношения клеток высших растений с клубеньковыми бактериями и микоризными грибами;
–механизмы устойчивости растений к неблагоприятным факторам среды: абиотическим (засолению, кислой среде, низким температурам и т.д.), биотическим (патогенам разного происхождения, вызывающим болезни растений);
–регуляция вторичного обмена;
–механизмы опухолеобразования;
–механизмы сомаклональной изменчивости;
–популяционные взаимоотношения в клеточной культуре.
4.3.2. Проблемыкультивированияизолированныхтканей
Успех в применении культуры клеток и тканей зависит от оптимизации физиологических процессов, обеспечивающих нормальное деление клеток, их дифференциацию и регенерацию из них взрослых растений, что определяется многими факторами, прежде всего используемыми гормонами. Наиболее сложной является регенерация растений из отдельных клеток. В первую очередь это касается злаковых растений, поэтому важнейшее значение имеет выяснение механизмов морфогенеза in vitro, регенерации и лежащих в их основе процессов.
Высокая способность к образованию растений-регенерантов при культивировании in vitro тканей и клеток растений является необходимым условием эффективного применения многих клеточных технологий.
В старых пересадочных культурах может протекать процесс, получивший название «привыкание». Он связан с усилением клеточной дедифференцировки, приобретением автономности по отношению к гормонам и превращением каллусных клеток в клетки химических опухолей. «Привыкание» тканей препятствует в большинстве случаев получению растений-регенерантов. Утрата регенерационной способности наблюдается также при длительном пассировании у гормонозависимых, т.е. нормальных, каллусных тканей.
Новообразование растений в культивируемых каллусных культурах в значительной степени определяется генотипом и физиологическим статусом экспланта. В связи с этим способ отбора генотипов и эксплантов, эффективных к образованию морфогенетических структур в культуре in vitro, представляет собой актуальную задачу. Решение ее сопряжено с разработкой ряда физиологических проблем, одной из которых является изучение особенно-
Современные проблемы и методы биотехнологии. Учеб. пособие |
177 |

ГЛАВА 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ
4.3. Направления и возможности использования культуры изолированных тканей растений
стей целого растения, обуславливающих поведение его органов и тканей в культуре in vitro.
Имеются данные, которые указывают на связь способности к регенерации растений в культуре первичных эксплантов с модификацией клеточного метаболизма, функционированием меристем и морфогенезом растения, которые, в свою очередь, определяются гормональным балансом.
Есть данные о положительном влиянии кустистости и об отрицательном влиянии скороспелости растений картофеля на число побегов в первичном каллусе клубневых дисков. Склонность к образованию многочисленных придаточных корней в природе находит отражение в высоком уровне ризогенеза в каллусной культуре. У гороха отмечен высокий коэффициент корреляции между азотфиксацией (нитрогеназная активность, интенсивность образования клубеньков, число клубеньков) и каллусо- и корнеобразованием. Предполагается, что общая причина формирования клубеньков на корнях растений и образования каллуса в культуре in vitro заключается в способности генотипа к пролиферации клеток, определяемой балансом фитогормонов. Показана связь между полиэмбрионией семян in vivo и числом соматических эмбриоидов в культуре in vitro у ржи. Выявлено большое сходство при формировании эмбриоидов в семени пиона (Paeonia anomala L.) in vivo и в культуре in vitro (образование эмбриоидов из клеток эпидермиса, характер их развития, форма эмбриоидов и др.). Отмечена отрицательная корреляция между частотой образования нередуцированных пыльцевых зерен и способностью к андрогенезу в культуре пыльников у картофеля. Возможно, это свидетельствует о сцеплении генов, контролирующих формирование эмбриоидов и первое деление при образовании реституционных ядер.
У раннеспелых сортов в культуре первичного каллуса, полученного из развивающихся зародышей, уровень множественной регенерации растений ниже, чем у позднеспелых. Одной из причин низкого уровня множественной регенерации растений в группе раннеспелых сортов может быть более быстрое развитие зародышей, что определяет более короткий период компетентности их клеток.
В работах, проведенных на злаках, показано влияние на процесс регенерации в культуре in vitro отдельных генов, вовлеченных в контроль гормонального баланса растений. Для пшеницы установлено влияние генов, обуславливающих короткостебельность, и гена, определяющего чувствительность к длине дня на рост каллуса, на соматический эмбриогенез и регенерацию растений. У ячменя выявлена сопряженность высокой регенерационной способности с числом рядов в колосе.
Известно, что древесные, и особенно хвойные, деревья характеризуются медленным ростом, трудно укореняются, содержат большое количество вторичных соединений (фенолы, терпены и другие вещества), которые в изолированных тканях активируются, окисляя фенолы растений, различные фенолазы. В свою очередь, продукты окисления фенолов обычно ингибируют деление и рост клеток, что ведет к гибели первичного экспланта или к уменьшению способности тканей древесных пород к регенерации адвентив-
Современные проблемы и методы биотехнологии. Учеб. пособие |
178 |

ГЛАВА 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ
4.3. Направления и возможности использования культуры изолированных тканей растений
ных почек, которая с возрастом растения-донора постепенно исчезает полностью. Однако несмотря на все трудности, исследователи все чаще привлекают в качестве объектов исследований различные ткани и органы древесных растений.
Вцелом исследования влияния отдельных характеристик целого растения на поведение его частей в культуре in vitro малочисленны и фрагментарны.
4.4.Клональноемикроразмножениерастений
Вприроде существует два способа размножения растений: половой (семенной) и вегетативный. Эти способы имеют свои преимущества и недостатки. К недостаткам семенного размножения следует отнести генетиче-
скую пестроту получаемого посадочного материала и длительность ювенильного периода. При вегетативном размножении сохраняется генотип материнского растения и сокращается продолжительность ювенильного периода. Однако для большинства видов (в первую очередь для древесных пород) проблема вегетативного размножения остается до конца не решенной. Это обусловлено следующими причинами:
1)не все породы, даже на ювенильной стадии, могут размножаться вегетативным способом с требуемой эффективностью (дуб, сосна, ель, орехоплодные и др.);
2)практически невозможно с помощью черенкования размножать многие виды древесных пород в возрасте старше 10–15 лет;
3)не всегда удается получать стандартный посадочный материал (существует возможность накопления и передачи инфекции);
4)операции при размножении взрослых (древесных) растений с помощью прививок отличаются трудоемкостью и сложностью;
5)разработанные технологии не эффективны для получения достаточного количества генетически однородного материала в течение года.
Достижения в области культуры клеток и тканей привели к созданию принципиально нового метода вегетативного размножения – клонального микроразмножения (получение в условиях in vitro (в пробирке) неполовым путем растений, генетически идентичных исходному экземпляру). В основе метода лежит уникальная способность растительной клетки реализовывать присущую ей тотипотентность, т.е. под влиянием экзогенных воздействий давать начало целому растительному организму.
Для обозначения растений, полученных бесполым размножением, в 1903 г. Уэббер из Министерства сельского хозяйства США ввел термин клон от греч. clon – черенок (побег), пригодный для размножения.
Клон – популяция клеток, возникших из одной клетки посредством митоза, или группа растений, развившихся вегетативным или бесполым путем, все члены которой произошли из одной повторно культивируемой клетки.
Клональное микроразмножение – получение in vitro неполовым путем
растений, генетически идентичных исходному.
Современные проблемы и методы биотехнологии. Учеб. пособие |
179 |
ГЛАВА 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ
4.4.Клональное микроразмножение растений
4.4.1.Этапыиметодыклональногомикроразмножениярастений
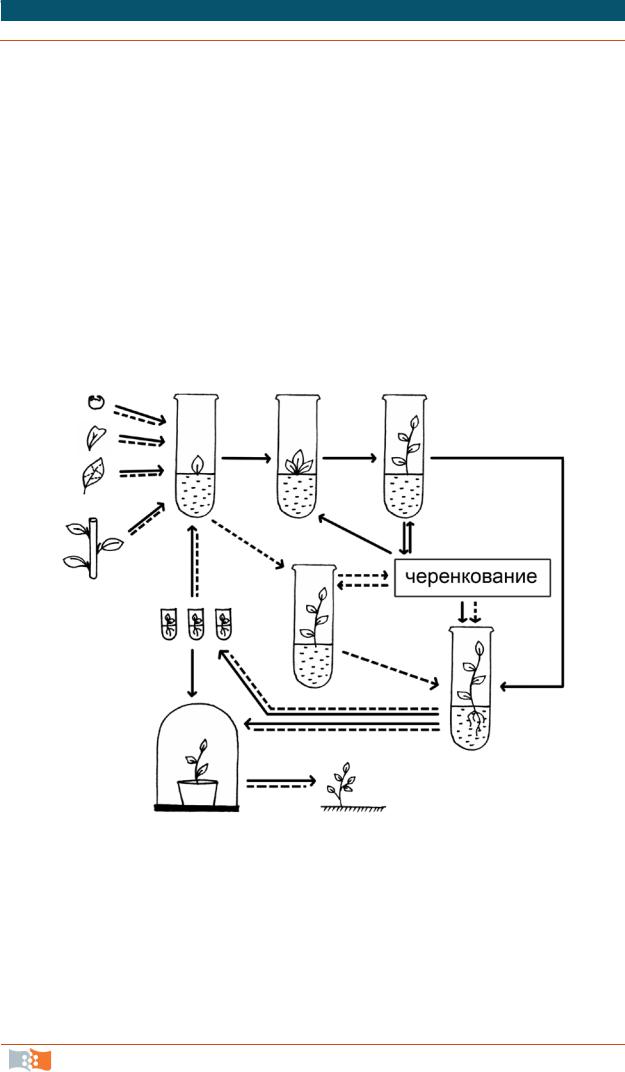
Процесс клонального микроразмножения можно разделить на четыре этапа: 1 – выбор растения-донора (донор – растение, часть которого вводится в культуру), изолирование эксплантов (эксплант – ткань, взятая из своего оригинального места и перенесенная в искусственную среду для роста и поддержания жизнедеятельности) и получение хорошо растущей стерильной культуры; 2 – собственно микроразмножение, когда достигается получение максимального количества мериклонов (микропобегов); 3 – укоренение размноженных побегов с последующей адаптацией их к почвенным условиям, а при необходимости депонирование растений-регенерантов при пониженной температуре (2–10 оС); 4 – выращивание растений в условиях теплицы и подготовка их к реализации или посадке в поле (рис. 4.1) [12, 14].
Рис. 4.1. Схема клонального микроразмножения растений: I путь – активация развития существующих меристем; II путь – индукция возникновения адвентивных почек; 1 – выбор исходного экспланта; 2 – получение стерильной культуры; 3 – образование адвентивных почек на первичном экспланте; 4 – рост почек и формирование микропобегов; 5 – размножение микропобегов; 6 – укоренение микропобегов; 7 – депонирование растений-регенерантов; 8 – акклиматизация
растений к грунту; 9 – высадка регенерантов в поле
Современные проблемы и методы биотехнологии. Учеб. пособие |
180 |
