
Современные проблемы и методы биотехнологии
.pdf
ГЛАВА 3. МЕД-Я БИОТЕХНОЛОГИЯ: ОСНОВЫ МОЛЕКУЛ-Й ТЕРАПИИ И ДИАГНОСТИКИ СОЦ. ЗНАЧ. ЗАБОЛЕВАНИЙ
3.1. Геном человека
ный методом произвольного секвенирования полного генома (более известный как произвольное секвенирование методом дробления), который позволял со-
брать полный геном из частично секвенированных фрагментов ДНК при помощи компьютерной модели.
Этим методом впервые был полностью секвенирован геном самореплицирующегося свободно живущего организма – бактерии Haemophilus influenzae Rd. Копии ДНК бактерии были разрезаны на куски произвольной длины от 200 до 1 600 п.о. Эти фрагменты секвенировали по несколько сот с каждого конца. Кроме того, были секвенированы и более длинные фрагменты по 15–20 тыс. п.о. Полученные последовательности были внесены в компьютер, который их сравнивал, распределял по группам и по сходству. Первыми идентифицировались неповторяющиеся последовательности, затем – повторяющиеся последовательности фрагментов. Длинные фрагменты помогали установить порядок часто повторяющихся, почти идентичных последовательностей. Затем заполнялись пробелы между полученными основными кусками ДНК. Секвенирование геномаHaemophilus influenzae заняло один год и при этом была определена последовательность 1 830 137 п.о. и 1 749 генов, расположенных на 24 304 фрагментах. Это был несомненный успех, который доказал, что новая технология может быть применима для быстрого и точного секвенирования целых геномов. В 1996 г. картировали геном первой эукариотической клетки – дрожжевой, а в 1998 впервые секвенировали геном многоклеточного организма – круглого земляного червя Caenorhabolits elegans.
Вфеврале 2001 г. рабочий вариант генома человека (выполненный на 90 %) был одновременно опубликован в журналах «Nature» – результаты HUGO и «Science» – результаты исследований компании Celera. Анализ полученного варианта генома человека выявил около 25 тыс. генов. Ранее предполагалось, что это количество должно достигать 140 тыс. (если исходить из постулата «один ген кодирует один белок»). В настоящее время представляется возможным, что один ген может кодировать 5-6 белков. Многообразие белков, кодируемых одним и тем же геном, обеспечивается несколькими механизмами: с помощью альтернативного сплайсинга, посттрансляционных превращений белков – фосфорилирования, ацетилирования, метилирования, гликозилирования и многих других.
В2003 г. был опубликован окончательный вариант полной последова-
тельности генома человека. Вся эта информация является доступной и нахо-
дится в Интернете на нескольких сайтах (см.: http://jbirc.jbic.or.jp/g-compass).
Однако до сих пор некоторые элементы генома не поддаются секвенированию современными технологиями, а наши знания о геноме остаются неполными. Оказалось, что лишь 30 % генома кодируют белки и участвуют в регуляции действия генов. Каковы функции остальных участков генома и есть ли они вообще, остается совершенно неясным. Около 10 % генома составляют так называемые Alu-элементы длиной около 300 п.о. Они появились неизвестно откуда в ходе эволюции только у приматов. Попав к человеку, они
Современные проблемы и методы биотехнологии. Учеб. пособие |
121 |

ГЛАВА 3. МЕД-Я БИОТЕХНОЛОГИЯ: ОСНОВЫ МОЛЕКУЛ-Й ТЕРАПИИ И ДИАГНОСТИКИ СОЦ. ЗНАЧ. ЗАБОЛЕВАНИЙ
3.1. Геном человека
размножились до полумиллиона копий и распределились по хромосомам самым причудливым образом. Что касается кодирующих участков ДНК, то при чисто молекулярно-компьютерном анализе они были названы генами по сугубо формальным критериям: наличию знаков пунктуации, необходимых для прочтения информации и синтеза конкретного генного продукта. При этом время и действие большинства потенциальных генов пока неясны, и для определения их функций может потребоваться не меньше ста лет.
3.1.2. Построениегенетическихкартхромосом
Сиквенс генома – это всего лишь последовательность из одних и тех же четырех букв в бесконечной вариации. Взглянув на нее, никто не сможет мгновенно вычислить ее функцию. Однако, вставив последовательность оснований на правильное место в геноме, можно получить ключ к разгадке ее функции. Карта генома – это графическая схема, позволяющая исследователям ориентироваться в геноме, искать в нем места, которые могут быть ва ж- ны и интересны. В простейшем виде карта генома представляет собой линию, по всей длине которой расположены различные ориентиры, помеченные буквами и цифрами, дающие возможность исследователю идентифицировать отдельные признаки. Карта не одно и то же, что и последовательность оснований генома. Расположение генов на карте можно вычислить без определения последовательности оснований. Приблизительная локализация генов, нарушения в которых связаны с рядом наследственных заболеваний, была установлена задолго до секвенирования генома человека при исследовании наследования различных сцепленных признаков. Методы, которые используются при этом, подробно излагаются в курсе «Генетика». Здесь же мы затронем лишь общие закономерности части из них.
Как проводится построение генетические карты? Предположим, что необходимо выяснить расположение определенного гена, вызывающего заболевание, которое выражается определенными фенотипическими признаками. Сначала обследуют несколько семей, представленных несколькими поколениями, члены которых страдают этим заболеванием, чтобы узнать, с какими другими генетическими признаками связана эта болезнь. Гены любых признаков, имеющих тенденцию наследоваться вместе с предрасположенностью к болезни, с большой долей вероятности могут быть локализованы на одной хромосоме рядом с генами, вызывающими болезнь. Их выбирают в качестве маркеров для искомого гена. Определив несколько маркеров с известным расположением на хромосоме, можно с большой точностью (до нескольких миллионов п.о.) установить расположение гена, вызывающего болезнь. Затем исследования фокусируются на части генома, несущей указанный ген, и поисках гена, который имеет различную последовательность оснований у здоровых и больных людей, или гена, функции которого могут
Современные проблемы и методы биотехнологии. Учеб. пособие |
122 |

ГЛАВА 3. МЕД-Я БИОТЕХНОЛОГИЯ: ОСНОВЫ МОЛЕКУЛ-Й ТЕРАПИИ И ДИАГНОСТИКИ СОЦ. ЗНАЧ. ЗАБОЛЕВАНИЙ
3.1. Геном человека
быть связаны с болезнью. Именно так были идентифицированы гены, связанные с фиброзом мочевого пузыря и болезнью Гантингтона. Однако путь этот долог и трудоемок, поэтому целью генетиков остается разработка более детальных карт геномов, которые позволят с точностью находить последовательности, нужные в каждом конкретном случае.
Существует два типа генетических карт – карты генетического сцепления и физические карты.
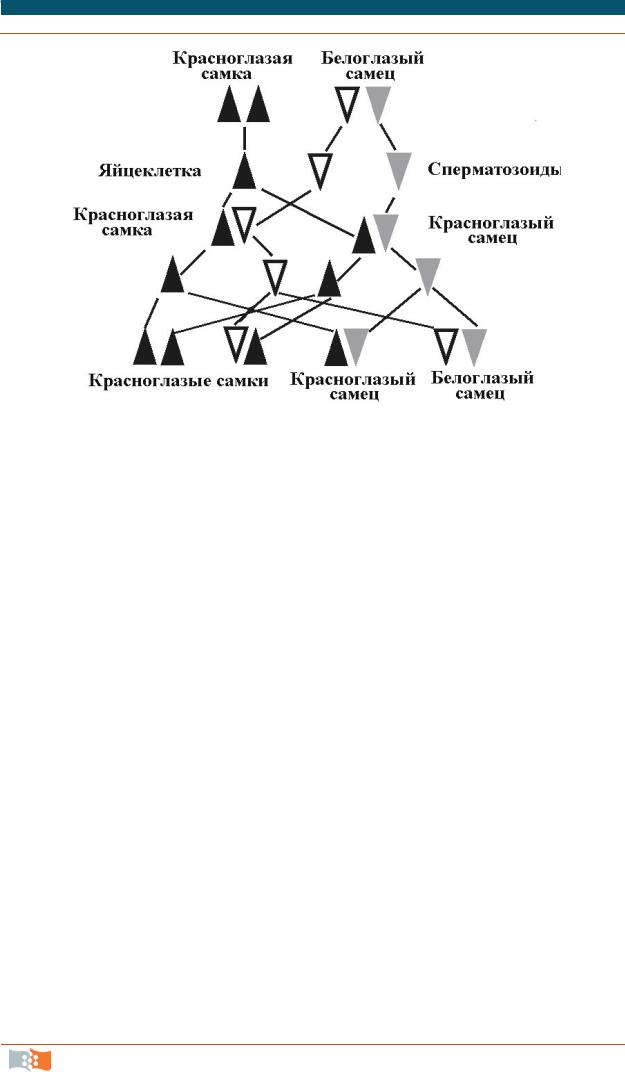
Карты генетического сцепления показывают порядок расположения генов на хромосоме и относительные расстояния между ними. Впервые такую карту составили в начале ХХ в. в лаборатории Колумбийского университета, возглавляемой Томасом Г. Морганом (лауреат Нобелевской премии по физиологии и медицине, 1933 г.). Объектом этих классических генетических исследований были избраны плодовые мушки Drosophila melanogaster, мелкие размеры и неприхотливость которых позволяли проводить эксперименты с сотнями мух. Кроме того, они быстро размножались и оказались чрезвычайно плодовитыми – новое поколение появлялось через каждые 12 сут, и самка откладывала до 1 000 яичек. Плодовые мушки имеют 4 пары хромосом, включая пару половых. Морган заметил, что если самца с белыми глазами скрестить с красноглазой самкой, то у потомства глаза будут красными; но при скрещивании потомства друг с другом «белоглазость» проявляется вновь, но только у самцов. Морган сделал вывод, что этот признак и другие «ограниченные полом» признаки, например, дальтонизм у людей, который поражает только мужчин, должны располагаться на Х-хромосоме. Это была первая мутация, связанная с определенной хромосомой. В течение нескольких последующих лет были идентифицированы более 40 мутаций у плодовых мушек, часть из которых оказались сцепленными друг с другом. Сейчас различают четыре основных вида наследования: аутосомнодоминантный, аутосомно-рецессивный (относится к 22-м парам неполовых хромосом), а также Х-сцепленный доминантный и Х-сцепленный рецессивный.
Схема эксперимента Моргана с белоглазыми мушками приведена на рис. 3.1. Этот эксперимент демонстрирует случай Х-сцепленного рецессивного наследования. Итак, гены сцепленных признаков расположены на одной хромосоме. Для определения сцепления генов группа Моргана скрещивала мутантов с нормальными мушками и полученное потомство снова и снова, пока не получали достаточное количество мушек с сохранением мутации на определенной хромосоме. Поскольку их расположение было известно, такие мутации служили маркерами. Затем самцов с новой мутацией скрещивали с самками, несущими эти маркерные мутации. Как уже было отмечено, белые глаза были результатом мутации на Х-хромосоме. Если новая мутация постоянно проявлялась у белоглазых мух, это означало, что и она расположена на Х-хромосоме.
Современные проблемы и методы биотехнологии. Учеб. пособие |
123 |
ГЛАВА 3. МЕД-Я БИОТЕХНОЛОГИЯ: ОСНОВЫ МОЛЕКУЛ-Й ТЕРАПИИ И ДИАГНОСТИКИ СОЦ. ЗНАЧ. ЗАБОЛЕВАНИЙ
3.1. Геном человека
Рис. 3.1. Результаты скрещивания белоглазых мушек с красноглазым самцом. Черными треугольниками помечены Х-хромосомы, несущие доминирующий признак красных глаз. Белыми перевернутыми треугольниками обозначены Х-хромосомы, несущие рецессивный признак белых глаз. Серые треугольники – Y-хромосомы
Однако встречались признаки, которые передавались вместе, но не всегда, например, признаки белого глаза и рудиментарного крыла. Этот эффект объясняется происходящим во время мейоза кроссинговером (обменом между генными участками хромосом). Если интересующие нас гены находятся на одной и той же хромосоме, но располагаются далеко друг от друга, в результате кроссинговера при образовании половых клеток они с большой вероятностью попадут в разные клетки. Близко расположенные гены не будут разделяться при кроссинговере. Таким образом, можно установить не только нахождение гена на определенной хромосоме, но и приблизительно определить взаимное расположение генов на ней, если учесть, как часто они проявляются в потомстве в результате скрещиваний. Пользуясь полученными результатами, сотрудники лаборатории Моргана построили первую карту Х-хромосомы плодовой мушки (рис. 3.2). Позднее были построены первые генетические карты и других 3 хромосом. По сути, они являются прототипом современных генетических карт.
Карты Моргана были построены на генетических признаках, физически видимых у исследуемых мушек. Сегодня гораздо более сложные карты сцепления генов строятся на определении наследования специфических последовательностей ДНК. В частности, для этого используется метод, основанный на полиморфизме длины рестрикционных фрагментов (ПДРФ).
Современные проблемы и методы биотехнологии. Учеб. пособие |
124 |

ГЛАВА 3. МЕД-Я БИОТЕХНОЛОГИЯ: ОСНОВЫ МОЛЕКУЛ-Й ТЕРАПИИ И ДИАГНОСТИКИ СОЦ. ЗНАЧ. ЗАБОЛЕВАНИЙ
3.1. Геном человека
Рис. 3.2. Примерный вид первой генетической карты, показывающей расположение пяти признаков на хромосоме плодовой мушки
Для возникновения аллелей достаточно, чтобы два гомологичных гена отличались всего одним нуклеотидом. Если вероятность появления такой замены (мутации) больше 1 %, то говорят, что имеет место генетический полиморфизм. Замена всего одного нуклеотида может вызвать значительное изменение свойств кодируемого белка, по сравнению с нормальным. Однако множество однонуклеотидных замен не приводит к синтезу измененных генных продуктов. Более того, замены, происходящие в некодирующих областях (а в человеческом геноме они составляют около 90 %), не приводящие ни к каким изменениям, распределены по всей длине хромосомы и представляют собой полиморфные сайты, которые используются в качестве маркеров для генетического маркирования. Но сначала эти полиморфные сайты нужно обнаружить. Метод состоит в следующем. ДНК расщепляют с помощью определенной рестриктазы по специфическим местам. Если в сайте рестрикции находится однонуклеотидная замена, рестриктаза его не узнает и расщепления не происходит. В то же время она по-прежнему узнает и расщепляет интактный сайт в другой хромосоме. Таким образом, в результате обработки рестриктазой двух этих аллелей получается набор разных продуктов (фрагментов ДНК разной длины), которые затем опознаются с помощью гибридизации со специфичным зондом (см. пример на рис. 3.8).
Явление встречающегося в популяции измененного сайта рестрикции, приводящее к образованию специфического набора фрагментов ДНК, назы-
вается полиморфизмом длины рестрикционных фрагментов. Полиморфные сайты рестрикции образуют маркерные локусы на той хромосоме, где они присутствуют. В настоящее время идентифицированы тысячи ПДРФ-локусов, благодаря чему значительно увеличилось число аллелей, которые можно использовать для генетических исследований. Определение аллелей ПДРФлокуса, присутствующих на хромосомах данного индивидуума, называется генотипированием (ДНК-типированием). Наследование ПДРФ-локусов происходит в соответствии с законами Менделя и можно проследить их передачу в пределах родословной. Используя сцепление гена того или иного заболевания с маркерным локусом, можно определить хромосомную локализацию этого гена. С их помощью были изолированы гены таких наследственных заболеваний, как миодистрофия Дюшена и муковисцидоз.
Современные проблемы и методы биотехнологии. Учеб. пособие |
125 |
ГЛАВА 3. МЕД-Я БИОТЕХНОЛОГИЯ: ОСНОВЫ МОЛЕКУЛ-Й ТЕРАПИИ И ДИАГНОСТИКИ СОЦ. ЗНАЧ. ЗАБОЛЕВАНИЙ
3.1. Геном человека
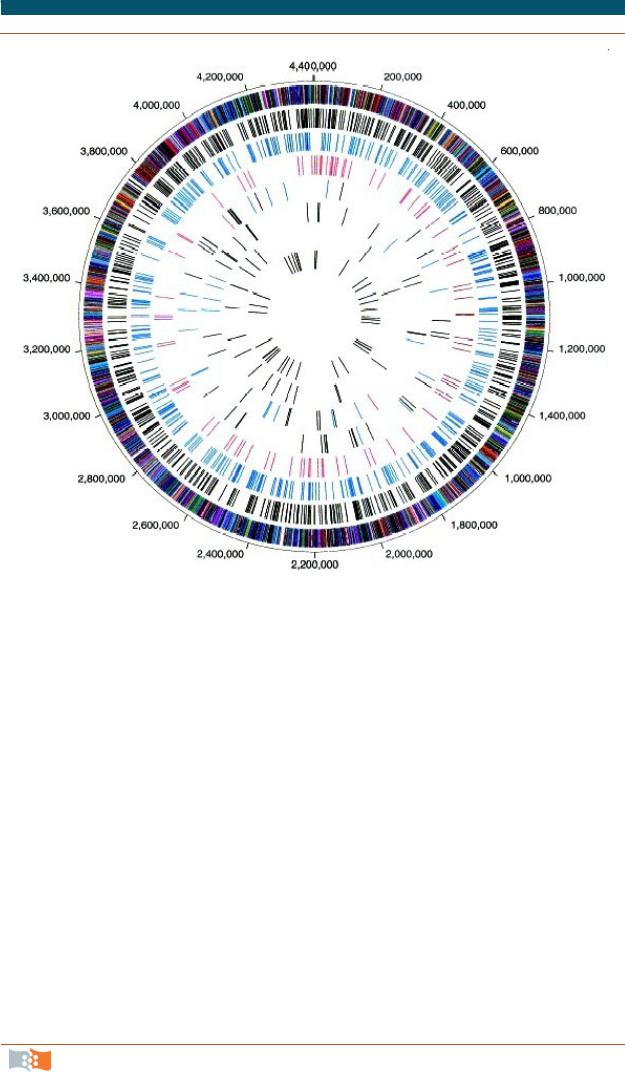
Рис. 3.3. Карта генома хромосомы Micobacterium tuberculosis. На внешней окружности показано расположение генов, кодирующих соответствующие белки, общие для штаммов CDC1551 (клинический) и H37Rv (лабораторный). Каждая из внутренних окружностей отражает различия между этими штаммами. Например, вторая окружность показывает локализацию синонимных замен, пятая – обнаруженные в штамме CDC1551 вставки и т.д. [1] (с разрешения American Society for Microbiology)
Другим типом полиморфных локусов являются так называемые корот-
кие тандемные повторы (STR, от англ. short tandem repeats). Дело в том, что по геному человека равномерно распределены примерно 100 000 блоков динуклеотидных повторов, содержащих до 40 CA/GT-элементов. Любой такой блок, локализованный в определенном участке хромосомы, передается из поколения в поколение с сохранением числа повторяющихся элементов. В геноме встречаются также повторы (AT)n, (ATG)n, (ATCG)n. Чтобы идентифицировать полиморфные STR-локусы, проводят скрининг геномной библиотеки человека, содержащий вставки небольшого размера (около 1 000 п.о.), используя подходящий олигонуклеотидый зонд. Для (CA)n-повторов обычно используют зонд (CA)15. Каждую позитивную вставку секвенируют, чтобы установить длину повтора и нуклеотидные последовательности фланкирую-
Современные проблемы и методы биотехнологии. Учеб. пособие |
126 |

ГЛАВА 3. МЕД-Я БИОТЕХНОЛОГИЯ: ОСНОВЫ МОЛЕКУЛ-Й ТЕРАПИИ И ДИАГНОСТИКИ СОЦ. ЗНАЧ. ЗАБОЛЕВАНИЙ
3.1. Геном человека
щих его участков. Чтобы определить, являются ли фланкирующие последовательности однокопийными, проводят гибридизацию с комплементарными им зондами, и если обнаруживается, что эти последовательности встречаются в геноме один раз, то синтезируют пару комплементарных им праймеров и осуществляют амлификацию СА-повторов. Далее, используя эту пару праймеров, проводят ПЦР-тестирование ДНК, полученных от большого числа индивидуумов. Длина ПЦР-продуктов (применяют примерно 200 п.о.) определяется с помощью полиакриламидного гель-электрофореза. Если длина амплифицированного таким образом сегмента одинакова для всех исследуемых образцов ДНК, значит повтор не полиморфен и наоборот, если образуются ПЦР-продукты разной длины, это указывает на полиморфизм по данному
STR (STR-полиморфизм, STRP).
Различающиеся по длине повторы данного локуса представляют собой аллели, которые встречаются с частотой 20 % и более. Использование STRPлокусов для картирования геномов, по сравнению с ПДРФ-локусами, имеет ряд преимуществ:
1)для их идентификации нужна информация о нуклеотидной последовательности только пары праймеров, которая может храниться в компьютерной базе данных;
2)эти локусы равномерно распределены в геноме;
3)их частоты очень высоки, что обеспечивает высокую гетерозиготность;
4)они без труда идентифицируются после ПЦР-амплификации. Физическая карта целой хромосомы или ее области дает непосредст-
венное представление о расположении генов в ДНК, что облегчает их идентификацию и характеристику. Существующие в настоящее время, после завершения секвенирования генома человека, геномные карты совмещают черты обоих типов карт. Созданы электронные сайты, где специалисты могут получить информацию о содержании различных хромосомных карт, включая их полное графическое изображение, о методах исследования генома и программном обеспечении. На рис. 3.3. показана карта хромосомы Micobacterium tuberculosis. Сравнение последовательностей клинического штамма CDC1551 и лабораторного H37Rv позволило выявить мутации (замены и вставки), ответственные за патогенность клинического образца, что в свою очередь позволяет улучшить метод диагностирования, понять механизм возникновения заболевания и предложить соответствующую эффективную терапию [1].
3.1.3. Практическоезначениерезультатов секвенированиягеномачеловека
С результатами секвенирования генома человека связаны надежды на возможность лечения генетических заболеваний. К настоящему времени в мире идентифицировано множество генов, ответственных за болезни человека, в том числе болезнь Альцгеймера, болезнь Гоше, атаксию, муковисцидоз,
Современные проблемы и методы биотехнологии. Учеб. пособие |
127 |

ГЛАВА 3. МЕД-Я БИОТЕХНОЛОГИЯ: ОСНОВЫ МОЛЕКУЛ-Й ТЕРАПИИ И ДИАГНОСТИКИ СОЦ. ЗНАЧ. ЗАБОЛЕВАНИЙ
3.1. Геном человека
мышечную дистрофию Дюшенна, дистонию, гемофилию А и В, фенилкетонурию, серповидно-клеточную анемию, талассемию, синдром хрупкости Х-хромосомы, наследуемый рак молочных желез и яичников и др. Структуры этих генов расшифрованы, и сами они клонированы. Это позволяет проводить эффективную раннюю и даже пренатальную диагностику и лечение.
Тестирование будущих родителей на высокий риск генетического заболевания теперь может осуществляться для постоянно растущего числа генов. При этом типичным подходом является использование исследований при помощи гибридизации или ПЦР-анализа. Можно протестировать здорового человека из семьи, где встречался, например, кистозный фиброз, и определить, есть ли у него копия дефектного гена или нет. Если неблагополучного сочетания генов избежать не удалось и оба потенциальных родителя являются носителями рецессивного дефекта, они должны сами решать, рисковать ли им, чтобы иметь детей. В любом случае раннее начало профилактического лечения ребенка позволит предотвратить начало заболевания или отодвинуть начало его проявления.
В настоящее время в практику медико-генетического консультирования введены десятки систем для генодиагностики наиболее распространенных наследственных заболеваний. Установленная последовательность генома поможет идентифицировать новые гены и выявить среди них те, что обусловливают предрасположенность к тем или иным заболеваниям.
Как было отмечено ранее, в ходе выполнения проекта «Геном человека» были установлены последовательности целого ряда организмов – бактерий, среди которых немало патогенных, дрожжей, круглого червя Caenorhabolits elegans (нематоды), дрозофилы, мухи, москита, мыши, крысы, собаки, шимпанзе, рыбы-собаки и растений – арабидопсиса, тополя и двух видов риса. Полученная информация (большую часть которой еще предстоит осмыслить) открыла новые возможности для развития сравнительной геномики. Оказалось, к примеру, что из 269 генов человека, мутации которых приводят к болезням, 177 генов имели родственные гены в геноме дрозофилы. Сравнение мышиного генома с человеческим показало, что около 200 геномных блоков у человека и мыши содержат одинаковые гены (хотя и в разных хромосомах). Количество генов у нематоды только в 4-5 раз меньше, чем у человека, и часть из них также являются общими. Это позволяет изучать функции новых генов человека и последствия мутаций известных генов, прослеживая изменение свойств организма в опытах с экспериментальными животными и экстраполируя полученные результаты на человека.
В процессе прочтения генома был выявлен еще один механизм генетического разнообразия, так называемый однонуклеотидный полиморфизм (фактор СНП, по английской транскрипции). СНП – это изменение «буквы» генетического кода без «последствий для здоровья». Считается, что у человека СНП встречается с частотой 0,1 %, т.е. каждый человек отличается от других одним нуклеотидом на каждую тысячу нуклеотидов. У шимпанзе, представляющей собой более древний вид и к тому же гораздо более гетерогенный, число СНП при сравнении двух разных особей достигает 0,4 %. Но если
Современные проблемы и методы биотехнологии. Учеб. пособие |
128 |
ГЛАВА 3. МЕД-Я БИОТЕХНОЛОГИЯ: ОСНОВЫ МОЛЕКУЛ-Й ТЕРАПИИ И ДИАГНОСТИКИ СОЦ. ЗНАЧ. ЗАБОЛЕВАНИЙ
3.1. Геном человека
различия в СНП не сказываются на здоровье особей, то чем они интересны и важны? Оказалось, что практическое значение СНП велико. Известно, что самые распространенные лекарства эффективны не более чем для четверти нуждающегося населения. Минимальные генетические отличия, обусловленные СНП, определяют эффективность лекарств и их переносимость в каждом конкретном случае.
Например, в одном из генов, кодирующих синтез рецептора адреналина, выявлено 13 СНП, которые могут комбинироватьcя друг с другом, давая 8 192 различных варианта (гаплотипа). Среди астматиков довольно популярно лекарство албутерол, которое взаимодействует с указанным рецептором адреналина и подавляет приступ удушья. Однако из-за разнообразия гаплотипов людей лекарство действует не на всех, а некоторым больным оно вообще противопоказано. Это обусловлено СНП: люди с последовательностью букв в одном из генов ТЦТЦЦ (Т – тимин, Ц – цитозин) не реагируют на албутерол, если же концевой цитозин заменен на гуанин (ТЦТЦГ), то реакция есть, но частичная. Для людей же с тимином вместо концевого цитозина в этом участке – ТЦТЦТ – лекарство токсично!
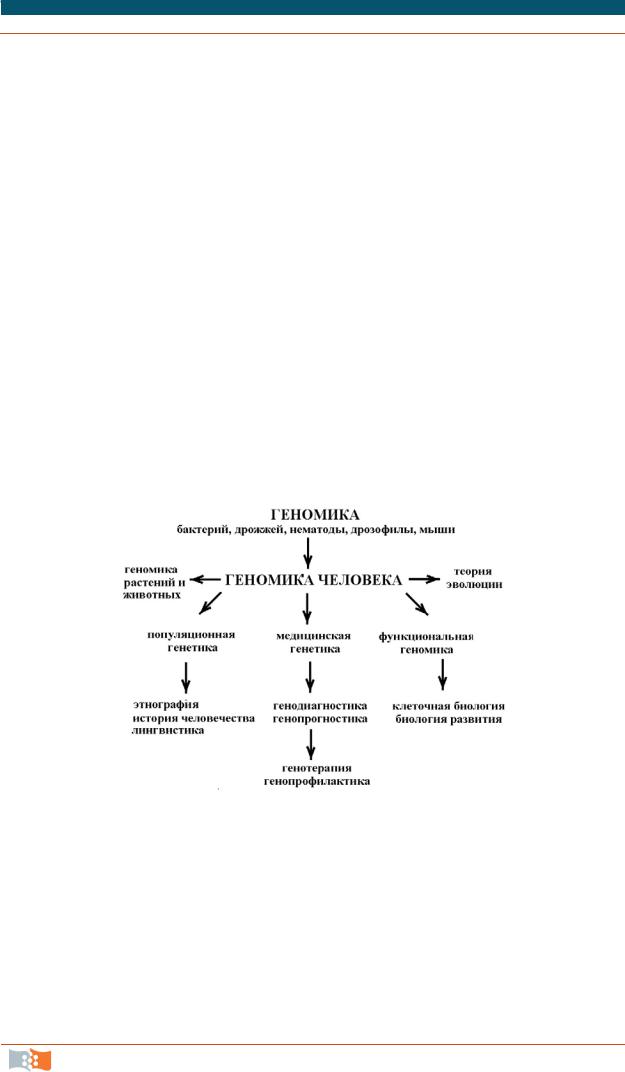
Необходимо отметить, что развитие и достижения геномики человека, в свою очередь, обеспечили новые возможности для развития целого ряда других научных направлений (рис. 3.4).
Рис. 3.4. Связь геномики человека с другими научными направлениями
Определение нуклеотидной последовательности человека является событием исторического масштаба, но между тем необходимо знать не только порядок следования звеньев в цепи ДНК и не только взаимное расположение генов и их функции. Важно выяснить характер связей между ними, который определяет, как гены будут работать в конкретных условиях – внешних и внутренних: ведь многие болезни человека обусловлены не дефектами в самих генах, а нарушениями их согласованных действий, системы их регуляции.
Современные проблемы и методы биотехнологии. Учеб. пособие |
129 |

ГЛАВА 3. МЕД-Я БИОТЕХНОЛОГИЯ: ОСНОВЫ МОЛЕКУЛ-Й ТЕРАПИИ И ДИАГНОСТИКИ СОЦ. ЗНАЧ. ЗАБОЛЕВАНИЙ
3.2. Методымолекулярнойдиагностики
Успехи современной медицины в огромной мере зависят от того, удастся ли вовремя обнаружить специфические инфекционные агенты (вирусы, бактерии, паразитические микроорганизмы) или изменения в содержании важных биологически активных белков или низкомолекулярных соединений в организме. Надо ли говорить, что профилактику и лечение любого заболевания существенно облегчает ранняя и точная диагностика. Современные методы молекулярной диагностики обладают высокой специфичностью и чувствительностью и при этом являются достаточно продуктивными, эффективными и недорогими для рутинного применения.
По оценкам специалистов, объем мирового рынка иммунодиагностических тестов в 1993 г. составил 3,4 млрд дол., в 2000 г. – около 5 млрд дол. В 1994 г. объем мирового рынка ДНК-диагностических тестов был примерно 80 млн дол., к 2000 г. – 600 млн дол., к 2004 г. – 2 млрд дол.
Любой диагностический тест должен быть высокоспецифичным в отношении молекулы-мишени, чувствительным для определения малых количеств мишени и достаточно простым и надежным, позволяющим получать однозначные результаты в условиях обычной медицинской лаборатории.
Различают два основных метода молекулярной диагностики – иммунодиагностика, основанная на сродстве антитела к антигену, и ДНК-диагностика, основанная на гибридизации нуклеиновых кислот (спаривании комплементарных фрагментов ДНК) и ПЦР.
3.2.1.Методыиммунодиагностики– основныезакономерности
иразнообразие
Воснове любого иммунодиагностического исследования лежит высоко специфичное и эффективное взаимодействие антиген – антитело (рис. 3.5). Таким образом, связывание антитела с антигеном-мишенью (появление в образце комплексов АТ~АГ) свидетельствует о наличии анализируемого антигена (инфекционного агента или целевого биологически активного соединения).
Задача состоит в том, чтобы о своем наличии такие комплексы «сообщали» каким-либо визуальным сигналом, т.е. необходимо каким-то образом «пометить» антитело. Долгое время в качестве меток в иммуноанализе использовали радиоактивные изотопы. Они обеспечивали высокую чувствительность анализа, однако обладали рядом недостатков: нестабильностью (использовали высокоактивные короткоживущие изотопы), невозможностью автоматизации анализа, опасностью для персонала лабораторий и производства. Альтернативой радиоиммуноанализу стал так называемый иммунофер-
Современные проблемы и методы биотехнологии. Учеб. пособие |
130 |
