
Современные проблемы и методы биотехнологии
.pdf
ГЛАВА 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ
4.5. Культура каллусных тканей
Компетентность ее в рассмотренных примерах определяется степенью дифференцировки клеток.
Переход клетки in vitro из дифференцированного состояние к дедифференцировке и активным клеточным делениям обусловлен изменением активности генов (эпигенной изменчивостью). Активирование одних генов и репрессирование других приводит к изменению в белковом составе клеток. В каллусных клетках появляются специфические белки и одновременно исчезают или уменьшаются в количестве белки, характерные для фотосинтезирующих клеток листа. У двудольных растений процесс репрессии и депрессии генов, лежащий в основе дифференцировки, происходит легче, чем у однодольных.
Для того чтобы не произошло старения, утраты способности к делению и отмиранию каллусных клеток, первичный каллус через 4–6 недель переносят на свежую питательную среду (пассирование). При регулярном пассировании способность к делению может поддерживаться в течение десятков лет. Культура каллусной ткани моркови, полученная Готре более 50 лет назад, до сих пор растет в коллекции.
4.5.1. Особенностикаллусныхклеток
Каллусные клетки имеют как сходства с нормальными клетками, так и отличия от них [6].
Сохранение свойств оригинальных нормальных клеток:
–синтез вторичных метаболитов;
–морозо- и жаростойкость, устойчивость к низким и высоким темпера-
турам;
–фотопериодическая реакция (сохраняется активность фитохрома);
–устойчивость к осмотически активным веществам, к засолению и т.п.
Отличия от нормальных клеток:
–изменение состава белков. В каллусных клетках появляются специфические белки и одновременно исчезают или уменьшаются в количестве белки, характерные для фотосинтезирующих клеток листа;
–физиологическая асинхронность, гетерогенность по возрасту. Присутствуют молодые клетки в G1-фазе, старые – в G2 и в S-фазах цикла клеточных делений;
–более длительный клеточный цикл, чем у растений, произрастающих
воткрытом грунте;
–неограниченный, анархический рост;
–слаборазвитые митохондрии, как и в меристематических клетках (в них мало крист, что влияет на активность аэробного дыхания);
–особенности энергетического обмена. Потребляют меньше кислорода по сравнению с нормальными (ДК более 1), т.е. в них снижен эффект Пастера (понижение процесса брожения под действием кислорода). Это роднит кал-
Современные проблемы и методы биотехнологии. Учеб. пособие |
191 |

ГЛАВА 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ
4.5. Культура каллусных тканей
лусные клетки с другими быстро делящимися клетками меристематическими
ираковыми;
–повышенное потребление углеводов (в 19 раз) из-за аэробного гликолиза (бескислородное расщепление углеводов в присутствии кислорода);
–сдвиг в обмене углеводов в направлении пентозофосфатного пути, который является источником пентоз, необходимых для делящихся клеток.
Перечисленные особенности каллусных клеток позволяют очень эффективно использовать их в получении вторичных метаболитов и селекции растений.
4.5.2. Генетикакаллусныхклеток
Однотипно образующиеся каллусные клетки в процессе культивирования формируют каллусную ткань, которую характеризует гетерогенность по клеточному составу, что выяснено с 60-х гг. прошлого века. Каллусная ткань может содержать клетки следующих типов: паренхимные, меристематические, некротические, а также отдельные клетки или зоны проводящей системы.
Культура каллусных тканей обладает не только гетерогенностью по степени дифференцированности клеток, но и гетерогенностью по цитогенетическим характеристикам, которая может быть обусловлена двумя причинами:
1.Клетки исходного экспланта имеют разную плоидность. В условиях in vitro эти клетки индуцируются к делению и становятся источником отдельных клеточных линий.
2.Клетки исходного экспланта имеют одинаковую плоидность, характерную для меристематических клеток растения, но в условиях культивирования плоидность отдельных клеток может измениться.
Установлено, что примерно у 90 % из числа изученных покрытосеменных растений в процессе дифференцировки клеток происходит их полиплоидизация. Такие растения относят к полисоматическим или миксоплоидным, т.е. к растениям, которые одновременно содержат диплоидные и полиплоидные клетки. Это, например, бобовые, пасленовые и т.д. Виды растений, клетки которых при дифференцировке сохраняют исходный уровень плоидности, относят к неполисоматическим, например, Crepis capillaris, Ipomoea batatas
(батат), Ipomea purpurea, a также ряд видов Lilium (лилии).
Выделены и промежуточные виды, такие как подсолнечник и топинамбур, у которых содержание полиплоидных клеток обнаруживают только в некоторых тканях и не у всех растений.
Следовательно, у большинства растений только в апикальных меристемах, т.е. в кончиках корешков и верхушках побегов, клетки характеризуются нормальным клеточным циклом: за синтезом ДНК происходит деление ядра, а затем и всей клетки с образованием двух дочерних клеток.
Таким образом, в апикальных меристемах плоидность поддерживается на одном уровне и характеризует цитотип данного растения.
Современные проблемы и методы биотехнологии. Учеб. пособие |
192 |

ГЛАВА 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ
4.5. Культура каллусных тканей
Клетки с различным уровнем плоидности образуются в результате эндомитоза и эндоредупликации. Оба эти процесса являются такими формами митоза, при которых не происходит деление ядра и клетки, но содержание ДНК в ядре увеличивается в геометрической прогрессии.
Вусловиях культивирования in vitro эндомитоз и эндоредупликация могут иметь место и у неполисоматических видов растений. Например, после года культивирования часть диплоидных клеток каллусной ткани Crepis capillaries (крепис) становится полиплоидной.
Вусловиях культивирования в большей степени, чем у интактных растений, наряду с полиплоидизацией происходит образование анеуплоидных клеток и клеток со структурными изменениями хромосом.
Индукторами онтогенетической изменчивости клеток в культуре могут быть различные компоненты питательной среды. Наиболее хорошо изучена роль фитогормонов. При этом необходимо подчеркнуть, что действие одного
итого же фитогормона в разных культуральных системах может приводить к неодинаковой реакции клеток. Так, в экспериментах по культивированию сегментов корня гороха на среде, содержащей синтетический ауксин-2,4-Д, наблюдалось деление диплоидных клеток. При добавлении в питательную среду кинетина начинали делиться тетраплоидные клетки.
Вдругих экспериментах показана роль 2,4-Д как фактора полиплоидизации. Так, в суспензионной культуре гаплопаппуса при наличии в питательной среде 2,4-Д в течение шести месяцев культивирования происходило превращение диплоидной культуры в тетраплоидную.
Как правило, увеличение продолжительности культивирования, независимо от состава питательной среды и происхождения культуры, ведет к повышению цитогенетической нестабильности.
4.5.3. Морфогенезвкаллусныхтканях
Существует несколько путей, по которым может пойти каллусная клетка после ее дедифференцировки:
1)вторичная регенерация целого растения, возможна дифференцировка на уровне клеток, тканей, органов;
2)утрата способности к вторичной дифференцировке и регенерации растений, стойкая дедифференцировка, приобретение способности расти без гормонов – опухолевая (это явление чаще наблюдается у старых культур);
3)нормальный онтогенез каллусной клетки, заканчивающийся ее старением и умиранием. Клетка претерпевает вторичную дифференцировку и прекращает делиться (стационарная фаза). Интереснее регенерация.
В культуре каллусных тканей морфогенезом называют возникновение
организованных структур из неорганизованной массы клеток. Существуют различные типы морфогенеза: органогенез – корневой, стеблевой, флоральный, листовой; соматический эмбриогенез (образование зародышеподобных структур из соматических клеток). В случае органогенеза сначала регенери-
Современные проблемы и методы биотехнологии. Учеб. пособие |
193 |

ГЛАВА 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ
4.5. Культура каллусных тканей
руют отдельные органы, а затем уже из них – целые растения, исключение – корневой органогенез (рис. 4.11). В отличие от органогенеза при соматическом эмбриогенезе сразу образуется биполярная структура (соматический зародыш), имеющая зачаточный корешок и стеблевую почку, из которой развивается растение.
а |
б |
в |
г |
Рис. 4.11. Морфогенез в каллусных тканях, сформированных в культуре незрелых зародышей ячменя (а–в) и пшеницы (г): а – ризогенез; б, г – стеблегенез; в– стебле- и ризогенез (формирование регенеранта) (фото Н.В. Зобовой)
Тотипотентность – это способность любой клетки воспроизвести целое растение. Любая растительная клетка содержит весь набор генов и сохраняет свойственную зиготе программу развития любого органа: лист, лепесток, сердцевинная паренхима и т.п. Однако возможности разных типов клеток различны, свойство тотипотентности не всегда реализуется. В некоторых клетках гены в сильной степени репрессированы.
В организме тотипотентность не проявляется, так как организм подавляет потенциал развития отдельной клетки, изоляция способствует проявлению этих потенций.
Клеточную основу морфогенеза составляет цитодифференцировка. Регенерация растений начинается с вторичной дедифференцировки. При этом дедифференцированные клетки вновь приобретают структуру и функции специализированных. Большая роль в этом процессе принадлежит фитогормонам. Они вызывают изменение метаболизма клеток.
Вторичная дифференцировка каллусных клеток не всегда заканчивается морфогенезоим и регенерацией растений. Иногда это гистодифференцировка. Таким путем клетка каллуса может превращаться во флоэмные и ксилемные элементы, из активной клетки в старую.
Для управления морфогенезом используются внешние и внутренние факторы: внутренние – вид растения, генотип, орган, из которого взят эксплант; внешние – состав питательной среды, температура, свет (интенсивность, спектр, длина фотопериода).
Современные проблемы и методы биотехнологии. Учеб. пособие |
194 |

ГЛАВА 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ
4.5. Культура каллусных тканей
Сигналом (импульсом) морфогенеза является изменение соотношения цитокининов и ауксинов, т.е. они не только регуляторы роста, но и дифференцировки [7, 11].
Эмбриогенез фактически не зависит от гормонов. Обычно эмбриогенные зоны возникают в каллусной ткани на той же питательной среде, на которой шло каллусообразование. Развитие соматических зародышей в каллусной ткани начинается тогда, когда устраняется дедифференцирующий фактор из питательной среды. Развивающийся зародыш не нуждается в экзогенных гормонах.
Дополнительные стимулы морфогенеза – азотнокислое серебро, нитрат аммония, некоторые аминокислоты (пролин, тирозин, иногда серин), полиамины (путресцин и спермидин). В ряде случаев стимулируют морфогенез маннит и сорбит. Ионы окиси азота влияют на развитие возникающих в каллусной ткани организованных структур, а их индукцию стимулируют ионы аммония -NH4. Гибберелловая кислота способствует росту зачатков стебля, а абсцизовая – ускоряет дифференциацию органов соматических зародышей.
Азотнокислое серебро продлевает регенерационную способность в старых пересадочных культурах. Лишь одна из 400–1 000 клеток регенерирует. Одного стимула недостаточно, необходима еще готовность к нему. Способность воспринимать стимулы морфогенеза определяется как компетентность клетки.
Морфогенез начинается с того, что под влиянием условий среды детерминированная клетка обособляется от каллусных клеток, образуя утолщенную стенку [4].
Клетка-инициаль при соматическом эмбриогенезе дает начало зиготе, а при органогенезе – меристематическому очагу. От недетерминированных каллусных клеток инициальная отличается более крупным ядром и меньшими размерами вакуоли. Ядро обычно занимает центральное положение. В инициальных клетках содержатся большие количества крахмала, иногда липидов.
Некоторое время инициальная клетка находится в лаг-фазе, что необходимо для переустройства и подготовки к последующим быстрым делениям. Затем эти клетки делятся по типу дробления, образуя сферическую массу мелких изодиаметрических клеток. При органогенезе эту массу называют меристематическим очагом, а при соматическом органогенезе – глобулярным проэмбрио. В дальнейшем в меристематическом очаге дифференцируются зачатки стебля, корня, листа или цветочной почки и, соответственно, происходит стеблевой, корневой, листовой и флоральный органогенез. В глобулярном проэмбрио развивается биполярная структура. Можно выделить несколько последовательных стадий формирования эмбриоидов из каллусной ткани – глобулярную, сердечка, торпедовидную, соматического зародыша. Меристематические очаги или проэмбрио могут возникать на периферии каллусной ткани или быть погруженными в нее. Обычно не наблюдается определенной закономерности в их локализации, исключение составляет стеблевой органогенез в каллусной ткани, полученной из сердцевидной паренхи-
Современные проблемы и методы биотехнологии. Учеб. пособие |
195 |

ГЛАВА 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ
4.5. Культура каллусных тканей
мы табака. Меристематические очаги здесь локализуются только в нижней части каллусной ткани.
Некомпетентные клетки делятся, но скорее (чаще) всего становятся гормононезависимыми. Многие в силу генетических особенностей используют гормоны, но не регенерируют, занимая промежуточное положение между «привыкшими» и свежими каллусами.
4.6. Органогенезвкультуресоматическихтканей
Манипуляции в культуре изолированных тканей растений (с использованием или без культуры каллусных клеток) чаще всего осуществляют в соматических тканях.
Реализация тотипотентности соматических клеток лежит в основе вегетативного размножения растений. Отрезки стеблей, корней и листья растений разных таксономических групп способны к регенерации новых побегов и корней.
При культивировании in vitro эти возможности могут быть значительно увеличены, а у растений, не проявляющих регенерационной способности в природных условиях, индуцированы.
4.6.1. Прямойинепрямойпутиорганогенеза
Если при культивировании развитие корней, стеблевых или цветочных почек происходит из клеток экспланта без образования каллуса, то такой путь органогенеза называют прямым. Путь формирования морфологических структур, приводящих к образованию корней, стеблевых и цветочных почек в каллусной культуре, называют непрямым органогенезом [11].
Пример прямого органогенеза in vivo и in vitro – образование стеблевых почек у льна. Так, если у 15-дневных проростков льна удалить верхушку стебля, то через определенный промежуток времени из эпидермальных клеток гипокотиля происходит образование многочисленных стеблевых почек. Позже одна из почек доминирует в развитии и дает полноценный стебель. Если сегмент гипокотиля льна размером примерно 15 мм поместить на агаризованную культуральную среду с фитогормонами, то развитие может получить до 170 проростков, формирующихся как из эпидермальных, так и из субэпидермальных клеток.
Возможные пути преобразования, включая органогенез, при культивировании изолированной ткани представлены на рис. 4.12.
Современные проблемы и методы биотехнологии. Учеб. пособие |
196 |
ГЛАВА 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ
4.6. Органогенез в культуре соматических тканей
|
|
|
|
|
|
|
ЭКСПЛАНТ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
КАЛЛУС |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Цветочные |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
«Привыкшая» |
|
||||||
|
Корни |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Корни |
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
Стеблевые |
|
|
|
|
|
|
|
|
|
почки |
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ткань |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
почки |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Эмбриоиды |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Эмбриоиды |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
РАСТЕНИЯ |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 4.12. Возможные пути преобразования при культивировании изолированных тканей
Предрасположенность клеток культивируемой ткани к определенному пути органогенеза в условиях in vitro может зависеть от многих факторов:
–таксономической принадлежности и генотипа исходного растения;
–онтогенетического возраста растения;
–локализации ткани, использованной в качестве экспланта;
–действия физических факторов при культивировании;
–длительности культивирования;
–состава питательной среды.
Рассмотрим примеры, подтверждающие эти положения.
Зависимость от таксономической принадлежности наиболее хорошо прослеживается при сравнении особенностей культивирования изолированных органов и тканей у двудольных и однодольных растений.
У двудольных растений каллусную ткань, способную к органогенезу, можно индуцировать не только из меристематических клеток, но и из вполне дифференцированных тканей листьев, стебля, корня. У однодольных растений для получения каллусной ткани в качестве эксплантов используют только ткани, содержащие меристематические клетки. Например, у злаков каллус можно получить из зародышей, гипокотиля, корневых и стеблевых апексов, сегментов молодых листьев, молодых соцветий. Возможности получения растений-регенерантов у злаков еще более ограничены. Регенерация растений происходит в основном из каллуса, индуцированного из молодых зародышей и молодых соцветий.
Роль генотипа в проявлении морфогенной способности в культуре тканей хорошо изучена на примере разных сортов, изогенных и мутантных линий табака, моркови, цветной капусты, пшеницы, риса и других растений. Выявлены соответствующие доноры с высоким морфогенным потенциалом в культуре in vitro.
Зависимость особенностей органогенеза от онтогенетического состояния растения выявлена, в частности, при изучении культивирования листовых эксплантов эчеверии (семейство Толстянковых) и табака.
Современные проблемы и методы биотехнологии. Учеб. пособие |
197 |

ГЛАВА 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ
4.6. Органогенез в культуре соматических тканей
Такие различия в характере органогенеза при культивировании на средах одинакового состава определяются содержанием эндогенных фитогормонов в тканях исходного экспланта. Уровень эндогенных фитогормонов определяет и зависимость между типом органогенеза и локализацией ткани, использованной в качестве исходного экспланта. Особенности органогенеза изучены в зависимости от таких физических факторов, как температура, содержание кислорода в культуральной системе, продолжительность и качество освещения. Результаты многих экспериментов однозначно продемонстрировали, что с увеличением продолжительности культивирования тканей утрачивается их способность к регенерации стеблевых и цветочных почек. Гораздо дольше сохраняется способность к ризогенезу – образованию корней.
Что касается факторов питательной среды, определяющих особенности регенерации в культуре ткани, то в наибольшей степени на индукцию стеблевых почек и корней влияет фитогормональный баланс.
При наличии в среде разного соотношения этих гормонов наблюдаются следующие особенности:
1.Определенное превышение концентрации кинетина над ауксином в неорганизованно растущей каллусной культуре приводит к образованию стеблевых почек и побегов.
2.Увеличение концентрации ауксина способствует развитию корней.
3.Среднее, близкое к равному, соотношение концентраций этих фитогормонов поддерживает неорганизованный рост каллусной ткани.
Процессы органогенеза на клеточном уровне могут носить продолжительный характер и быть асинхронными. В каллусной культуре образование меристематических зон происходит в основном в базальной ее части, контактирующей с питательной средой. Клетки меристематических зон характеризуются интенсивным синтезом РНК и белка и становятся источником формирующихся зачатков органов. Этот процесс контролируется экзогенными фитогормонами, содержащимися в питательной среде, и эндогенными, синтезируемыми самими клетками.
Возможность индуцирования процессов органогенеза и регенерации растений из стеблевых почек в культуре in vitro используется для массового размножения растений.
4.6.2. Соматическийэмбриогенез
При культивировании in vitro и из клеток экспланта, и из клеток каллуса могут развиться соматические зародыши, или эмбриоиды, которые, как и стеблевые почки, при прорастании дают целые растения. В зависимости от пути образования эмбриоидов (из экспланта или каллуса) по аналогии с орга-
ногенезом различаютпрямой инепрямой путь соматического эмбриогенеза.
Морфологические различия между стеблевыми почками и эмбриоидами заключаются в следующем. Эмбриоиды развиваются из соматических
Современные проблемы и методы биотехнологии. Учеб. пособие |
198 |
ГЛАВА 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ
4.6. Органогенез в культуре соматических тканей
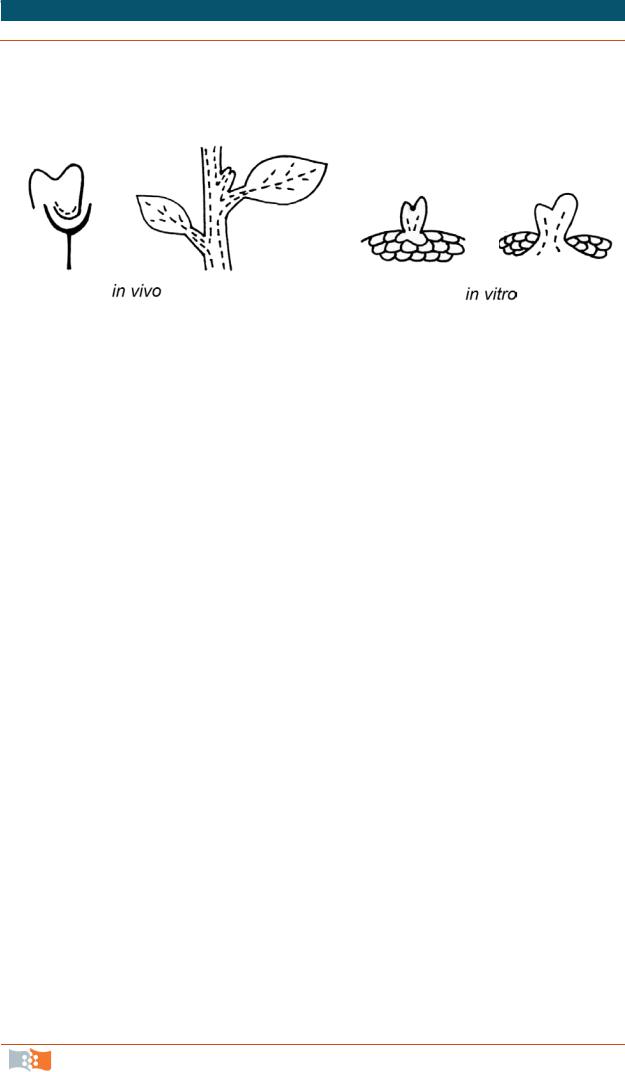
клеток как автономные структуры. Для соматических зародышей, как и для зиготических, характерна биполярность [9] (рис. 4.13).
а |
б |
в |
г |
Рис. 4.13. Морфологические особенности зиготических (а) и соматических (в) зародышей по сравнению со стеблевыми почками, развивающимися in vivo (б) и in vitro (г)
Стеблевые почки, развивающиеся и у интактных растений, и в культуре in vitro, монополярны и не автономны, так как связаны сосудистыми тканями с органом растения или каллусной тканью.
Пример соматического эмбриогенеза in vivo – адвентивная полиэмбриония у цитрусовых. В одном семени может развиваться до сорока зародышей. Обычно один зародыш зиготический. Он формируется от слияния половых клеток и несет признаки материнского и отцовского растения. Остальные зародыши – неполовые, развиваются из клеток нуцеллуса, окружающего зародышевый мешок, и несут признаки только материнского растения. Способность к полиэмбрионии у цитрусовых используют для их клонального размножения. Нуцеллус изолируют и культивируют in vitro в условиях, где происходит индукция образования эмбриоидов из отдельных клеток.
Образование структур, подобных зародышевым, впервые описал Ф. Стюард в 60-е гг. Культивирование клеток корня моркови в жидкой среде с кокосовым молоком приводило к их быстрому делению и образованию клеточных агрегатов. Внутри этих агрегатов происходила дифференцировка элементов ксилемы, после чего формировались корневые зачатки. При переносе культуры на агаризованную среду наблюдалось образование из этих структур побегов, развивающихся в целое растение.
Источником эмбриогенного каллуса у моркови могут быть разные органы: корень, листья, стебель, зиготические зародыши.
Интересной моделью для изучения соматического эмбриогенеза является лютик – Ranunculus sceleratus. На среде, содержащей кокосовое молоко,
всоматических тканях и пыльниках формируется эмбриогенный каллус.
Втечение трех недель как внутри каллуса, так и на его поверхности образуются эмбриоиды, по своему строению напоминающие зиготические зародыши. Такие же эмбриоиды могут формироваться и из клеток суспензионной культуры. При пассировании соматических зародышей на свежую
Современные проблемы и методы биотехнологии. Учеб. пособие |
199 |

ГЛАВА 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ
4.6. Органогенез в культуре соматических тканей
среду индуцируется развитие проростков, у которых по всему стеблю из отдельных эпидермальных клеток без дополнительной индукции формируются многочисленные эмбриоиды.
У злаков в условиях культивирования эмбриогенный каллус может быть получен из щитков молодых зародышей, помещенных на поверхность агаризованной среды, содержащей 2,4-Д. Соматический эмбриогенез у злаков на примере культурного ячменя был впервые описан в 1970 г. Норстогом.
Различают критические стадии в развитии и прорастании эмбриоидов, индуцированных в каллусной культуре:
1.Дедифференциация клеток экспланта. Этот период связан с активацией генов, контролирующих деление клеток. В культуральную среду необходимо вводить ауксины (например, для злаков) или ауксины в сочетании с цитокининами (для хвойных), стимулирующие как процесс дедифференциации, так и образования эмбриогенных групп клеток.
2.Развитие эмбриоидов, происходящее в зонах эмбриогенных клеток и контролируемое генами, последовательно экспрессирующимися на разных стадиях эмбриоидогенеза. На данном этапе культивирования концентрация ауксинов в питательной среде или снижается, или полностью исключается.
3.Прорастание эмбриоидов и развитие растений. В этот период требования к среде и условиям культивирования могут быть различными в зависимости от культивируемого объекта. Так, для развития растений из эмбриоидов цитрусовых в культуре нуцеллуса необходим гиббереллин, а у винограда культивирование проводят при пониженной температуре (t = 4 °С). Чтобы индуцировать прорастание соматических эмбриоидов у злаков и цикламена, необходимо использовать безгормональную среду или среду с низким содержанием ауксинов [10].
Возможность получения соматических зародышей у растений используют для получения искусственных семян или при клональном размножении растений.
4.6.3. Сомаклональнаяизменчивость
Морфогенез и регенерация растений в культуре соматических клеток достаточно часто сопровождается изменениями регенерантов по сравнению с растениями, введенными в культуру.
Австралийскими исследователями Ларкиным и Скоукрофтом растениярегенеранты предложено называть сомаклонами (от сома – тело), а проявление генетической изменчивости у растений, регенерировавших в результате культивирования in vitro, – сомаклональной изменчивостью. По определению Бутенко [7], сомаклональные варианты – фенотипическое выражение непостоянства ядерного и органельного геномов растительных клеток, от истинных генных мутаций отличаются большой частотой возникновения и комплексностью изменений (изменения в структуре генов, хромосом, геномов).
Современные проблемы и методы биотехнологии. Учеб. пособие |
200 |
