
- •1.6. Витамины
- •1.6.1. Жирорастворимые витамины
- •1.6.2. Водорастворимые витамины
- •1.6.3. Антивитамины
- •2. Биохимическая энергетика и ферменты
- •2.1. Биохимическая энергетика
- •2.1.1. Принципы функционирования
- •2.1. Теплота сгорания некоторых биохимических продуктов
- •2.1.2. Тепловые эффекты биохимических реакций
- •2.2. Стандартные энтальпии образования (dн˚) и стандартные
- •2.1.3. Термодинамические критерии направленности
- •2.3. Стандартные свободные энергии образования
- •2.4. Стандартные окислительно-восстановительные потенциалы
- •2.1.4. Сопряжённый синтез веществ
- •2.5. Стандартные свободные энергии гидролиза
- •2.1.5. Общие закономерности осуществления
- •2.2. Ферменты
- •2.2.1. Механизм действия ферментов
- •2.2.2. Строение двухкомпонентных ферментов
- •2.2.3. Каталитическая активность ферментов
- •2.2.4. Изоферменты
- •2.2.5. Изменение активности ферментов в зависимости
- •Vmax – максимальная скорость ферментативной реакции при данном
- •2.2.6. Локализация ферментов
- •2.2.7. Регуляция ферментативных реакций
- •2.2.8. Классификация ферментов
2.2.7. Регуляция ферментативных реакций
В каждой растительной клетке и во всём организме в целом одно-временно происходят многие тысячи биохимических реакций, которые осуществляются строго согласованно в соответствии с генетической про-граммой развития организма и функционированием механизмов адаптации растений к изменениям условий окружающей среды. При этом растения и другие высшие организмы представляют собой очень хорошо сбалан-сированные и эффективно действующие саморегулирующиеся системы. Это оказывается возможным благодаря тому, что в любых живых орга-низмах имеются системы регуляции биохимических процессов, связанные прежде всего с воздействием на синтез и каталитическую активность фер-ментов.
В зависимости от особенностей синтеза все ферменты подразделяют на две группы – конститутивные и индуцируемые (или индуцибельные) ферменты. Конститутивные ферменты постоянно синтезируются в клет-ках организма независимо от их состояния и условий окружающей среды. Они катализируют жизненно важные и постоянно протекающие в орга-низме биохимические реакции, например, реакции дыхания.
Однако синтез многих других ферментов почти все время подавлен специфическими белками-репрессорами. Но действие белка репрессора, ингибирующего синтез фермента, прекращается при появлении в клетке определённого вещества, превращение которого катализирует данный фер-мент, или под воздействием какого-либо другого фактора, способного по-нижать ингибиторную активность белка-репрессора, при этом иниции-руется синтез белка-фермента. Образующиеся в результате такого регу-ляторного механизма ферментные белки получили название индуцируемых ферментов.
Регуляция скорости реакций, катализируемых конститутивными ферментами, осуществляется с помощью аллостерических активаторов и ингибиторов, называемых аллостерическими эффекторами. Они способ-ны связываться с определённым участком молекулы фермента, который пространственно удалён от каталитического центра, при этом происходит изменение конформации ферментного белка, вызывающее усиление или ослабление его каталитических свойств. Участок связывания аллостери-ческого эффектора называют аллостеричеким центром фермента, а сами ферментные белки, имеющие аллостерический центр, получили название аллостерических ферментов. Связывание эффектора с аллостерическим центром фермента происходит на основе такой же специфической реакции, как и связывание субстрата с каталитическим центром ферментного белка.
Аллостерические ферменты чаще всего представляют собой олиго-мерные белки, в каждой субъединице которых имеются центры связы-вания для субстрата, активатора и ингибитора. Такой белок может нахо-диться в двух конформациях, между которыми существует подвижное рав-новесие. В одной из них он связывает молекулы активатора, которые вы-зывают перестройку пространственной структуры ферментного белка и оп-тимизацию структуры каталитического центра (рис. 2.10). В другой кон-формации субъединицы аллостерического фермента связывают молекулы ингибитора, под действием которого ферментный белок переходит в неак-тивное состояние.
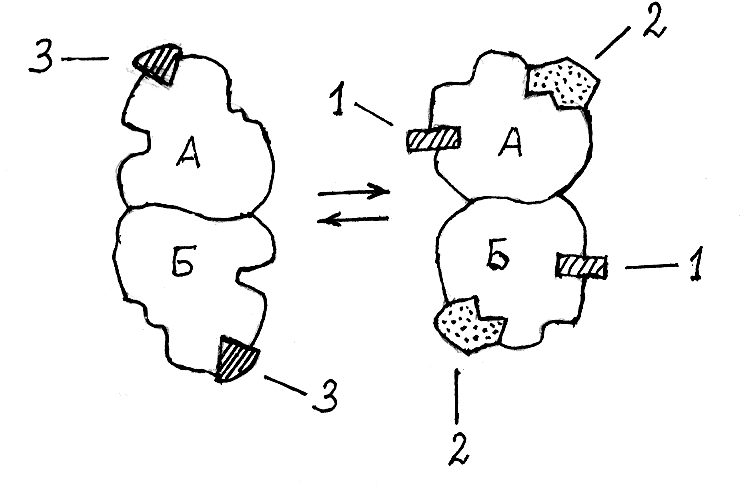 Рис.
2.10. Взаимодействие
аллостерического
Рис.
2.10. Взаимодействие
аллостерического
фермента с активатором и ингибитором
1 – активатор, связанный с аллостерическим цен-тром фермента; 2 – субстрат, связанный с катали-тическим центром фермента; 3 – ингибитор, связан-ный с аллостерическим центром фермента; А и Б –
полипептидные субъединицы фермента
Общее число молекул фермента, находящихся в каталитически ак-тивной конформации, зависит от соотношения концентраций активатора, ингибитора и субстрата. При достаточно высокой концентрации ингиби-тора аллостерический фермент находится преимущественно в каталити-чески неактивной конформации и скорость ферментативной реакции очень сильно замедляется. Если в физиологической среде создаётся высокая кон-центрация активатора, то аллостерический фермент переходит в каталити-чески активную конформацию, обеспечивая ускорение катализируемой ре-акции. Роль активаторов и ингибиторов аллостерических ферментов вы-полняют биохимические метаболиты, образующиеся в ходе жизнедеятель-ности организма.
Так, например, связывание СО2 с рибулозо-1,5-дифосфатом в ходе фотосинтеза катализирует аллостеричесий фермент рибулозодифосфаткар-боксилаза (см. раздел 3.1.1). Аллостерическим активатором этого фермен-та служит фруктозо-6-фосфат, образующийся в процессе превращения и взаимодействия продуктов данной реакции, тогда как другой продукт реакций фотосинтеза фруктозо-1,6-дифосфат действует как аллостеричес-кий ингибитор фермента рибулозодифосфаткарбоксилазы. Если в хлоро-пластах в результате действия каких-либо факторов замедляется превраще-ние фруктозо-1,6-дифосфата во фруктозо-6-фосфат, то происходит накоп-ление этого продукта и он аллостерически подавляет действие фермента рибулозодифосфаткарбоксилазы, вследствие чего скорость включения СО2 в углеводные продукты фотосинтеза понижается.
Активность дыхательного фермента фосфофруктокиназы, катализи-рующего фосфорилирование фруктозо-6-фосфата от АТФ с образованием фруктозо-1,6-дифосфата, аллостерически активируется повышенной кон-центрацией АДФ и ингибируется повышенной концентрацией АТФ.
Аллостерической регуляции, как правило, подвержены так называе-мые ключевые ферменты, которые катализируют лимитирующие стадии биохимических превращений, в ходе которых происходит значительное уменьшение свободной энергии. Ферменты, катализирующие другие этапы в данной цепи превращений, чаще всего не обладают аллостерическими свойствами, поэтому их действие в основном определяется концентра-циями субстратов и образующихся продуктов. Почти всегда к лимити-рующим стадиям, которые катализируют аллостерические ферменты, от-носятся начальные реакции в цепях последовательных биохимических превращений и реакции, приводящие к ветвлению метаболических путей.
Наиболее распространены два вида аллостерических механизмов ре-гуляции: ингибирование по типу отрицательной обратной связи и регу-ляция опережающего типа, или активация предшественником. Ингибиро-вание по типу отрицательной обратной связи происходит в том случае, когда наблюдается накопление конечного продукта в цепи последова-тельных биохимических превращений, что может вызвать нарушение об-мена веществ. Этот метаболит действует как аллостерический ингибитор, понижая активность ферментов, катализирующих лимитирующие стадии данного метаболического пути и в первую очередь фермента, который катализирует начальный этап превращений.
В ряде других реакций осуществляется регуляция опережающего типа (активация предшественником), когда образовавшийся метаболит ал-лостерически активирует фермент, катализирующий его превращение, или другой фермент в цепи последующих превращений. Так, например, осу-ществляется аллостерическая активация продуктом первой реакции цикла Кребса лимонной кислотой фермента изоцитратдегидрогеназы, катализи-рующей один из последующих этапов её превращения.
На рисунке 2.11 показана схема возможной аллостерической регуля-ции синтеза двух биохимичеких продуктов из одного метаболического предшественника (A). Если по какой-либо причине увеличивается концен-трация продукта Р1, то он аллостерически ингибирует фермент Фсд и дей-ствует как аллостерический активатор на фермент Фск, переводя таким об-разом метаболические реакции на синтез продукта Р2. Если же продукт Р2 также будет накапливаться, то он аллостерически игибирует фермент Фск, а образующийся продукт С уже действует как аллостерический ингибитор фермента ФАВ, катализирующего начальную стадию превращений. В цепи превращений С → Р1 продукт Д алостерически активирует действие фер-мента ФEF, обеспечивая сдвиг равновесия в реакции Д D Е для образования продукта Е.
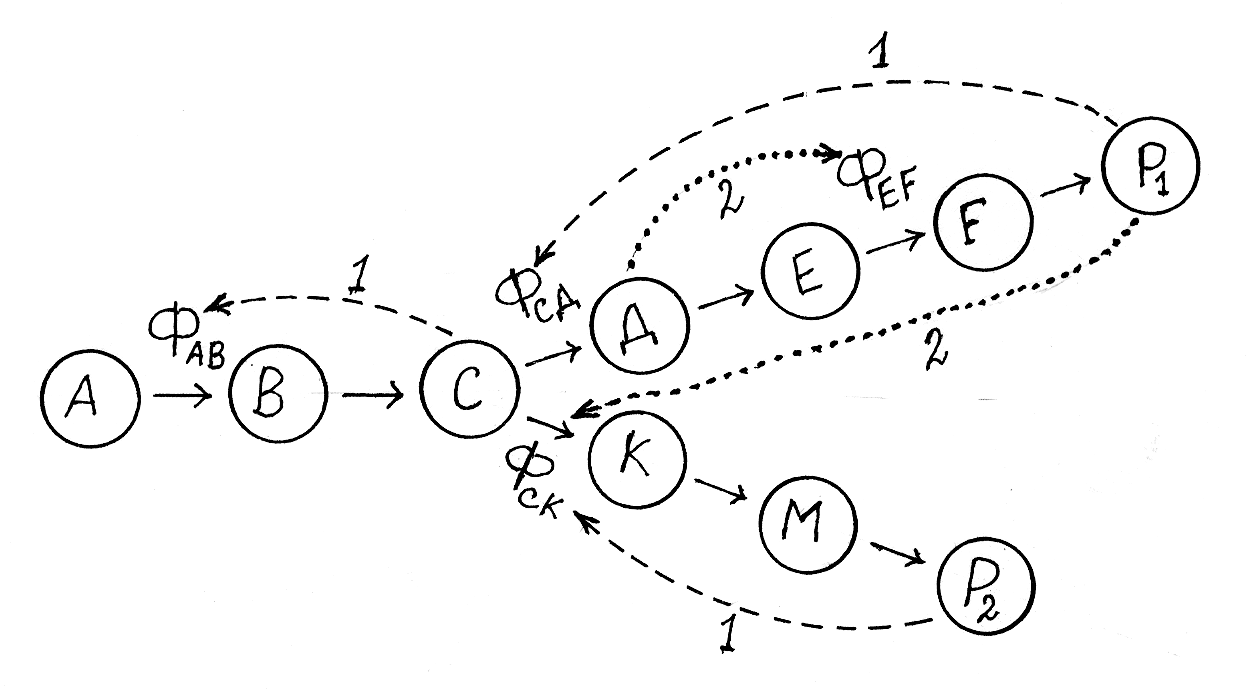
Рис. 2.11. Возможная схема аллостерической регуляции фермента-
тивных реакций синтеза двух биохимических продуктов Р1 и Р2
А – первичный субстрат; В, С, Д, Е, F, К, М – промежуточные продукты;
Р1 и Р2 – конечные продукты; ФАВ, ФСД, ФEF, ФСК – аллостерические ферменты;
1 – аллостерическое ингибирование; 2 – аллостерическая активация
На примере рассмотренной схемы аллостерической регуляции пока-зано лишь одно из звеньев довольно сложной общей системы метабо-лических взаимодействий в организме, включающей элементы множест-венной регуляции, когда один и тот же метаболит может аллостерически воздействовать на целую группу ферментов, катализирующих биохими-ческие превращения в разных метаболических путях, объединяя их в еди-ную регуляторную систему. Благодаря этому формируется довольно слож-ная и хорошо сбалансированная система регуляции всех биохимических превращений, из которых складывается в целом обмен веществ организма. В результате существования такой перекрёстной системы регуляции ока-зывается возможным переключение биохимических превращений с одного метаболического пути на другой.
При рассмотрении схем регуляции ферментативных реакций следует отметить очень важную особенность. Если фермент представлен в орга-низме набором изоферментов, то активность каждого изофермента регу-лируется разными метаболитами, что придаёт системе аллостерической ре-гуляции метаболических реакций большую лабильность и эффективность.
Быстрый перевод фермента в активную или неактивную форму может происходить также путём ковалентной модификации его молекул в результате присоединения фосфатных групп или нуклеотидных радикалов. В свою очередь, ферменты, катализирующие ковалентную модификацию, регулируются по аллостерическому механизму.
Регуляция активности индуцируемых ферментов осуществляется как в процессе их синтеза, так и с участием аллостерических механизмов. Син-тез ферментов, как и других белков, представляет собой довольно слож-ный биохимический процесс, который включает синтез рибосомной (рРНК), транспортной (тРНК) и матричной (мРНК) рибонуклеиновых кислот, называемый транскрипцией.
С участием рибосомной РНК происходит
образование рибосом, ко-торые при
взаимодействии с матричной и транспортной
РНК осуществ-ляют синтез ферментных и
других белков. Этот процесс называют
тран-сляцией. Установлено, что у
высших организмов регуляция синтеза
фер-ментов может происходить в процессе
как транскрипции, так и трансля-ции.
Однако значительно лучше изучен механизм
регуляции синтеза фер-м
участием рибосомной РНК происходит
образование рибосом, ко-торые при
взаимодействии с матричной и транспортной
РНК осуществ-ляют синтез ферментных и
других белков. Этот процесс называют
тран-сляцией. Установлено, что у
высших организмов регуляция синтеза
фер-ментов может происходить в процессе
как транскрипции, так и трансля-ции.
Однако значительно лучше изучен механизм
регуляции синтеза фер-м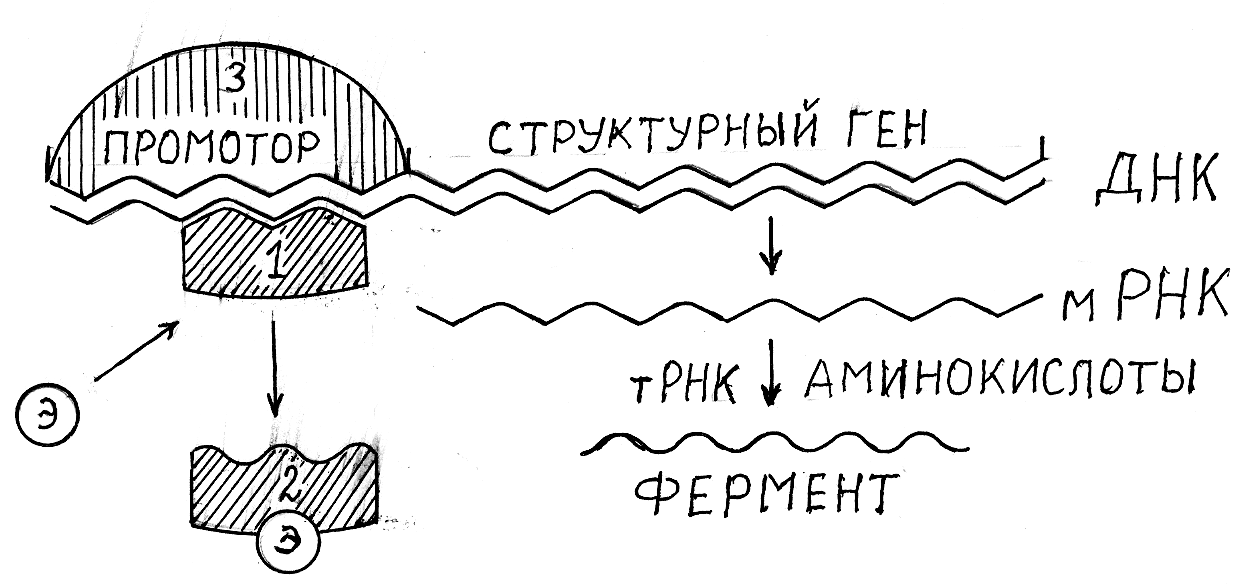 ентов
на уровне транскрипции. Принципиальная
схема такого процесса представлена на
рисунке 2.12.
ентов
на уровне транскрипции. Принципиальная
схема такого процесса представлена на
рисунке 2.12.
Рис. 2.12. Схема регуляции синтеза фермента белком-репрессором
1 – белок-репрессор присоединён к одному из участков промотора; 2 – белок-ре-прессор переведён в неактивное состояние аллостерическим эффектором; 3 – фер-мент РНК-полимераза, который присоединяется к промотору после перевода в не-активное состояние белка-репрессора; Э – аллостерический эффектор, активируе-
мый субстратом синтезируемого фермента
Основной регулируемый этап на этой схеме – синтез матричной РНК, катализируемый ферментом РНК-полимеразой. Этот фермент в ре-зультате специфического взаимодействия связывается с определённым участком молекулы ДНК – промотором, после чего он способен катализи-ровать синтез мРНК. Однако действие РНК-полимеразы блокирует белок-репрессор, который связывается с промотором в акцепторной зоне, выклю-чая таким образом процесс транскрипции (т. е. синтез мРНК).
Белок-репрессор относится к аллостерическим белкам. Аллостери-ческими эффекторами, воздействующими на белки-репрессоры в системе синтеза ферментов, являются или сами субстраты, которые должны прев-ращаться с участием синтезируемых ферментов, или вещества, активиру-емые субстратами. И в том и в другом случае при поступлении в клетки организма соответствующих субстратов происходит аллостерическая пере-стройка структуры белка-репрессора, вследствие чего уменьшается срод-ство этого белка к акцепторной зоне промотора и он уже не препятствует действию фермента РНК-полимеразы, катализирующей синтез мРНК. Да-лее уже с участием мРНК синтезируются молекулы ферментного белка, ко-торый необходим для превращения поступившего субстрата. После того как произойдет полное превращение субстрата, его воздействие на белок-репрессор прекращается, вследствие чего восстанавливается сродство это-го белка к промотору и синтез мРНК снова блокируется.
Регуляция синтеза ферментов очень хорошо изучена у бактерий. У растений также известны индуцируемые ферменты, к ним относятся a-амилазы семян, нитратредуктаза и многие другие ферменты азотного об-мена, некоторые протеолитические ферменты.
В ходе жизнедеятельности организмов синтез некоторых ферментов может ингибироваться конечными продуктами биохимических превраще-ний по механизму отрицательной обратной связи. В этом случае накапли-вающийся конечный продукт, взаимодействуя с аллостерическим центром белка-репрессора, усиливает его сродство к ДНК, в результате чего белок- репрессор связывается с промотором в акцепторной зоне и останавливает транскрипцию генов, кодирующих структуру полипептидов данного фер-ментного белка. Вследствие понижения концентрации фермента умень-шаются скорость катализируемой им биохимической реакции и выход об-разующихся продуктов, что, в свою очередь, окажет соответствующие вли-яние на всю цепочку последовательных биохимических превращений со-гласно принципам смещения равновесия в химических реакциях и, как следствие, понизит концентрацию конечного продукта.
В качестве примера регуляции синтеза ферментов по механизму от-рицательной обратной связи можно рассмотреть схему реакций образо-вания аминокислот лизина, треонина, метионина и изолейцина у растений и ряда микроорганизмов (рис. 2.13). Исходным соединением для синтеза указанных аминокислот служит аспарагиновая кислота. В схеме представ-ленных биохимических реакций выделены две лимитирующие стадии, наиболее сильно влияющие на суммарную скорость процесса. Одна из них – первая реакция в цепи превращений аспарагиновой кислоты в указанные на схеме аминокислоты, её катализирует фермент аспартаткиназа. Вторая находится на одном из разветвлений в указанной цепи превращений, и она даёт начало реакциям, в ходе которых из полуальдегида аспарагиновой кислоты синтезируются аминокислоты метионин, треонин и изолейцин.

Рис. 2.13. Схема регуляции синтеза ферментов конечными продукта-ми, образующимися в ходе последовательных превращений аспараги-
новой кислоты
Эту стадию катализирует фермент гомосериндегидрогеназа. Как по-казано на схеме, синтез этих двух ферментов зависит от концентрации ко-нечных продуктов – лизина, метионина, треонина и изолейцина. При этом следует отметить, что указанные аминокислоты не только осуществляют ингибирование синтеза ферментов аспартаткиназы и гомосериндегидро-гиназы, но и подавляют их активность по аллостерическому механизму.
Эффективность регуляции ферментативных реакций путём воздей-ствия на синтез ферментов в значительной степени определяется периодом полужизни ферментов. Чем дольше сохраняется активность фермента пос-ле прекращения его синтеза, тем менее эффективна регуляция фермента-тивной реакции и потребуется достаточно много времени, чтобы пол-ностью её остановить (несколько часов или даже дней). В свою очередь, период полужизни фермента зависит от скорости его инактивации в клетке и гидролитического расщепления протеолитическими ферментами.
Таким образом, синтез и деградация ферментов находятся в дина-мическом равновесии, и регуляция активности ферментов на этом уровне происходит сравнительно медленно. Более быстро она осуществляется с участием аллостерических ферментов и посредством механизма ковалент-ной модификации ферментных белков. В этом случае регуляторное воздей-ствие направлено непосредственно на ферменты.
Некоторые ферменты синтезируются в виде проферментов (зимоге-нов), представляющих собой каталитически неактивные белки, которые могут переходить в активную форму в результате отщепления от их мо-лекул определённых полипептидов, восстановления дисульфидных груп-пировок (−S−S−) в тиоловые группы (−SH), ковалентной модификации мо-лекулы путём фосфорилирования и т. д. Синтезированные на рибосомах эндоплазматического ретикулума проферменты очень часто упаковыва-ются в зимогенные гранулы, которые могут перемещаться к поверхности клетки или даже секретироваться в окружающую среду. В виде зимоген-ных форм синтезируются многие пищеварительные ферменты человека и животных (пепсин, трипсин, химотрипсин, карбоксипептидазы), расти-тельный фермент папаин, некоторые гидролитические ферменты семян растений (амилазы и протеазы).
Важными компонентами регуляторной системы растений являются фитогормоны. Поскольку они легко переносятся по флоэме, эти физиоло-гически активные соединения могут выполнять функцию переноса регуля-торных сигналов от одних тканей или органов растения к другим, вызывая синтез и активацию определённых ферментов.
Действие гормонов на активацию биохимических процессов может осуществляться двумя путями. Первый путь – это быстрое регуляторное воздействие, связанное с активацией ферментов путём ковалентной моди-фикации. В этом случае гормон соединяется с определённым белком в составе клеточной мембраны, который называют рецепторным белком. Под действием гормона происходит конформационное изменение рецеп-торного белка в составе мембраны, которое инициирует перестройку всей мембранной структуры, вызывая активацию связанных с мембраной ферментов. В свою очередь, с участием этих ферментов приводится в дей-ствие рассмотренный выше механизм ковалентной модификации фермент-ных белков, катализирующих различные метаболические реакции в клетке.
Второй путь связан с воздействием гормонов на регуляторную сис-тему синтеза ферментных белков. На основе специфической реакции гор-мон соединяется с цитоплазматическим белком-рецептором. Затем образо-вавшийся гормон-рецепторный комплекс перемещается в ядро и взаимо-действует там с регуляторным белком, инициируя или замедляя процесс транскрипции соответствующего гена. В опытах по изучению действия фиторегуляторов выяснено, что ауксины активируют в цитоплазме синтез кислых гидролаз (проявляющих активность в кислой среде), цитокинины – фермента нитратредуктазы, гиббереллины – образование в прорастающих зерновках злаков a-амилаз, катализирующих гидролитическое расщепле-ние молекул крахмала.
Регуляция светом. В растениях многие биохимические процессы регулируются светом, который воспринимают в качестве регуляторного сигнала рецепторные белки – фитохром и флавопротеиды.
При поглощении красного света (660 нм) в структуре молекулы фитохрома происходит конформационная перестройка, которая переводит этот белок в активированное состояние. он связывается с клеточной мем-браной и вызывает регуляторное действие примерно по такому же меха-низму, как и гормоны. Если же активная форма фитохрома поглощает свет с длиной волны 730 нм, этот белок превращается в неактивную форму. В опытах установлено, что фитохром регулирует активность ферментов, катализирующих реакции фотосинтеза (фруктозо-1,6-дифосфатаза, глице-ральдегидфосфатдегидрогеназа), проницаемость клеточных мембран в листьях, синтез гормонов.
Другая группа фотосенсорных белков представлена флавопротеи-дами. У них хромофором служит флавиновая группировка, способная под-вергаться фотохимическому превращению под воздействием синего света.
