
- •1.6. Витамины
- •1.6.1. Жирорастворимые витамины
- •1.6.2. Водорастворимые витамины
- •1.6.3. Антивитамины
- •2. Биохимическая энергетика и ферменты
- •2.1. Биохимическая энергетика
- •2.1.1. Принципы функционирования
- •2.1. Теплота сгорания некоторых биохимических продуктов
- •2.1.2. Тепловые эффекты биохимических реакций
- •2.2. Стандартные энтальпии образования (dн˚) и стандартные
- •2.1.3. Термодинамические критерии направленности
- •2.3. Стандартные свободные энергии образования
- •2.4. Стандартные окислительно-восстановительные потенциалы
- •2.1.4. Сопряжённый синтез веществ
- •2.5. Стандартные свободные энергии гидролиза
- •2.1.5. Общие закономерности осуществления
- •2.2. Ферменты
- •2.2.1. Механизм действия ферментов
- •2.2.2. Строение двухкомпонентных ферментов
- •2.2.3. Каталитическая активность ферментов
- •2.2.4. Изоферменты
- •2.2.5. Изменение активности ферментов в зависимости
- •Vmax – максимальная скорость ферментативной реакции при данном
- •2.2.6. Локализация ферментов
- •2.2.7. Регуляция ферментативных реакций
- •2.2.8. Классификация ферментов
2.2.2. Строение двухкомпонентных ферментов
Структурной основой двухкомпонентного фермента, как и одноком-понентного, является молекула белка, которую в данном случае называют апоферментом, а небелковую часть фермента принято называть кофер-ментом. Коферменты образуются из витаминов, нуклеотидов и других ак-тивных группировок, включающих атомы металлов, серы, а также произ-водные различных органических соединений (гетероциклические радика-лы пиррола и имидазола, хиноны, липоевая кислота, кетокислоты и др.).
Коферменты имеют разные формы соединения с белковой частью фермента. Одни из них довольно легко отделяются от ферментного белка и могут самостоятельно участвовать в биохимических реакциях, другие свя-заны с белковой частью фермента очень прочно и не могут быть выделены без разрушения молекулы фермента. Коферменты, прочно связанные с ферментным белком, называют простетическими группами. К наиболее хорошо изученным простетическим группам относятся биотин, липоевая кислота, флавиновые коферменты и железосодержащие коферменты – гемы.
Витамин биотин выполняет роль простетической группы в составе молекул ферментов карбоксилаз, катализирующих реакции образования карбоксильных групп с участием СО2 (–НСО3⁻), и карбоксилтрансфераз, участвующих в переносе карбоксильных групп. В составе этих ферментов молекула биотина своей карбоксильной группой соединяется с ε-амино-группой остатка аминокислоты лизина, находящегося в структуре белко-вой части фермента.
В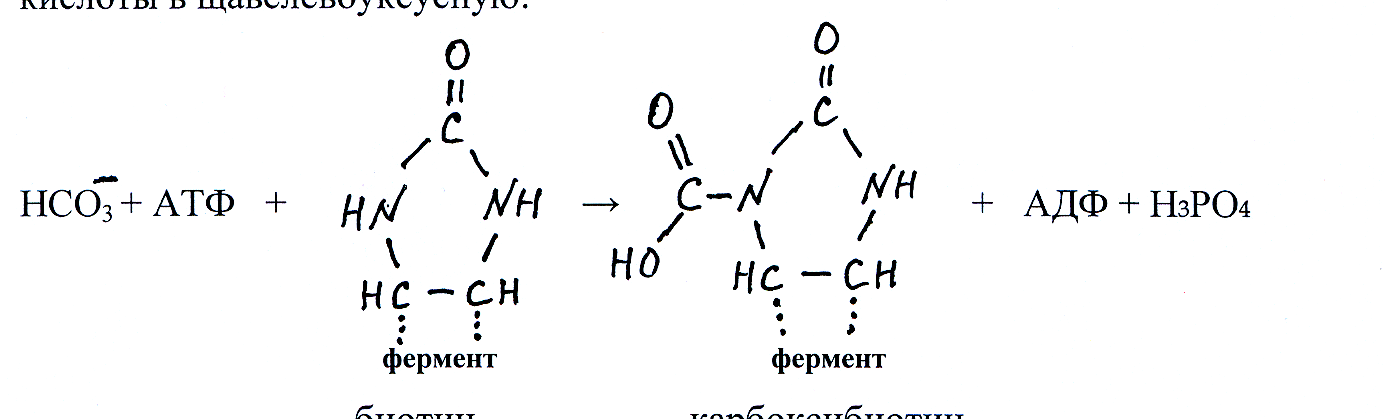 ходе реакций карбоксилирования и
транскарбоксилирования био-тин, связанный
с белком фермента, вначале превращается
в карбоксибио-тин, а затем передаёт
карбоксильную группу на субстрат. При
этом уста-новлено, что образование
карбоксильной группы с участием СО2
(–НСО3⁻)
сопряжено с гидролизом АТФ и эту реакцию
также катализирует биотин-зависимый
фермент. В качестве примера рассмотрим
действие фермента пируваткарбоксилазы,
катализирующего превращение пировиноградной
кислоты в щавелевоуксусную:
ходе реакций карбоксилирования и
транскарбоксилирования био-тин, связанный
с белком фермента, вначале превращается
в карбоксибио-тин, а затем передаёт
карбоксильную группу на субстрат. При
этом уста-новлено, что образование
карбоксильной группы с участием СО2
(–НСО3⁻)
сопряжено с гидролизом АТФ и эту реакцию
также катализирует биотин-зависимый
фермент. В качестве примера рассмотрим
действие фермента пируваткарбоксилазы,
катализирующего превращение пировиноградной
кислоты в щавелевоуксусную:
биотин карбоксибиотин
(в составе фермента)

карбоксибиотин пировиноградная биотин щавелевоуксусная
(в составе кислота (в составе кислота
фермента) фермента)
В составе фермента содержатся белковые субъединицы, участвую-щие в связывании бикарбонат-иона, АТФ и пирувата, а также катализиру-ющие присоединение карбоксильной группы от бикарбоната к биотину с образованием карбоксибиотина и далее перенос карбоксильной группы от карбоксибиотина на молекулу пировиноградной кислоты, а биотиновый кофермент регенерируется снова в биотин.
Липоевая кислота в качестве простетической группы входит в сос-тав ферментов, катализирующих окислительное декарбоксилирование a-кетокислот. Как и биотин, она соединяется амидной связью с ε-амино-группой аминокислоты лизина, входящего в состав ферментного белка:

остаток липоевой кислоты остаток лизина в белке
В процессе реакции липоевая кислота подвергается восстановлению и становится акцептором ацильного радикала кетокислоты, после чего ацильный радикал связывается с другим коферментом, а липоевая кислота снова превращается в окисленную форму. Наиболее хорошо изучено действие ферментов, имеющих в качестве кофермента липоевую кислоту, при окислительном декарбоксилировании пировиноградной и α-кетоглу-таровой кислот (см. раздел 3.1.2).
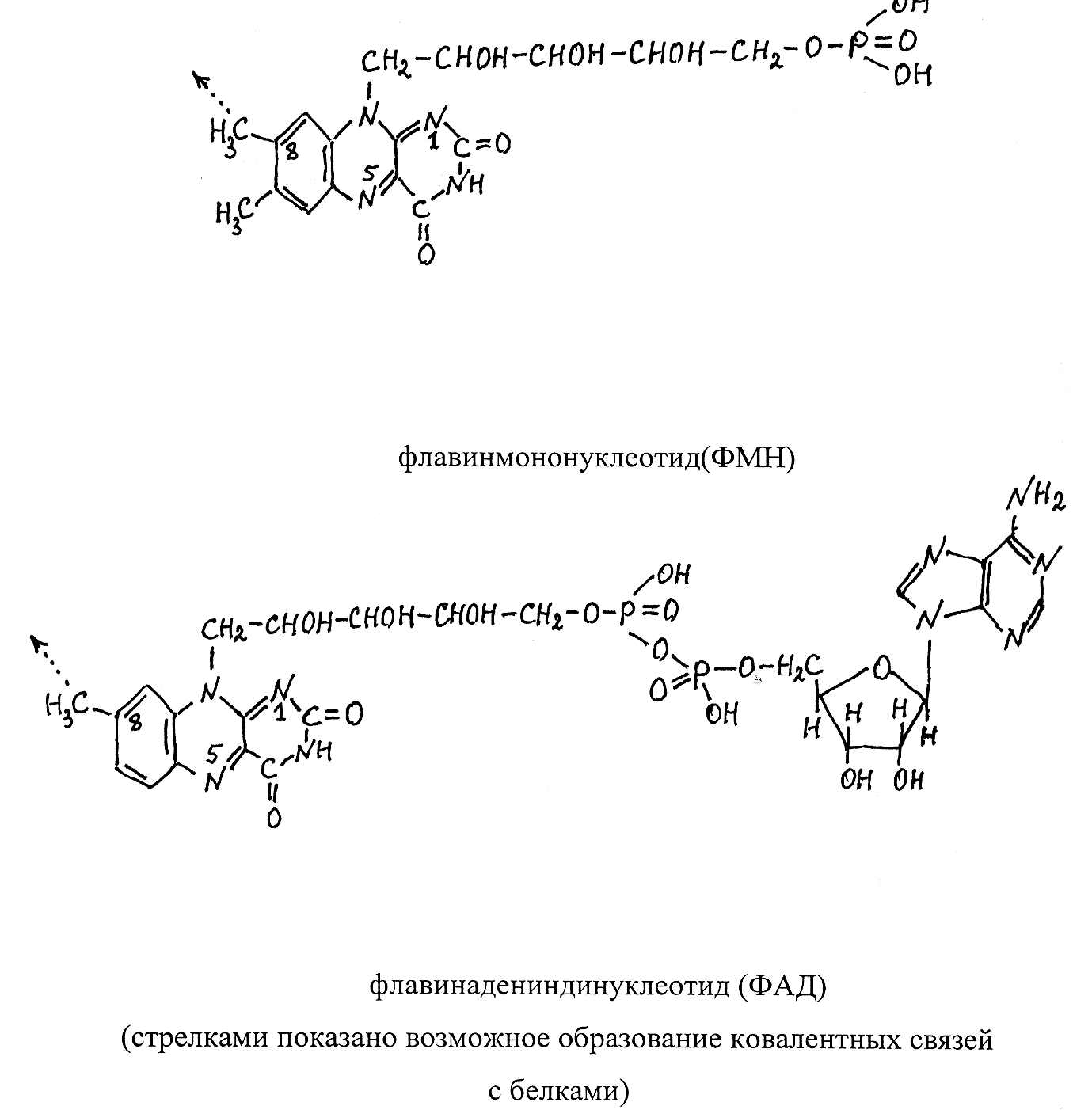
Флавиновые простетические группы представлены двумя видами соединений – флавинадениндинуклеотидом (ФАД) и флавинмононуклео-тидом (ФМН), которые ковалентно связаны с ферментными белками.
Коферментная группировка ФМН представляет собой витамин рибо-флавин, фосфорилированный по спиртовой группе пятого углеродного атома рибита, а в составе ФАД к ФМН путём взаимодействия фосфатных остатков присоединяется нуклеотидный радикал аденозинмонофосфата (АМФ). Чаще всего флавиновая простетическая группа соединяется с фер-ментным белком в результате образования ковалентной связи (показана стрелкой) между углеродом метильной группы, соединённой с восьмым углеродным атомом диметилизоаллоксазина, и азотом гетероцикличес-кого радикала гистидина или атомом серы цистеинового остатка в составе белка.

![]()
флавинмононуклеотид (ФМН)

Флавинадениндинуклеотид (ФАД)
К аталитическая
активность указанных простетических
групп прояв-ляется в том, что они способны
присоединять атомы водорода к атомам
азота диметилизоаллоксазина в положениях
1 и 5 с последующей пере-группировкой
двойных связей:
аталитическая
активность указанных простетических
групп прояв-ляется в том, что они способны
присоединять атомы водорода к атомам
азота диметилизоаллоксазина в положениях
1 и 5 с последующей пере-группировкой
двойных связей:
В результате присоединения атомов водорода флавиновый кофер-мент превращается в восстановленную форму, которая сокращённо запи-сывается ФАД · Н2 или ФМН · Н2, а окисленная форма соответственно ФАД и ФМН.
В настоящее время известны несколько десятков ферментов, имею-щих флавиновые коферменты. Они могут функционировать в качестве переносчиков водорода в дыхательных реакциях и катализируют многие реакции окисления: спиртов в альдегиды, дигидролипоевой кислоты в липоевую, гликолевой кислоты в глиоксиловую. С участием флавиновых ферментов происходит образование α,β-ненасыщенных производных жир-ных кислот и превращение янтарной кислоты в фумаровую.
В ажные
функции в организмах выполняют ферменты,
имеющие в своём составе простетические
группы в виде гема. Гемы представляют
со-бой устойчивые хелатные комплексы
порфириновой группировки с ато-мом
железа. Порфириновая группировка
образуется из четырех гетеро-циклических
структур пиррола (обозначаемых А, В, С,
D), соединенных метеновыми
радикалами (=СН–) в более крупную
циклическую группи-ровку, к которой
присоединены ещё восемь боковых
радикалов. В зависи-мости от строения
этих радикалов различают разные типы
гемов (прото-гем, гем а, гем c
и др.). При соединении со специфическим
белком гем может выполнять роль
переносчика электронов, катализировать
окисли-тельно-восстановительные реакции
с участием кислорода или пероксида
водорода.
ажные
функции в организмах выполняют ферменты,
имеющие в своём составе простетические
группы в виде гема. Гемы представляют
со-бой устойчивые хелатные комплексы
порфириновой группировки с ато-мом
железа. Порфириновая группировка
образуется из четырех гетеро-циклических
структур пиррола (обозначаемых А, В, С,
D), соединенных метеновыми
радикалами (=СН–) в более крупную
циклическую группи-ровку, к которой
присоединены ещё восемь боковых
радикалов. В зависи-мости от строения
этих радикалов различают разные типы
гемов (прото-гем, гем а, гем c
и др.). При соединении со специфическим
белком гем может выполнять роль
переносчика электронов, катализировать
окисли-тельно-восстановительные реакции
с участием кислорода или пероксида
водорода.

протогем
Гемопротеиды, участвующие в переносе электронов, получили наз-вание цитохромов. Все они представляют собой сравнительно низкомо-лекулярные белки, имеющие в качестве простетической группы гем, прочно связанный с молекулой белка. Цитохромы, различающиеся строе-нием гема и белковой молекулы, обычно обозначают латинскими буквами а, в, с, d, f.
Активным компонентом в структуре гема, принимающим участие в переносе электронов, является атом железа. В окисленном цитохроме железо содержится в виде Fe3+, а после присоединения электрона оно превращается в восстановленную форму Fe2+ :
цит (Fe3+) + `е ® цит ( Fe2+).
Восстановленный цитохром передает электрон другому акцептору, превращаясь в окисленную форму, способную снова присоединять элек-трон от донора:
цит (Fe2+) + акцептор ® цит (Fe3+) + восстановленный акцептор.
Ферменты пероксидаза и каталаза содержат простетическую группу в виде протогема, включающего железо в виде Fe3+. Пероксидазы катали-зируют окислительно-восстановительные реакции с участием пероксида водорода (Н2О2) по схеме:
пероксидаза
Н2О2 + АН2 ¾¾¾¾® 2Н2О + А
Много этих ферментов синтезируется в растительных тканях, осо-бенно в пероксисомах.
Каталаза катализирует разложение пероксида водорода на воду и кислород:
каталаза
2Н2О2 ¾¾® 2Н2О + О2
Пероксид водорода оказывает повреждающее воздействие на клеточ-ные мембраны, подвергая их пероксидному окислению, а фермент каталаза предотвращает накопление Н2О2 в клетках организма.
Активную роль в переносе электронов играют железосерные белки, у которых простетическая группа образуется атомами железа, соединён-ными лабильными связями с атомами серы. Атомы Fe соединяются с белком через атомы серы четырёх остатков цистеина. Очень часто атомы железа при соединении с атомами серы образуют Fe4S4-кластеры (рис. 2.4).

Рис. 2.4. Пространственное изображение Fe4S4–кластера
в составе железосерного белка
Fe – атомы железа; S – атомы лабильной серы; Б – полипептидные цепи белка,
соединённые с атомами Fe через тиоловые группировки цистеиновых остатков
Полипептидная цепь ферментного белка закручена вокруг железо-серной простетической группы, включающей по 4 атома железа и серы, а также боковые цепи четырёх остатков цистеина, связанных через атомы серы с железом. Каждый из атомов серы в Fe4S4-кластере связан с тремя атомами железа. Простетическая группа железосерного белка способна присоединять и передавать другому акцептору один электрон. При этом электроны, акцептируемые Fe4S4-кластером, не присоединяются к какому-либо конкретному атому, а взаимодействуют с атомами и Fe, и серы.
К железосерным белкам относятся ферредоксины
бактерий и расте-ний, осуществляющие
одноэлектронный перенос. Их простетические
груп-пы могут содержать по 2 или 4 атома
железа и такое же число атомов серы.
Так, например, в ферредоксине растительных
хлоропластов содержится железосерный
кластер, включающий два атома железа и
два атома лабиль-ной серы. С белковой
частью атомы железа соединены через
атомы серы цистеиновых остатков. Строение
простетической группы хлоропластного
ферредоксина можно представить в виде
следующей схемы:
железосерным белкам относятся ферредоксины
бактерий и расте-ний, осуществляющие
одноэлектронный перенос. Их простетические
груп-пы могут содержать по 2 или 4 атома
железа и такое же число атомов серы.
Так, например, в ферредоксине растительных
хлоропластов содержится железосерный
кластер, включающий два атома железа и
два атома лабиль-ной серы. С белковой
частью атомы железа соединены через
атомы серы цистеиновых остатков. Строение
простетической группы хлоропластного
ферредоксина можно представить в виде
следующей схемы:

К числу коферментов, которые связаны с белковой частью фермента лабильными связями, относятся никотинамидадениндинуклеотид (НАД), никотинамидадениндинуклеотидфосфат (НАДФ), кофермент А (КоА), а также коферментные формы витаминов В1, В6, В12, фолиевой кислоты. Эти коферменты удерживаются в активном центре ферментов водородными связями и силами электростатического взаимодействия заряженных групп-пировок кофермента и функциональных групп аминокислотных остатков, образующих активный центр фермента. В связи с этим указанные кофер-менты легко отделяются от белковой части фермента.
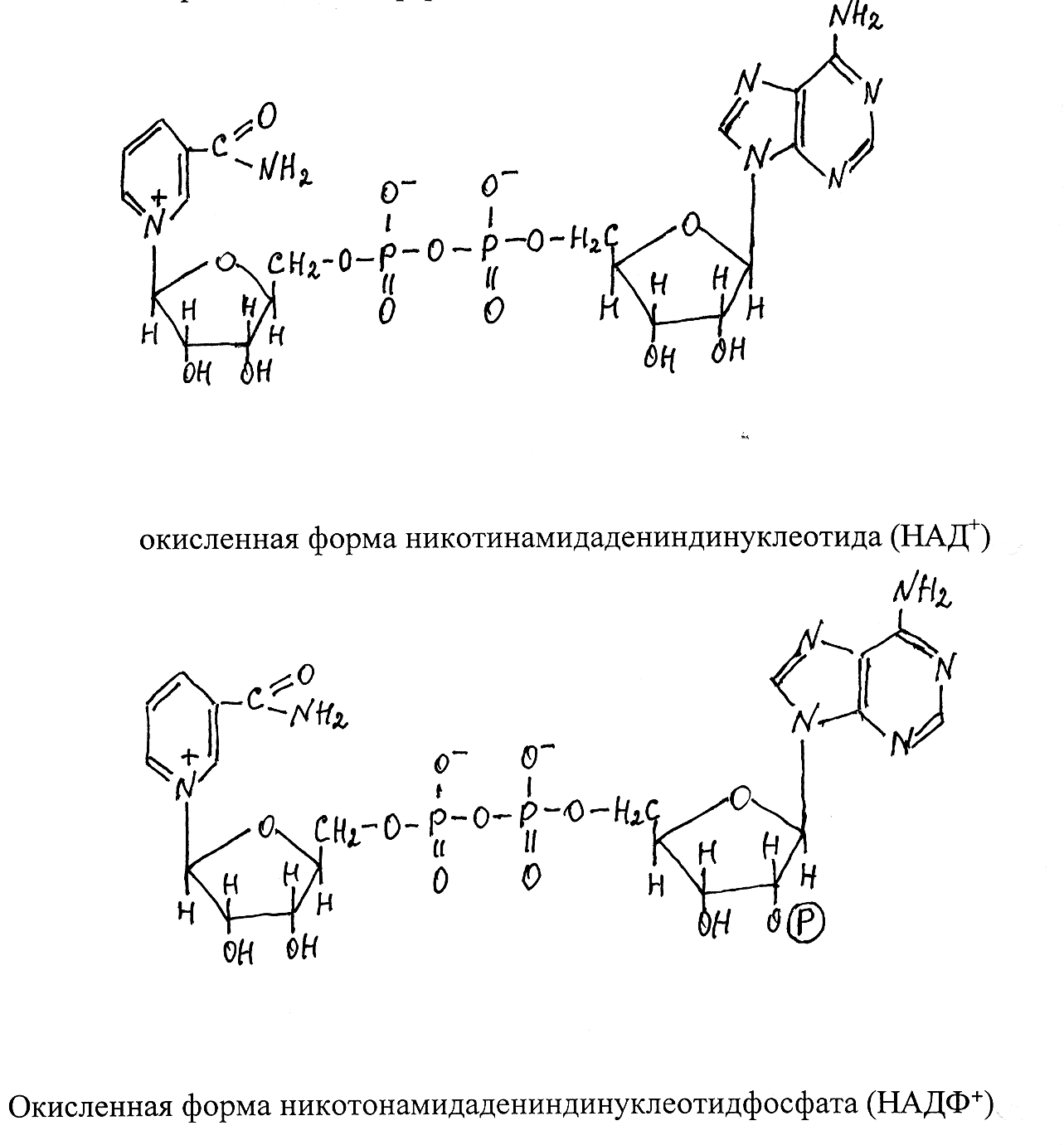
Молекулы кофермента НАД образуются из витамина РР (амид нико-тиновой кислоты) и нуклеотида АМФ (аденозинмонофосфат), соединён-ных через остатки ортофосфорной кислоты и по химическому строению представляют собой динуклеотиды. НАДФ отличается от НАД только на-личием дополнительной фосфатной группировки, присоединённой ко вто-рому атому углерода рибозы в составе АМФ.
Ф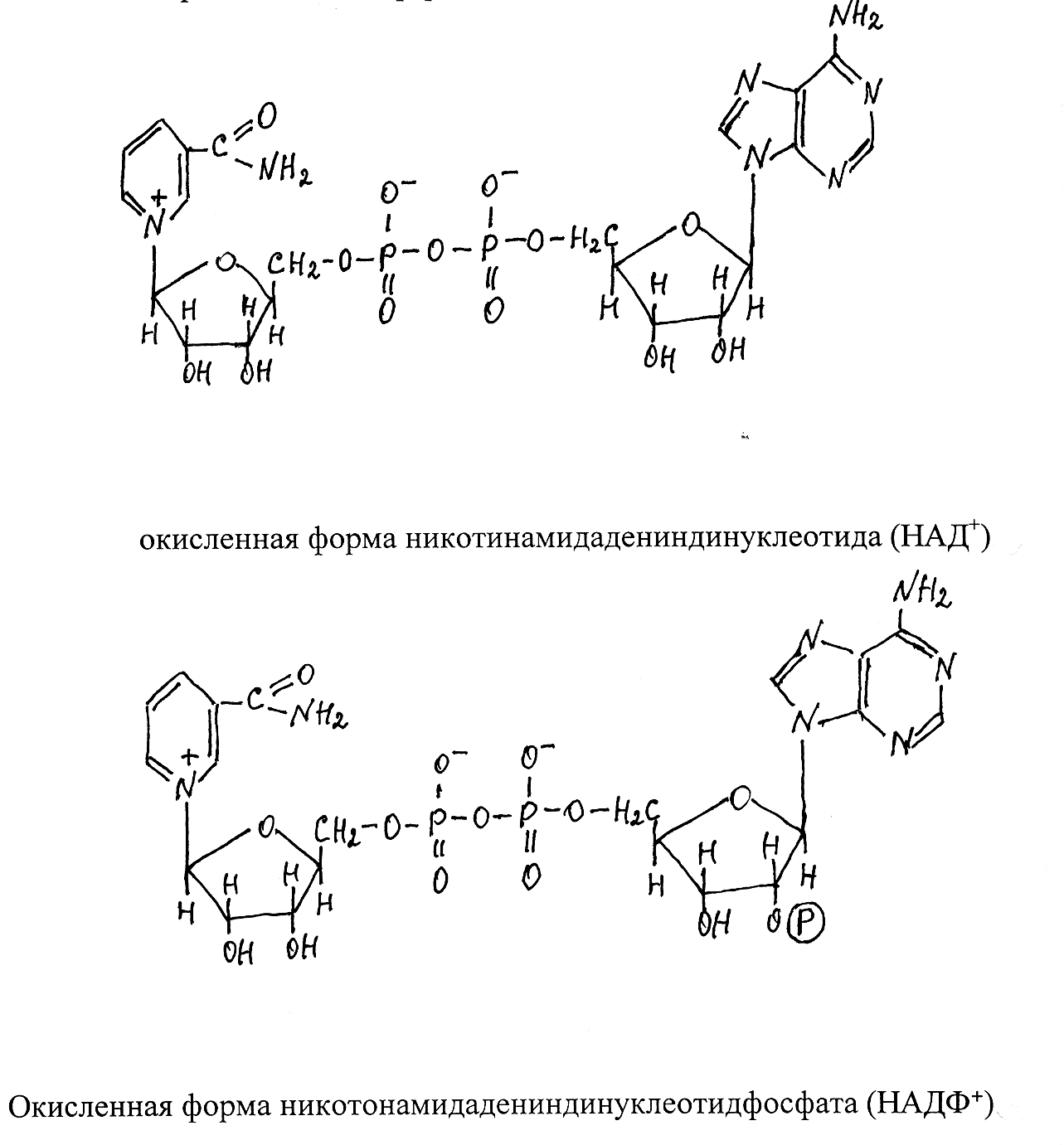 ерменты,
имеющие в своём составе НАД и
НАДФ, катализируют реакции отщепления
водорода от восстановленных субстратов
и перенос их на соответствующий акцептор.
Очень часто таким акцептором служит
окисленный флавиновый кофермент.
ерменты,
имеющие в своём составе НАД и
НАДФ, катализируют реакции отщепления
водорода от восстановленных субстратов
и перенос их на соответствующий акцептор.
Очень часто таким акцептором служит
окисленный флавиновый кофермент.
 окисленная
форма никотинамидадениндинуклеотида
(НАД⁺)
окисленная
форма никотинамидадениндинуклеотида
(НАД⁺)
окисленная форма никотинамидадениндинуклеотидфосфата (НАДФ⁺)
Активной группировкой, участвующей в отщеплении и переносе водорода, служит окисленная форма никотинамида. От субстрата отщепля-ются два атома водорода в виде двух электронов и двух протонов, при
этом один электрон и протон взаимодействуют с четвёртым углеродным атомом, а второй электрон с атомом азота никотинамида в составе фер-мента, переводя его в восстановленную форму, тогда как второй протон не связывается с коферментом и в дальнейшем непосредственно переходит на акцептор, с которым взаимодействует восстановленный кофермент. Окис-ленную форму НАД принято сокращённо записывать в виде НАД+, а вос-становленную – НАД × Н. Соответственно окисленная форма НАДФ записывается НАДФ+, восстановленная – НАДФ × Н.
 окисленная
форма восстановленная форма
окисленная
форма восстановленная форма
НАД(Ф) НАД(Ф)
Поскольку в реакциях, катализируемых НАД- и НАДФ-содержа-щими ферментами, происходит отщепление водорода от субстратов, такие ферменты называют дегидрогеназами. Схематически действие дегидроге-назы, имеющей кофермент НАД, можно представить следующим образом:
Субстрат−Н₂ + НАД+–фермент ¾® Субстратокисл. + Фермент–НАД × Н + Н+
Фермент–НАД × Н + Н+ + Акцептор ¾® НАД+–фермент + Акцептор–Н₂
НАД и НАДФ очень легко отделяются от ферментного белка и могут существовать в свободной форме, диффундируя от одного фермента к дру-гому. Свободные формы этих коферментов могут также переноситься по флоэмной системе растений от донорных клеток и органов к акцепторным.
НАД-зависимые ферменты наиболее активны в ускорении реакций, связанных с отщеплением водорода от субстратов, а ферменты, имеющие восстановленные коферменты НАДФ, чаще всего используются как силь-ные восстановители.
Ферменты, катализирующие перенос ацильных групп (R–C–), имеют ||
О
в каталитическом центре активную группировку, называемую кофермен-том А (КоА), которая связана с апоферментом лабильными (нековалент-ными) связями и поэтому может легко отделяться от фермента.
В составе кофермента А содержится остаток b-меркаптоэтиламина с реакционно-способной HS–группой, соединённой амидной связью с кар-боксильной группой пантотеновой кислоты, которая фосфорилирована по концевой гидроксильной группе. Через остаток ортофосфорной кислоты указанная группировка соединяется с неклеотидной частью, представлен-ной аденозинмонофосфатом (АМФ), у которого гидроксил при третьем углеродном атоме рибозы этирифицирован дополнительным фосфатным остатком.
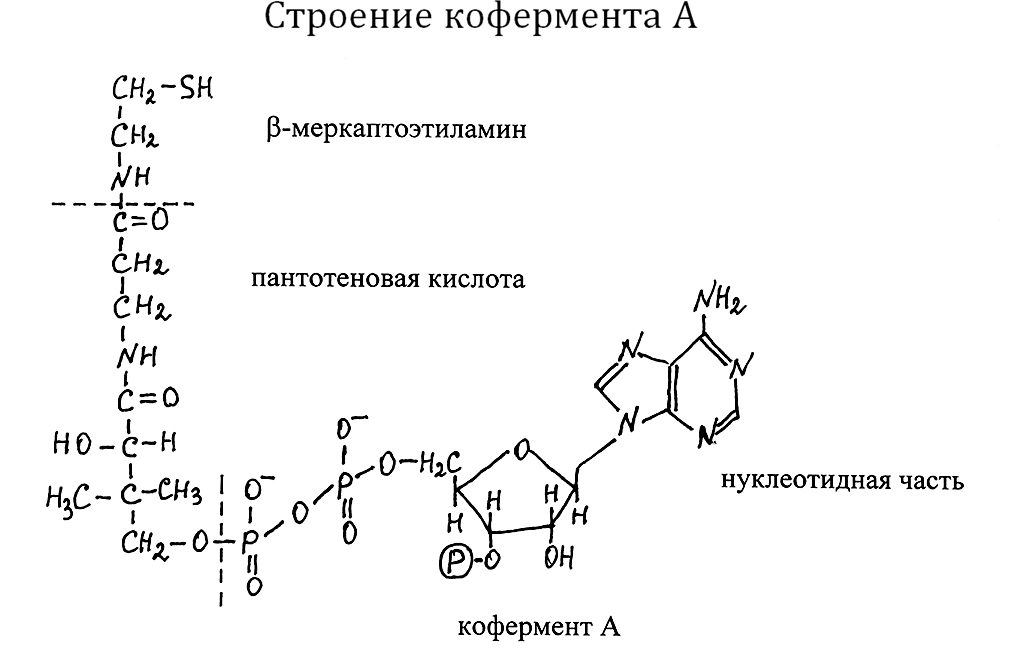
Соединение кофермента А с белковой молекулой происходит путём образования водородных связей и возникающих электростатических взаи-модействий между аминокислотными радикалами белка в активном центре фермента и группировками нуклеотидной части и пантотеновой кислоты кофермента.
В ходе ферментативной реакции кофермент А взаимодействует с субстратом за счёт HS–группы b-меркаптоэтиламина, находящейся на конце довольно длинной гибкой цепи, которая хорошо приспособлена к созданию структурного соответствия между активным центром фермента и субстратом. В уравнениях реакций принято использовать сокращённое обозначение кофермента А – HS–КоА. Образование ацильных производ-ных кофермента А сопряжено с гидролизом АТФ:
R–COOH + HS–KoA + АТФ ¾® R–C~S–KoA + AMФ + H4P2O7
||
O
При этом между углеродом карбонильной группы карбоновой кис-лоты и атомом серы кофермента возникает макроэргическая тиоэфирная связь. Активированный таким образом ацильный радикал может далее переноситься к центрам синтеза или b-окисления жирных кислот, где он уже соединяется с новым апоферментом и подвергается дальнейшим прев-ращениям.
В форме ацетилкофермента А (СН3−С~S–КоА) этот кофермент ||
О
включается в реакции цикла ди- и трикарбоновых кислот, а также глиок-силатного цикла и участвует в целом ряде других превращений.
Коферментной формой витамина В₁ является фосфорилированное производное тиамина – тиаминпирофосфат, которое пиримидиновым кольцом соединяется с белковой частью фермента, а тиазоловой группи-ровкой взаимодействует с субстатами – a-кетокислотами или a-кетоспир-тами (см. с. 130). В ходе ферментативной реакции осуществляется a-рас-щепление указанных субстратов, в результате чего происходит декарбок-силирование a-кетокислот или альдольное расщепление a-кетоспиртов.
В составе многих ферментов, катализирующих превращения амино-кислот и аминов, в качестве кофермента используется производное вита-мина В6 пиридоксальфосфат. Этот кофермент может оказывать каталити-ческое действие как в составе фермента, так и в свободном виде. Однако под воздействием белка, образующего фермент, значительно возрастает скорость реакции и специфичность действия катализатора. Активной частью кофермента является альдегидная группа, которая обратимо реаги-рует с аминокислотами (см. раздел 3.3.1).
