
- •Циклова комісія монтажних дисциплін Курс лекцій по теоретичним основам холодильної техніки
- •Лекція 1 вступ
- •1.1 Значення курсу “теоретичні основи холодильної техніки”
- •1.2 Короткий історичний огляд
- •1.3 Призначення холодильних установок
- •1.4 Промислові технології із застосуванням холоду
- •1.5 Класифікація холодильних установок
- •Питання для самоконтролю
- •Лекція 2 термодинаміка, як загальне вчення про енергетику
- •2.1 Фізичні основи одержання холоду
- •2.2 Термодинаміка, як загальне вчення про енергетику
- •2.3 Енергія, теплота, робота
- •2.4 Закон збереження енергії
- •2.5 Параметри стану
- •2.5 Рівняння стану
- •Питання для самоконтролю
- •Лекція 3 калоричні параметри стану
- •3.1 Рівноважний термодинамічний стан і рівноважні процеси
- •3.2 Зворотні і незворотні процеси
- •3.3 Кругові процеси Калоричні параметри стану: внутрішня енергія, ентальпія, ентропія
- •3.5 Робота й теплота процесу
- •Питання для самоконтролю
- •Лекція 4. Другий закон термодинаміки. Цикл карно
- •4.1 Другий початок термодинаміки
- •4.2 Цикл Карно
- •Питання для самоконтролю
- •Лекція 5 способи одержання низьких температур
- •5.1 Охолодження при фазових перетвореннях речовин
- •5.2 Охолодження шляхом розширення газів.
- •5.3 Термоелектричний метод
- •5.4 Холодильні установки з вихровою трубкою.
- •5.5 Способи охолодження камер
- •Питання для самоконтролю
- •Питання для самоконтролю
- •Лекція 7 холодоагенти
- •7.1 Основні визначення, короткий історичний огляд, позначення й торговельні марки
- •7.2 Критерії вибору і вимоги до холодоагенту
- •7.3 Холодильні агенти і охорона навколишнього середовища
- •7.4 Альтернативні однокомпонентні холодоагенти
- •7.5 Альтернативні багатокомпонентні холодоагенти групи гфв
- •7.6 Альтернативні багатокомпонентні холодоагенти групи гхфв
- •7.7 Який же холодоагент значніший ?
- •7.8 Особливості термодинаміки сумішей холодоагентів.
- •Лекція 8. Холодоносії
- •8.1 Призначення холодоносіїв та вимоги до них
- •8.2 Характеристика холодоносіїв
- •9.1 Вимоги до мастил
- •9.2 Типи мастил та їх характеристики
- •9.3 Циркуляція мастила у холодильній установці
- •Лекція 10 розширювальні та нагнітальні машини холодильних установок
- •10.1 Призначення та класифікація розширювальних та нагнітальних машин
- •10.2 Термодинамічні основи процесів стиску та розширювання.
- •10.3 Поршневі детандери
- •10.4 Процеси стиску у компресорі
- •10.5 Холодопродуктивність компресора
- •10.6 Потужність компресора й енергетичні втрати
- •11.7 Область застосування компресорів
- •Лекція 11 основи теорії компресійних холодильних машин.
- •11.1 Ідеальна парова компресійна холодильна машина
- •11.2 Дійсний цикл парової холодильної машини.
- •11.3 Побудова холодильного циклу
- •Питання для самоконтрою
- •Лекція 12 ексергетичний метод аналізу ефективності холодильних систем
- •12.1 Властивості оборотних і необоротних циклів. Математичне вираження другого закону термодинаміки
- •7.2 Максимальна робота. Ексергія.
- •7.3 Ексергетичний баланс парокомпресорної холодильної установки
- •Питання для самоконтролю
- •Лекція 13 основи теорії газових холодильних машин.
- •13.1 Повітряна холодильна машина
- •13.2 Холодильна машина Стірлінга
- •Питання для самоконтрою
- •Лекція 14 Цикли багатоступінчатих холодильних машин
- •14.1 Причини переходу до багатоступінчастого стиску.
- •14.2 Вибір проміжного тиску.
- •14.3 Двоступінчаста холодильна машина зі змійовиковою проміжною посудиною й неповним проміжним охолодженням.
- •14.4 Двоступінчаста холодильна машина зі змієвиковою проміжною посудиною й повним проміжним охолодженням.
- •14.5 Двоступінчаста холодильна машина з теплообмінниками.
- •Питання для самоконтрою
- •Лекція 15 цикли каскадних холодильних машин
- •15.1 Найпростіша каскадна холодильна машина.
- •15.2 Реальна каскадна холодильна машина.
- •Питання для самоконтролю
- •Лекция 16 абсорбційні та пароежекторні холодильні установки
- •16.1 Принцип дії абсорбційної холодильної установки.
- •16.2 Цикл пароежекторної холодильної установки
- •Питання для самоконтролю
- •Лекція 17 теплові насоси
- •17.1 Компресія низкопотенційного природного тепла
- •17.2 Схема і принцип дії теплового насосу
- •17.3 Розрахунок тепонасосної установки
- •17.4 Двоступінчасті тепло насосні установки
- •17.5 Геотермальні теплові насоси
- •17.6 Екологічні аспекти впровадження теплових насосів
- •Питання для самоконтролю
- •Лекція 18 Енергозбереження при виробництві холоду
- •18.1 Стратегія енергозбереження
- •18.2 Законодавство України про енергозбереження.
- •18.3 Основні принципи енергозбереження
- •18.4 Вплив компонентів системи на ефективність
- •18.5 Сучасні енергозберігаючі технології компанії Данфосс
- •18.6 Застосування теплових насосів в Украъні
- •Використана література
Питання для самоконтролю
1. Зобразити Р-t діаграму фазових переходів.
2. Як використати процес плавлення для охолодження речовин?
3. Назвіть способи одержання пари.
4. Що таке теплота пароутворення?
5. Від чого залежить температура насичення?
6. Як використовується процес сублімації для охолодження речовин?
7. У чому полягає суть ефекту Пельтьє?
8. Який принцип роботи вихрової трубки?
9. Як здійснюється процес дроселювання?
ЛЕКЦІЯ 6. ТЕРМОДИНАМІЧНІ ДІАГРАМИ
Експлуатація холодильної установки неможлива без порозуміння термодинамічних процесів, що відбуваються в ній. Вивчення окремих процесів, що входять у цикл парової компресійної машини, а також зв'язків між ними, їхнього впливу один на оден, може бути значно спрощене, при використанні термодинамічних діаграм холодильних агентів. Уміння користуватися діаграмами необхідно також для контролю й аналізу параметрів діючих холодильних установок; настроювання приладів автоматичного контролю й регулювання; розрахунку й підбору холодильного устаткування при реконструкції й розширенні діючих установок.
Для кожного холодильного агента існують свої діаграми, які наведені в додатках, але принцип їхньої побудови й користування ними однаковий.
Штучне охолодження в парових холодильних машинах засновано на процесі кипіння холодильних агентів при низьких температурах, у результаті чого вони переходять із рідкого стану в пару, поглинаючи певну кількість теплоти. Щоб процес штучного охолодження був замкнутий та повторювався, пара холодильного агента стискається, а потім конденсується шляхом охолодження. Таким чином, у холодильній машині відбуваються два процеси фазового переходу холодоагенту: з рідини – в пару та з пари – в рідину. Ці два процеси й відображені на всіх діаграмах.
Ми вже познайомилися з діаграмами Pv (тиск – питомий об‘єм) та Ts (температура – ентропія), які дозволяють графічно визначати роботу й кількість тепла в термодинамічному процесі шляхом виміру площ. Холодильщикам користуватися цими діаграмами не завжди зручно: по перше, вони дають значення тільки роботи, або тільки теплоти; по друге, щоб визначити ці значення, необхідно вимірювати площі. Тому, холодильщики віддають перевагу ентальпійній діаграмі (тиск – ентальпія), яка дозволяє безпосередньо визначати кількість тепла й роботи, що беруть участь у виробництві холоду. Для зручності зображення й користування діаграмою lgP-i тиск відкладений по логарифмічній шкалі.


 К P
= const
К P
= const

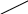 T v
= const
T v
= const
P = const i = const
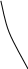 t
= const P
=const t = const
t
= const P
=const t = const
t = const

переохо- волога перегріта пара
лоджена насичена
рідина пара
i = const v = const
x = 0 x = 1
x = const

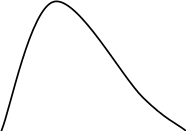
Рис.6.1 Тs – діаграма. S
 K
K




 lgP
i
= const
lgP
i
= const
t = const s = const

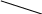
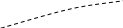 P
= const
P
= const

 переохолоджена t
= const v
= const
переохолоджена t
= const v
= const
рідина
P = const волога насичена перегріта пара
пара
 Х=
0 X
= const
X
= 1
Х=
0 X
= const
X
= 1
t = const
Рис.6.2 lgP-I – діаграма. і
Для порівняння розглянемо діаграми Тs (Рис.6.1) і lgP-i (Рис.6.2).
На діаграмах показані області різного стану робочого тіла та наведені значення параметрів стану: тиску, Р (мПа); температури, t (0С); питомого об’єму, v (м3/кг); ентропії, s (кДж/кг К); ентальпії, I (кДж/кг).
Критична точка К діаграми характеризує такий стан, вище якого тіло може бути тільки в стані газу. Нижче критичної точки тіло може перебувати одночасно у двох станах: рідкому й пароподібному, а при певних параметрах – у трьох станах: твердому, рідкому й пароподібному (потрійна точка). Нижче потрійної точки тіло може перебувати одночасно тільки у двох станах: твердому й пароподібному.
Для більшості холодильних агентів критична точка характеризується високою температурою й тиском, а потрійна точка – дуже низькою температурою й тиском, наприклад фреон-12 має tкр =111,5 0С, а tтр = - 155°С.
Для таких холодильних агентів діаграма викреслюється тільки для того інтервалу температур, у якому використовується холодильний агент.
Вуглекислий газ (С02) має низьку критичну точку (tкр= 31 °С) та високу потрійну точку ( Pтр = 0,515 мПа , tтр = - 56,6°С), й діаграма для цієї речовини викреслюється повністю.
На діаграмах лінії, що відходять від критичної точки К, є граничними кривими, що розділяють діаграму на окремі області. Ліва гранична крива розділяє області переохолодженої рідини та насиченого вологого пару. Точки, що лежать на ній, характеризують стан насиченої рідини. Права гранична крива розділяє області вологої насиченої пари й пари перегрітої. Точки, що лежать на правій граничній кривій характеризують стан насиченої сухої пари.
Зміст (частку) пари в суміші пари та рідини відображають лінії постійного паровмісту – X. Вони показують масову частку пари в суміші пари та рідини.
Перетворення рідини в пару (або пари в рідину) при незмінному тиску протікає без зміни температури, тому в діаграмах лінії постійних тисків в області вологої пари збігаються з лініями постійних температур.
Лінії постійних тисків — ізобари (р = соnst) — у діаграмі lgР-і зображуються горизонтальними прямими, паралельними вісі абсцис, а в діаграмі Т-s — ламаними лініями. В області вологого пару Т-s – діаграми лінії тисків зображуються горизонтальними прямими, що збігаються з лініями постійних температур, в області перегрітого пару це висхідні криві лінії, (на діаграмі суцільні криві), в області рідини – спадаючі криві, які практично збігаються з лівою граничною кривою, та тільки поблизу до критичної точки ізобари, проходять на деякій відстані від неї. Тому в Тs – діаграмі, лінії тиску в області рідини не наносяться, ця область практично зливається з лівою граничною кривою.
Лінії постійних температур — ізотерми (t = соnst) – в Тs – діаграмі зображуються горизонтальними прямими, паралельними осі абсцис, а в lgР-i діаграмі – ламаними лініями (штрихпунктирними). В області вологої пари lgР-i - діаграми – це прямі, що збігаються з ізобарами, в області перегрітої пари – круто падаючі криві, а в області рідини – криві, що круто піднімаються. Значення температури в діаграмах дано по шкалі Цельсія.
Лінії постійних питомих об’ємів – ізохори (v = соnst) в обох діаграмах зображуються пунктирними лініями, що мають злам на правій пограничній кривій. Поблизу лівої пограничної кривої й в області рідини лінії постійних об’ємів не нанесені, тому що питомий об’єм рідини настільки малий у порівнянні з об’ємом пару.(у десятки й сотні разів), що в масштабі діаграм показати його неможливо. Тому значення питомих об’ємів для рідини можна визначити тільки по таблицях насичених парів для відповідних холодильних агентів.
Лінії постійних ентропій – адіабати (s = соnst) – у діаграмі Т-s зображуються вертикальними прямими, паралельними осі ординат, а в діаграмі lgР-i — похилими кривими лініями (на діаграмі суцільні лінії).
Лінії постійних ентальпій (ізоентальпій) і = соnst у діаграмі lgP-і зображуються вертикальними прямими, паралельними осі ординат, а в діаграмі Т-s – це криві лінії, що мають різний нахил. Для перегрітої пари – це пологі криві, а для рідини – більш круті.
Параметри точок, що лежать на пограничних кривих, можуть бути визначені як по діаграмах, так і по таблицях насичених пар холодильних агентів (відповідно температурі або тиску насичення), а параметри точок, що лежать в області перегрітої пари, можуть бути визначені також по таблицях перегрітих пар.
Абсолютні значення калоричних параметрів стану (ентропії й ентальпії) у розрахунках не використовують. Характерним є тільки зміна цих параметрів у процесах. Тому ентропію й ентальпію відраховують від умовного початку, що відповідає стану насиченої рідини при 0 °С. У літературі зустрічаються таблиці й діаграми з іншим початком відліку ентропії й ентальпії. Це необхідно пам'ятати при використанні діаграм і таблиць із різних джерел.
Калоричні параметри зручні при наочному графічному зображенні й для теплових розрахунків. Так, змінення ентропії робочого тіла ds = dq/T – показує напрямок теплоти в процесі. Зростання ентропії характеризує підведення тепла до робочого тіла в даному процесі, убування ентропії – відвід тепла, а постійність ентропії – характеризує адіабатичний процес, що протікає без підводу й відводу тепла ззовні. Зростання ентропії в реальних процесах (процесах теплообміну) є мірою необоротності процесів.
В Тs – діаграмі площа під процесом, спроектованим на вісь абсцис, виражає кількість підведеного або відведеного тепла або роботу в цьому процесі Tds =dq.
У lgP-і – діаграмі тепло або роботу можна виразити відрізком на осі абсцис, що відповідає різниці ентальпій на межах даного процесу.
У процесах постійного тиску P = соnst кількість підведеного або відведеного тепла можна виразити різницею ентальпій кінця і початку процесу:
![]()
У процесах адіабатичного стиску, або розширення, робота машини може бути виражена також різницею ентальпій на межах процесу
![]()
У процесі дроселювання ентальпія не змінюється. В lgP-i - діаграмі цей процес зображується вертикальною прямою, а в Тs -діаграмі — кривою лінією.
