
- •Циклова комісія монтажних дисциплін Курс лекцій по теоретичним основам холодильної техніки
- •Лекція 1 вступ
- •1.1 Значення курсу “теоретичні основи холодильної техніки”
- •1.2 Короткий історичний огляд
- •1.3 Призначення холодильних установок
- •1.4 Промислові технології із застосуванням холоду
- •1.5 Класифікація холодильних установок
- •Питання для самоконтролю
- •Лекція 2 термодинаміка, як загальне вчення про енергетику
- •2.1 Фізичні основи одержання холоду
- •2.2 Термодинаміка, як загальне вчення про енергетику
- •2.3 Енергія, теплота, робота
- •2.4 Закон збереження енергії
- •2.5 Параметри стану
- •2.5 Рівняння стану
- •Питання для самоконтролю
- •Лекція 3 калоричні параметри стану
- •3.1 Рівноважний термодинамічний стан і рівноважні процеси
- •3.2 Зворотні і незворотні процеси
- •3.3 Кругові процеси Калоричні параметри стану: внутрішня енергія, ентальпія, ентропія
- •3.5 Робота й теплота процесу
- •Питання для самоконтролю
- •Лекція 4. Другий закон термодинаміки. Цикл карно
- •4.1 Другий початок термодинаміки
- •4.2 Цикл Карно
- •Питання для самоконтролю
- •Лекція 5 способи одержання низьких температур
- •5.1 Охолодження при фазових перетвореннях речовин
- •5.2 Охолодження шляхом розширення газів.
- •5.3 Термоелектричний метод
- •5.4 Холодильні установки з вихровою трубкою.
- •5.5 Способи охолодження камер
- •Питання для самоконтролю
- •Питання для самоконтролю
- •Лекція 7 холодоагенти
- •7.1 Основні визначення, короткий історичний огляд, позначення й торговельні марки
- •7.2 Критерії вибору і вимоги до холодоагенту
- •7.3 Холодильні агенти і охорона навколишнього середовища
- •7.4 Альтернативні однокомпонентні холодоагенти
- •7.5 Альтернативні багатокомпонентні холодоагенти групи гфв
- •7.6 Альтернативні багатокомпонентні холодоагенти групи гхфв
- •7.7 Який же холодоагент значніший ?
- •7.8 Особливості термодинаміки сумішей холодоагентів.
- •Лекція 8. Холодоносії
- •8.1 Призначення холодоносіїв та вимоги до них
- •8.2 Характеристика холодоносіїв
- •9.1 Вимоги до мастил
- •9.2 Типи мастил та їх характеристики
- •9.3 Циркуляція мастила у холодильній установці
- •Лекція 10 розширювальні та нагнітальні машини холодильних установок
- •10.1 Призначення та класифікація розширювальних та нагнітальних машин
- •10.2 Термодинамічні основи процесів стиску та розширювання.
- •10.3 Поршневі детандери
- •10.4 Процеси стиску у компресорі
- •10.5 Холодопродуктивність компресора
- •10.6 Потужність компресора й енергетичні втрати
- •11.7 Область застосування компресорів
- •Лекція 11 основи теорії компресійних холодильних машин.
- •11.1 Ідеальна парова компресійна холодильна машина
- •11.2 Дійсний цикл парової холодильної машини.
- •11.3 Побудова холодильного циклу
- •Питання для самоконтрою
- •Лекція 12 ексергетичний метод аналізу ефективності холодильних систем
- •12.1 Властивості оборотних і необоротних циклів. Математичне вираження другого закону термодинаміки
- •7.2 Максимальна робота. Ексергія.
- •7.3 Ексергетичний баланс парокомпресорної холодильної установки
- •Питання для самоконтролю
- •Лекція 13 основи теорії газових холодильних машин.
- •13.1 Повітряна холодильна машина
- •13.2 Холодильна машина Стірлінга
- •Питання для самоконтрою
- •Лекція 14 Цикли багатоступінчатих холодильних машин
- •14.1 Причини переходу до багатоступінчастого стиску.
- •14.2 Вибір проміжного тиску.
- •14.3 Двоступінчаста холодильна машина зі змійовиковою проміжною посудиною й неповним проміжним охолодженням.
- •14.4 Двоступінчаста холодильна машина зі змієвиковою проміжною посудиною й повним проміжним охолодженням.
- •14.5 Двоступінчаста холодильна машина з теплообмінниками.
- •Питання для самоконтрою
- •Лекція 15 цикли каскадних холодильних машин
- •15.1 Найпростіша каскадна холодильна машина.
- •15.2 Реальна каскадна холодильна машина.
- •Питання для самоконтролю
- •Лекция 16 абсорбційні та пароежекторні холодильні установки
- •16.1 Принцип дії абсорбційної холодильної установки.
- •16.2 Цикл пароежекторної холодильної установки
- •Питання для самоконтролю
- •Лекція 17 теплові насоси
- •17.1 Компресія низкопотенційного природного тепла
- •17.2 Схема і принцип дії теплового насосу
- •17.3 Розрахунок тепонасосної установки
- •17.4 Двоступінчасті тепло насосні установки
- •17.5 Геотермальні теплові насоси
- •17.6 Екологічні аспекти впровадження теплових насосів
- •Питання для самоконтролю
- •Лекція 18 Енергозбереження при виробництві холоду
- •18.1 Стратегія енергозбереження
- •18.2 Законодавство України про енергозбереження.
- •18.3 Основні принципи енергозбереження
- •18.4 Вплив компонентів системи на ефективність
- •18.5 Сучасні енергозберігаючі технології компанії Данфосс
- •18.6 Застосування теплових насосів в Украъні
- •Використана література
2.5 Параметри стану
Перетворення теплоти в роботу (теплові двигуни) або роботи в теплоту (установки, що виробляють холод) здійснюється в термоди- намічному процесі за допомогою певного пружного тіла, що називається робочим тілом (холодоагентом). Сукупність робочих тіл, що обмі- нюються енергією як одне з одним, так і з навколишніми матеріальними тілами, називається термодинамічною системою.
За певних умов, будь-яку галузь науки можна розглядати як сукупність зв’язаних між собою визначень, що описують ті системи, які вивчає дана галузь. Слово “система” походить від грецького слова, що буквально означає “ціле, складене із частин”. Воно має багато значень, що залежать від контексту. У нашому викладі, термін система відноситься до тієї частини реального світу, яку ми вивчаємо. Це може бути посудина з газом, хмара, машина, рослина або планета. Часто система визначається за допомогою її межі – уявлюваної оболонки, якій може бути приписана будь-яка бажана властивість. Вона може бути абсолютно твердою або абсолютно пружною, непроникною або проникною для речовини, повністю теплоізолюючою або ідеально проводити тепло. Межа не є матеріальною, тобто нічого не додає в масу речовини системи й навколишнього середовища. Часто зручно ототожнювати межу із замкнутою геометричною поверхнею, з одного боку якої перебуває система, а з іншого – інша частина реального світу, тобто середовище. На плоскому рисунку така гранична поверхня звичайно зображується простою замкнутою кривою довільної форми.
Термодинаміка вивчає макроскопічні системи, просторові розміри і час існування яких достатні для проведення нормальних процесів виміру, тобто маємо справу з динамічними системами, що володіють надзвичайно великим числом ступенів свободи. Системи з малим числом ступенів свободи термодинамікою не розглядаються.
Для того, щоб визначити конкретні фізичні умови, за яких ми розглядаємо речовину (робоче тіло), і тим самим однозначно визначити стан даної речовини, що особливо важливо в холодильній технології, де робоче тіло може бути в різних агрегатних станах, уведені зручні характеристики – так звані параметри стану.
Параметри – це просто числа, одержувані за допомогою відповід- них вимірювальних операцій. Значення цих параметрів визначають умови, у яких перебуває система, або, що теж саме, задають стан системи. Вони відображають тільки той стан системи, що існує в цей момент і нічого не говорять ні про минуле, ні про майбутнє системи.
Припустимо, що ви опустили термометр у посудину з гарячою водою на кухонній плиті о 10 годині ранку в понеділок, і нехай термо- метр показав 22 0С. Показання термометра о тій же порі у вівторок дорівнювало 27 0С. У цьому випадку, ми можемо сказати тільки те, що температура зросла на 5 0С. Ґрунтуючись тільки на показаннях термометра, неможливо описати, що саме відбувалося з водою за минулу добу: можливо, вона нагрівалася до кипіння, потім остигала, замерзала, а лід, що вийшов, плавився й знову нагрівалася рідина; однак, можливо, що вода всього лише злегка нагрілася. Це значить, що зміна температури має ту саму величину незалежно від того, яким шляхом – точніше, у результаті послідовності яких станів – вона досягається. Математично це означає, що при будь-якому способі інтегрування по даному інтервалі завжди виходить лише один єдиний, однозначний результат. Для температури це твердження можна записати в наступному виді:
![]() , (2.5)
де
, (2.5)
де
![]() означає суму нескінченно малих збільшень
температури у інтервалі від Т1
до Т2.
означає суму нескінченно малих збільшень
температури у інтервалі від Т1
до Т2.
Отже, характерною ознакою параметра стану є те, що він є функцією стану і його значення не залежить від способу одержання цього значення.
Основними (незалежними) інтенсивними параметрами стану є абсолютна температура Т, абсолютний тиск Р і питомий об’єм v, через які можуть бути виражені всі інші параметри. Ці параметри можуть бути легко визначені простими технічними засібами.
Величини, обумовлені однозначним завданням цих параметрів, називаються функціями стану. Сукупність таких беззупинно мінливих станів робочого тіла називають термодинамічним процесом.
Розглянемо основні параметри стану.
Одним з найважливіших параметрів, що визначає тепловий стан тіла, є абсолютна температура
Т 0К = t 0С + 273,15
Відповідно до молекулярно-кінетичної теорії газів абсолютну температуру можна визначити як величину, пропорційну середній кінетичній енергії поступального руху молекул
kТ =
![]() , (2.6)
де k – константа Больцмана.
, (2.6)
де k – константа Больцмана.
Із цього визначення виходить, що абсолютна температура завжди позитивна. При температурі абсолютного нуля тепловий рух молекул припиняється. Безпосередньо виміряти кінетичну енергію руху молекул практично неможливо. Тому, для вимірів температури використовують залежність від температури якої-небудь з властивостей речовини: здатність тіла розширюватися при нагріванні, електроопір, величину електрорушійної сили в місці сполуки двох різнорідних металів, інтенсивність випромінювання й ін.
Для виміру температури найпоширеніші рідинні термометри, термопари, термометри опору й оптичні пірометри.
Одна з істотних рис науки полягає в тому, що вона дає кількісний опис процесів та явищ. Щоб стати предметом наукового дослідження, будь-які явища, у тому числі й теплові, повинні бути описані за допомогою числових величин. Тому розглянемо більш докладно поняття температури й початку термометрії - мистецтва вимірювати ступінь нагрітості й виражати її за допомогою чисел [13].
П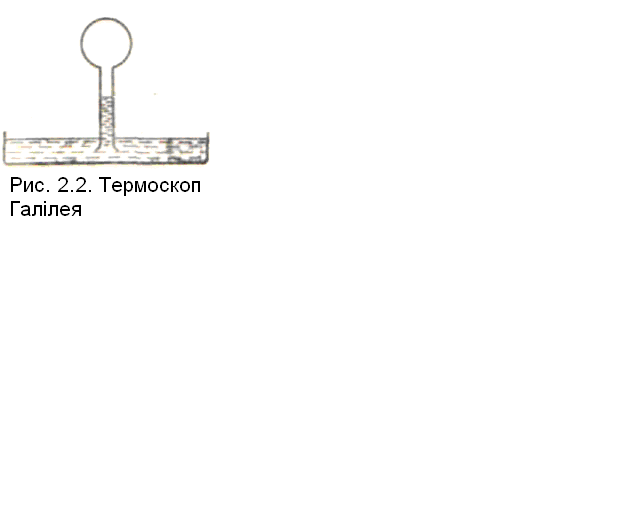 ерший
зафіксований крок, що відносять до 1597
року, у розвитку числової температурної
шкали пов’язаний з термоскопом Галілея,
який схематично представлений на рисунку
2.4. Коли верхня частина посудини стикалася
з теплим тілом, повітря розширювалося
та витіскало рідину вниз. Зміна
висоти стовпа рідини вказує на зміну
температури колби.
ерший
зафіксований крок, що відносять до 1597
року, у розвитку числової температурної
шкали пов’язаний з термоскопом Галілея,
який схематично представлений на рисунку
2.4. Коли верхня частина посудини стикалася
з теплим тілом, повітря розширювалося
та витіскало рідину вниз. Зміна
висоти стовпа рідини вказує на зміну
температури колби.
Прилад Галілея міг показувати зміну температури, але не дуже підходив для її виміру, тому що висота рідини в трубці залежить від атмосферного тиску. При одній і тієї ж температурі показання такого Рис.2.4. Термоскоп приладу на вершині гори відрізняється від Галілея показань у її основи. Тому, такий прилад назвали
термоскопом, а не термометром, для створення якого необхідно мати температурну шкалу із ціною одного розподілу та наявність реперних точок, у яких фіксований параметр не змінюється в плині тривалого проміжку часу.
Вибір реперних точок та температурних шкал має цікаву історію.
У 1701 році Ісаак Ньютон запропонував у якості нижньої фіксованої точки відліку взяти точку замерзання води й приписати їй нульове значення, а в якості верхньої такої точки - температуру “здорової людини”, приписавши їй значення 12.
У 1724 році німецький фізик Габріель Даніель Фаренгейт, що займався виготовленням приладів, запропонував прийняти за нульову точку нижчу температуру суміші рівних частин льоду, повареної солі й нашатирю. На шкалі Фаренгейта, лінійно екстрапольованої по температурі тіла людини, точка кипіння води відповідає градусній оцінці 212, а точка замерзання води - градусній оцінці 32. Таким чином, один градус шкали Фаренгейта дорівнює 1/180 різниці температур кипіння води й танення льоду при атмосферному тиску. У наш час ця температурна шкала широко вживається в англомовних країнах.
У 1730 році французький натураліст Рене Антуан де Реомюр запропонував розділити інтервал між точками замерзання й кипіння води на 80 градусів. Його шкала ще використовується в деяких країнах Європи.
Розподіл інтервалу між точками замерзання й кипіння води на 100 градусів для одержання 100-градусної шкали був запропонований декількома вченими, але асоціюється з ім’ям шведського астронома Андреса Цельсія. З 1954 року за рішенням 10-й Міжнародної конференції по мірах і вагам шкал, у якій нульовий відлік відповідає точці замерзання води, а відлік 100 - точці кипіння води, офіційно названа шкалою Цельсія. Це трохи дивно, тому що на шкалі, що запропонував Цельсій у 1742 році, точка кипіння води дорівнює нулю, а точка замерзання 100.
Найбільш універсальною шкалою температур є абсолютна термодинамічна шкала температур - шкала Кельвіна. Шкала Кельвіна побудована на основі другого закону термодинаміки та не залежить від властивостей речовини, що використовується для виміру температури. У ній використовується єдина експериментальна реперна точка – потрійна точка хімічно чистої води.
Молекули газу, що перебувають у замкнутій посудині та безладно рухаються, співударяються об стінки цієї посудини. Сукупність таких ударів сприймається стінками посудини як деяке безперервно діюче на них зусилля. Величина такого зусилля, що доводиться на одиницю поверхні посудини й діючу по нормалі до неї, називається питомим тиском або просто тиском газу.
Розрізняють абсолютний і надлишковий тиск. Під абсолютним розуміють дійсний тиск робочого тіла усередині посудини, що виміряється в Па ( Н/м2 ) та визначається по формулі
![]() , де (2.7)
n – число молекул в одиниці
об’єму.
, де (2.7)
n – число молекул в одиниці
об’єму.
Під надлишковим, або манометричним, розуміють різницю між абсолютним тиском у посудині й тиском навколишнього середовища. Для виміру різниці тисків служить манометр. Тиск, величина якого менше тиску навколишнього середовища, називають розрідженням або вакуумом.
У зв’язку з тим, що температура й тиск є інтенсивними величинами, і які не залежать від кількості речовини, то однозначний зв’язок між трьома основними параметрами стану може існувати тільки в тому випадку якщо всі вони будуть інтенсивними. Отже, параметром стану є не об’єм, що виміряється пропорційно кількості речовини, а питомий об’єм, тобто об’єм, який займає одиниця маси речовини
![]() , м3/кг,
де
V – об’єм, м3,
m – маса робочого тіла, кг.
, м3/кг,
де
V – об’єм, м3,
m – маса робочого тіла, кг.
