
- •Содержание
- •I. Спектроскопические методы анализа Фотометрический метод анализа сточных и природных вод
- •Сущность фотоколориметрического метода анализа
- •Лабораторная работа № 1 Определение железа в природных водах с сульфосалициловой кислотой
- •Порядок выполнения работы
- •Обработка результатов и оформление работы
- •Лабораторная работа № 2 Определение хрома в сточных водах
- •Лабораторная работа № 3 Определение меди в сточных и природных водах аммиачным методом
- •II. Спектрофотометрия
- •Теоретическая часть
- •Лабораторная работа № 4 Определение остаточного мономера в полимерах, используемых для изготовления контактных линз
- •Порядок выполнения работы
- •1. Назначение органов управления и индикации
- •2. Включение спектрофотометра
- •2.1. Закрыть фотоэлемент, установив рукоятку 49 переключения шторки в положение закр и переключателем 21 установить ширину щели 0,15 нм.
- •2.5. Выключение спектрофотометра производить нажатием кнопки сеть.
- •II. Порядок работы
- •1. Подготовка к измерению
- •1.5. Перед каждым новым измерением, когда неизвестна величина выходного напряжения, следует устанавливать ширину щели 0,15 нм во избежание засвечивания фотоэлементов.
- •1.6. Снимать показания следует при плотно закрытой крышке кюветного отделения.
- •2. Измерение оптической плотности
- •2.1. Установить рукоятку 49 в положение закр.
- •III. Электрохимические методы анализа Ионоселективные электроды и их применение
- •Лабораторная работа № 5
- •Опыт 2. Определение рН вытяжки из почвы
- •Опыт 3. Ионометрическое определение содержания нитрата в вытяжке из почвы (или в водном растворе)
- •1.1. Сорбенты, применяемые в тсх.
- •1.2. Аналитическая тсх
- •1.2.2. Условия проведения эксперимента
- •1.2.3. Материалы и приборы
- •1.2.5. Количественное определение методом тсх
- •1.2.5.1. Полуколичественный анализ
- •1. Корень квадратный из площади пятна анализируемого вещества;
- •2. Lg концентрации анализируемого вещества;
- •3. Опорные точки на калибровочном графике
- •1.3. Распределительная хроматография на бумаге
- •2.2. Лабораторная работа № 7. Разделение железа (III) и меди (II) с помощью хроматографии на бумаге
- •Список литературы
- •Методы и приборы контроля окружающей среды
- •450078, Г. Уфа, ул. Чернышевского, 145; тел. (347) 278-69-85.
Опыт 2. Определение рН вытяжки из почвы
Приготовление водной (или солевой) вытяжки из почвы. В агрохимических и почвенных лабораториях определяют как рН водной вытяжки из почвы (актуальную кислотность), так и рН вытяжки на 1 М растворе хлорида калия (обменную кислотность). Но рН водной вытяжки из почвы - величина неустойчивая, меняющаяся в течение вегетационного периода. Поэтому чаще определяют рН солевой вытяжки (KCl-вытяжки) из почвы, значение которого обычно ниже, чем в водной вытяжке из той же почвы. По рН солевой вытяжки из почвы судят о степени ее кислотности и необходимости известкования. Считают, что при рН 3-4 почва сильнокислая, 4-5 кислая, 5-6 слабокислая, 7 нейтральная, 7-8 слабощелочная, 8-9 щелочная, 9-11 сильнощелочная. Почвы с рН солевой вытяжки меньше 4,5 нуждаются в известковании.
Из средней пробы сырой (непросушенной) почвы возьмите навеску 20 г, взвешивайте в фарфоровой чашке на технохимических весах. Перенесите почву в колбу вместимостью 100-150 мл, прилейте 50 мл дистиллированной воды (или 0,1 М раствора хлорида калия), перемешайте содержимое колбы в течение 10 мин и отфильтруйте. Затем отберите пипеткой в стакан 20 мл прозрачной, бесцветной вытяжки для определения рН.
Ход определения рН вытяжки из почвы аналогичен описанному в опыте 1, используют индикаторный стеклянный электрод и хлорсеребряный электрод сравнения.
Опыт 3. Ионометрическое определение содержания нитрата в вытяжке из почвы (или в водном растворе)
Сначала получают водную вытяжку из почвы, приготовляют серию стандартных растворов нитрата калия для построения градуировочного графика, готовят иономер ЭВ-74 к работе. Находят pNO3 стандартных растворов и строят градуировочный график. Затем измеряют pNO3 почвенной вытяжки и вычисляют содержание нитрат-ионов.
Получение водной вытяжки см. опыт № 2.
Приготовление стандартных растворов нитрата калия. Возьмите у преподавателя 1 М раствор нитрата калия и пять мерных колб вместимостью 100 мл. Занумеруйте колбы. В колбу 1 налейте из бюретки 10 мл исходного раствора, доведите дистиллированной водой до метки и тщательно перемешайте. Полученный стандартный раствор имеет концентрацию нитрата калия 1·10–1 М моль/л.
Затем 10 мл этого раствора перенесите в колбу 2 и также доведите водой до объема 100 мл, т.е. получите стандартный раствор с концентрацией нитрата калия 1· 10–2 моль/л. Продолжайте последовательное разбавление растворов и получите стандартные растворы, имеющие СNO–3 = 1·10–3, 1· 10–4 и 1· 10–5 моль/л.
Подготовка иономера к работе. Электроды для этой лабораторной работы заблаговременно готовит преподаватель.
Новый измерительный NO3 – селективный электрод ЭM-NO3-01 перед измерением вымачивают 24 ч. в 1 10–1 М растворе нитрата калия (при комнатной температуре).
До измерений внутреннюю полость корпуса ионоселективного электрода два раза промывают дистиллированной водой и еще дважды приэлектродным раствором (смесью 0.1 М раствора нитрата калия с 0,005 М раствором хлорида калия). После этого в электрод заливают 1,5 мл того же приэлектродного раствора и ввинчивают хлорсеребряный индикаторный электрод.
Хранят NO3-селективный электрод в 0,01 М растворе нитрата калия.
Приступая к работе, измерительный NO3-селективный электрод подключите в гнездо «Изм.» на задней стенке прибора с помощью штуцера. Вспомогательный хлорсеребряный электрод включите в гнездо «Всп.», температурный компенсатор (в автоматическом режиме) также включается на задней стенке прибора.
Включите прибор в сеть, нажмите клавиши «t» и «-1-19» и дайте иономеру прогреться 20-30 минут.
Калибровка (настройка) NO3-селективного электрода по стандартным растворам. Начинайте измерения с наиболее разбавленного раствора 5, имеющего СNО3 = I 10-5 моль/л. Перенесите пипеткой 20 мл этого раствора в стаканчик для измерений, погрузите в него электроды (промытые водой и высушенные фильтровальной бумагой). Нажмите клавишу «рХ», ручкой «Калибровка» установите стрелку прибора по шкале «-1-19» на значения 5. Затем нажмите клавишу «4-9» и ручкой "Калибровка" установите точное значение pNO3 по шкале «0-5». Отключите прибор, нажав кнопки «t» и «-1-19».
Аналогично найдите рNO3 для растворов 4, 3, 2 и 1, пользуясь сначала шкалой «-1-19», а затем шкалой «0-5». По этим данным постройте на миллиметровой бумаге градуировочный график, откладывая на горизонтальной оси концентрацию нитрата с (NO3) моль/л, а на вертикальной рNО3 для всех пяти растворов.
Определение NО3 почвенной вытяжки. Перенесите пипеткой 20 мл почвенной вытяжки в измерительный стаканчик прибора, опустите в вытяжку электроды (промытые водой и высушенные фильтром). Нажмите клавишу «рХ» и по шкале «-1-19» найдите диапазон значения pNO3. После этого нажмите клавишу нужного диапазона и запишите точное значение pNO3 по шкале «0-5». Иономер отключите, нажав клавишу «t» и «-1-19», электроды опустите в дистиллированную воду.
Зная рNO3 почвенной вытяжки, найдите по градуировочному графику содержание нитрата в ней. Из точки на вертикальной оси, отвечающей среднему значению рNO3 проведите прямую параллельную горизонтальной оси до пересечения с графиком. Из точки пересечения опустите перпендикуляр на горизонтальную ось. Запишите найденную концентрацию нитратов в почвенной вытяжке СNO3 моль/л.
По известной концентрации определите массу нитрата (m) в почвенной вытяжке как произведение концентрации NO3, моль/л на объем всей вытяжки и молярную массу эквивалента нитрат-иона и содержание NO3 в почве в %. Рассчитайте содержание нитрат-иона в почве в мг/кг почвы, сравните с ПДК NO3- в почве.
Сделайте вывод о качестве почвы по ее кислотности и содержанию нитрат-ионов.
Контрольные вопросы
Какая зависимость лежит в основе прямых потенциометрических определений?
Привести уравнение Нернста для окислительно-восстановительной пары и пояснить смысл входящих в него величин.
Какие электроды относятся к электродам I рода и какие – к электродам II рода? Привести примеры.
Какие электроды называют индикаторными и какие – электродами сравнения? Указать наиболее распространенные электроды сравнения.
Охарактеризовать ионоселективные электроды (с твердыми мембранами, жидкими мембранами, газочувствительные электроды). Какие ионы можно практически определять с применением подобных электродов?
В чем сущность потенциометрического измерения рН раствора? Какие индикаторные электроды могут быть использованыдля определения рН?
Как устроен стеклянный электрод? Указать достоинства и недостатки стеклянного электрода.
IV. ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Определение ионов тяжелых металлов и фенолов
методами тонкослойной и бумажной хроматографии
Цель работы: ознакомление с методами тонкослойной и бумажной хроматографии и их использование для анализа объектов окружающей среды.
1. Теоретическая часть
Тонкослойная (ТСХ) и бумажная (БХ) хроматография основаны на различии скоростей перемещения компонентов анализируемой смеси в плоском тонком слое сорбента при движении по нему растворителя (элюента). Растворитель перемещается по сорбенту под действием капиллярных или гравитационных сил.
В сущности оба метода, ТСХ и БХ, представляют собой процесс разделения в тонком слое сорбента. Разница между ними заключается лишь в способе формирования рабочего слоя. В ТСХ слой сорбента наносят на поддерживающую подложку (пластинку, пленку). В БХ роль рабочего слоя выполняет лист специальной бумаги (для хроматографии). Преимущества ТСХ заключается в том, что при небольших затратах можно быстро и эффективно проводить разделение различных сложных смесей.
Пластинки для хроматографии производится промышленным способом. Методики для самостоятельного приготовления пластинок можно найти в монографиях.
Следует запомнить, что полярные вещества следует разделять в полярных растворителях, малополярные – в менее полярных или неполярных растворителях.
В различных системах растворителей вещества обладают различной подвижностью. Количественно подвижность выражается величиной Rf, иначе называемой фактором удерживания (рис. 1).
Р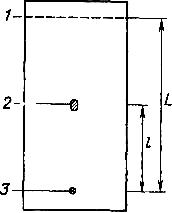 ис.
1. Пластинка ТСХ.
ис.
1. Пластинка ТСХ.
1 – фронт растворителя;
2
L
3 – стартовая точка;
L
L1
l – расстояние старт – пятно целевого вещества
Rf = l /L – хроматографическая подвижность
Rf равно отношению расстояний от стартовой линии до середины пятна вещества и от стартовой линии до линии фронта растворителя. Значение Rf практически не зависит от длительности проявления, но зависит от множества других факторов (в том числе и от влажности воздуха) и, следовательно, может служить лишь предварительным ориентиром. Большинство химических соединений лишено окраски, и для их обнаружения на пластине используют различные физические и химические методы.
Флуоресценция. Многие ароматические вещества имеют собственную флуоресценцию при 360 нм; при этой длине волны они обнаруживаются в виде желтых флуоресцирующих пятен на темном фоне.
Абсорбция. Большинство готовых ТСХ – пластин содержат люминофоры (такие пластины помечены индексом Ф23Д при облучении УФ – светом с длиной волны 254 нм они светятся равномерным желто – зеленым фоном). Вещества, поглощающие в УФ – области, обнаруживаются в виде темных пятен на светлом фоне.
Химические реакции. Функциональные группы веществ способны вступать в реакции со специфическими реагентами с образованием хромофоров (аминогруппы белков и пептидов проявляются с помощью нингидрина).
