
- •Глава 1 нейрофизиологические механизмы боли рецепторный аппарат и афферентные проводники болевой чувствительности
- •Сегментарные механизмы формирования болевого потока и восходящие пути болевой чувствительности
- •Супрасегментарные структуры и механизмы интеграции боли
- •Морфофункциональная организация анальгетических систем головного мозга
- •Нейрофизиологические и нейрохимические механизмы формирования гемодинамических ноцицептивных реакций
- •Глава 2 нейрофармакология опиатов и опиоидов фармакодинамика и фармакокинетика наркотических анальгетиков
- •Опиоидные пептиды
- •Антагонисты опиатов II опиоидов
- •Опиоидная регионарная аналгезия
- •Нейрональные механизмы болеутоляющего действия наркотических анальгетиков и опиоидных пептидов
- •Влияние опиатов и опиоидов на анальгетические системы головного мозга
- •Нейрохимические основы болеутоляющего действия анальгетиков и опиоидных пептидов
- •Адренергические механизмы болеутоляющего действия опиатов и опиоидов
- •Гамкергические механизмы болеутоляющего действия опиатов и опиоидов
- •Психофармакологические механизмы болеутоляющего действия опиатов и опиоидов
- •Нейрофармакологическая коррекция гемодинамических болевых реакций
- •Глава 3
- •Влияние наркотических анальгетиков на дыхание
- •Влияние на моторику кишечника
- •Глава 4 патофизиологические аспекты боли
- •Глава 5
- •Глава 6 болевой синдром при ишемической болезни сердца морфофункциональные основы ноцицепции при ибс
- •Глава 7
- •Патогенез и клиника болевых синдромов в невропатологии
- •Принципы и методы патогенетической терапии болевых синдромов
- •Глава 8
- •Особенности ноцицептивной импульсации при травме.
- •Роль ведущего повреждения в проявлениях болевого синдрома
- •Глава 9 трудно купируемые боли у онкологических больных
- •Особенности проблемы боли и обезболивания в онкологии
- •Патогенез и клиническая картина хронического болевого синдрома у онкологических больных
- •Лечение хронического болевого синдрома у онкологических больных
- •Глава 1. Нейрофизиологические механизмы боли (проф. Ю.Д. Игнатов,
- •Глава 2. Нейрофармакология опиатов и опиоидов (проф. А.А. Зайцев, проф. Ю.Д. Игнатов} ................... 65
- •Глава 8. Болевой синдром при травме и шоке (доц. М.А. Кацадзе, доц. О.Ю. Кузнецова, проф. В.А. Михайлович) ........... 266
- •Глава 9. Трудно купируемые боли у онкологических больных (проф. И. А. Фрид, д-р мед. Наук в. Г. Беляев) . . .......... 295
Глава 4 патофизиологические аспекты боли
При боли в организме развивается ряд вегетативных сдвигов, в том числе изменения функционального состояния систем кровообращения, дыхания, гемостаза и т.д. Эти изменения не являются специфическими, их направленность и степень выраженности зависят от силы и длительности болевого раздражения, исходного функционального состояния организма. Объективная оценка вегетативных сдвигов при боли имеет большое значение для предупреждения вторичных повреждений в организме и выбора обезболивающих средств.
ВЛИЯНИЕ БОЛИ НА ГЕМОСТАЗ
История изучения влияния боли на систему гемостаза начинается с работ У. Кэннона, установившего, что при болевом раздражении у животных уменьшается время свертывания крови. Тот же эффект наблюдался при раздражении чревного нерва [Кэннон У., 1927]. Эти факты были подтверждены в последующем многими исследователями, и в настоящее время гиперкоагуляция рассматривается как постоянный компонент реакции на болевое воздействие. Повышение свертываемости крови у человека и животных наблюдается при болевом раздражении разной силы, причем как сразу после воздействия, так и в последующее время, и рассматривается как биологически целесообразная реакция [Дионесов С. М., 1963].
По данным Н.С. Джавадяна (1951, 1954), максимальная гиперкоагуляция крови у собак отмечалась между 10 и 20-й минутами после раздражения кожи электрическим током. В.П. Балуда (1957), используя сходную модель боли, зафиксировал повышение свертываемости крови сразу после болевого раздражения, которое было максимальным через 20—30 мин. Н.П. Маркарян и соавт. (1956) наблюдали ускорение свертывания крови у собак при электрическом или механическом раздражении изолированной кишечной петли и рога матки. По данным Р. Linke и R. Polak (1956), ритмические раздражения различных вегетативных нервов ведут к укорочению протромбинового времени через 3—6 мин после раздражения.
Влияние длительного (хронического) ноцицептивного раздражения на свертывающую систему крови и гемостаз в целом изучено не так детально, как острой боли. В.В. Кравцов (1961) вызывал у кроликов и собак хроническую боль сдавлением седалищного нерва или корешков спинного мозга. У собак в течение 1-го месяца создания очага длительного ноцицептивного раздражения скорость свертывания крови возрастала в 2—3 раза. В последующие 2—3 мес также отмечалась гиперкоагуляция. У кроликов при длительном болевом раздражении наблюдалось ускорение свертывания крови в 1,5—2 раза в течение 2—3 мес. Длительное прерывистое надпороговое болевое раздражение лапы у собак приводило к выраженной гиперкоагуляции и депрессии противосвертывающей системы крови [Ястребцова Н.Л. и др., 1973].
Мы исследовали кинетику гемокоагуляции у крыс при эмоционально-болевом стрессе. По данным В.К. Кулагина и В.В. Давыдова (1973), через 30 мин от начала иммобилизации содержание 11-оксикортикостероидов в надпочечниках и плазме крови возрастает в 1,75 раза. При длительной фиксации уровень кортикостерона в циркулирующей крови продолжает увеличиваться в основном за счет свободных форм гормона. Показатели тромбоэластограммы (ТЭГ) определяли через 15, 30 мин и 3 ч от начала иммобилизации, сравнивали с исходными и определяли достоверность разницы. Полученные данные приведены в табл. 11.
Через 15 мин от начала иммобилизации исследуемые показатели ТЭГ существенно не изменялись. Через 30 мин наблюдались достоверное уменьшение неспецифической константы коагуляции (R+K) и увеличение максимальной амплитуды. Показатели, характеризующие скорость образования тромбопластина и тромбина (R), скорость образования сгустка (К) изменялись однонаправленно (в сторону гиперкоагуляции) хотя и недостоверно. Угловая константа, характеризующая скорость свертывания крови, и коагуляционный индекс (Ci) несколько увеличились. На основании этих данных можно заключить, что через 30 мин после начала иммобилизации отмечается тенденция к повышению свертывания крови. Через 3 ч изменения показателей ТЭГ были еще более выражены: достоверно уменьшились время образования сгустка (К), неспсцифическая константа коагуляции (R+K), общее время формирования сгустка (Т), увеличились максимальная амплитуда (МА), угловая константа (а) и коагуляционный индекс (Ci). Все эти изменения свидетельствуют о повышении свертывания крови. Уменьшение хронометрических показателей ТЭГ может быть обусловлено как высокой тромбопластиновой активностью, так и снижением активности естественных антикоагулянтов или сочетанием обоих механизмов. Увеличение максимальной амплитуды ТЭГ в основном связано не с кинетикой свертывания крови, а со строением сгустка и его организацией. Факторами, ведущими к увеличению МА, являются тромбоцитоз и гнперфибриногенемия.
Таблица 11
Показатели ТЭГ у крыс при эмоционально-болевом стрессе
Показатель ТЭГ |
Время исследования |
||
15 мин (n=8) |
30 мин (n=8) |
3 ч (n=8) |
|
∆Р, мин |
↓0,12 |
↓0,37 |
↓0,59 |
∆К, мин |
↓0,9 |
↓0,17 |
↓0,24±0,86 |
∆Т, мин |
↓1,7 |
↓0,5 |
↓2,4±0,46 |
∆МА, мм |
↑0,69 |
↑2,53±1,22 |
↑3,5±1,41 |
∆Ci |
↑0,14 |
↑0,43 |
↑1,1±0,42 |
∆a, град |
↑2,0±0,48 |
↑3,4 |
↑7,9±2,73 |
Примечание. ↑ — увеличение показателя; ↓ — уменьшение показателя.
Для уточнения роли надпочечников в реакции системы гемостаза на ноцицептивное раздражение мы исследовали кинетику гемокоагуляцин у адреналэктомированных (7-е сутки после операции) крыс при эмоционально-болевом стрессе. Через 15 и 30 мин от начала иммобилизации наблюдалось уменьшение показателей ТЭГ, характеризующих скорость свертывания крови (R, К, Т), но эти изменения, за исключением некоторого увеличения скорости образования сгустка (К) через 30 мин, были незначительны (табл. 12).
Т а б л и ц а 12
Показатели ТЭГ у адреналэктамиронанных крыс при эмоционально-болевом стрессе
Показатель ТЭГ |
Время исследования |
||
15 мин (n=8) |
30 мин (n=8) |
3 ч (n=8) |
|
∆Р, мин |
↓0,9 |
↓1,25 |
↓0,12 |
∆К, мин |
↓0,2 |
↓0,25±0,8 |
↑0,02 |
∆Т, мин |
↓4,0 |
↓2,6 |
↓0,8 |
∆МА, мм |
↓0,33 |
↓1,25 |
↓1,2 |
∆Ci |
↑0,42 |
↑0,46 |
↑0,18 |
∆a, град |
↑2,7 |
↓4,1 |
↓1,0 |
Через 3 ч от начала иммобилизации изменения ТЭГ у адреналэктомированных крыс были менее выражены, чем через 30 мин, и имели незакономерный характер. Между тем, как отмечалось ранее, у интактных крыс 3-часовая иммобилизация вызывала закономерное уменьшение хронометрических и увеличение структурных показателей ТЭГ. Таким образом, если у контрольных крыс через 3 ч иммобилизации наблюдалось отчетливое повышение свертываемости крови, то у адреналэктомированных не наблюдалось даже тенденции к гиперкоагуляции. Следовательно, экспериментальные исследования убедительно показали, что различные формы болевого воздействия приводят к повышению свертываемости крови.
В литературе имеются многочисленные данные о повышении свертываемости крови у больных на высоте приступа болей, во время оперативных вмешательств, в раннем постоперационном периоде и т.д. У всех больных в остром периоде инфаркта миокарда регистрируется гиперкоагуляция, причем артериовенозная разница гемостатических потенциалов практически отсутствует [Забелина И.В. и др., 1987]. Гиперкоагуляция при инфаркте миокарда особенно выражена у больных с выраженным болевым синдромом [Чазов Е.И., 1966].
Ускорение свертывания крови, регистрируемое in vitro, еще не свидетельствует о внутрисосудистом свертывании. Известно, что в процессе превращения фибриногена в фибрин образуется фибринопепгид А, содержание которого в плазме у здоровых людей минимально. У больных во время операции на кишечнике концентрация фибринопептида А в плазме увеличивалась с 5,2 пмоль/мл до 56 пмоль/мл, причем увеличение отмечалось с момента начала манипуляций на кишечнике [Grant P. et al., 1986]. Наиболее вероятной причиной увеличения свертываемости крови в данном случае могла быть висцеральная боль.
В механизме гиперкоагуляции при острой боли основное значение имеют ускорение тромбиногенеза и увеличение образования тромбина. Н.С. Джавадян наблюдал увеличение титра тромбина в крови собак после болевого раздражения в 3—8 раз (максимальное через 20—25 мин, когда гиперкоагуляция была наиболее выражена); по данным В.П. Балуды (1957), потребление протромбина увеличивалось сразу после болевого воздействия, а протромбиновый индекс был достоверно увеличен через 10—30 мин. Эти данные свидетельствуют о повышении тромбопластиновой активности крови. По мнению А.А. Маркосяна (1959), увеличение тромбопластиновой активности крови — основной фактор гиперкоагуляции. Интересно, что в опытах, в которых производилась предварительная анестезия зоны раздражения, изменений в свертываемости крови не наблюдалось.
Как известно, имеются внутренний и внешний механизмы активации свертывания крови, последний инициируется тканевым тромбопластином. При действии различных стрессорных факторов на организм, в том числе и боли, наблюдается выброс тромбопластина из интактной сосудистой стенки [Кузник Б.И. и др., 1973].
Тканевый тромбопластин образуется в различных клетках, входящих в состав сосудистой стенки. В физиологических условиях образование и выделение его в кровь незначительны или вообще не происходят. К факторам, способным индуцировать эти процессы, относятся тромбин, адреналин, норадреналин, серотонин и др. [Кузник Б.И. и др., 1973].
В механизме усиленного поступления тканевого тромбопластина из сосудистой стенки в кровь при боли главную роль, по-видимому, играют гиперадреналинемия и, возможно, усиление импульсации по адренергическим вазомоторным нервам. После перерезки чревных нервов болевое раздражение не приводило к гиперкоагуляции; это, по мнению авторов, доказывает роль гиперадреналинемии в ее развитии [Кеннон У., 1924]. По данным В.Л. Богуш (1968), усиленный выброс тромбопластических соединений из артерий и вен при болевом раздражении связан с повышением тонуса симпатического отдела вегетативной нервной системы.
Катехоламины не только влияют на образование и выделение тромбопластина, но и активируют фактор XII, играющий ключевую роль в активации внутреннего механизма гемостаза. Повышение активности фактора XII - одно из проявлений неспецифической реакции системы гемостаза на повреждение. Парциальное тромбопластнновое время, характеризующее активность внутреннего механизма гемостаза, во время операций (резекция кишечника) достоверно не изменялось [Grant P. et al., 1986], несмотря на очевидные признаки гиперкоагуляции, что свидетельствует о том, что активация фактора XII не является ведущим фактором усиления тромбиногенеза при болевом раздражении.
Повышение активности фактора XIII и фактора Виллебранда (фактора В) является типичной реакцией на повреждение [Bennet В./ Towler H., 1985] и наблюдается, в частности, в течение оперативных вмешательств [Grant P. et al., 1986; Mellisari E. et al., 1986]. В механизме этих изменений большое значение придается адреналину и вазопрессину, содержание которого в крови при болевом раздражении увеличивается (рис. 23). Адреналин оказывает прямое действие на эндотелиальные клетки и вызывает усиление поступления факторов VIII и В в кровь, а вазопрессин действует опосредованно, через второй мессенджер [Grant P. et al., 1987].
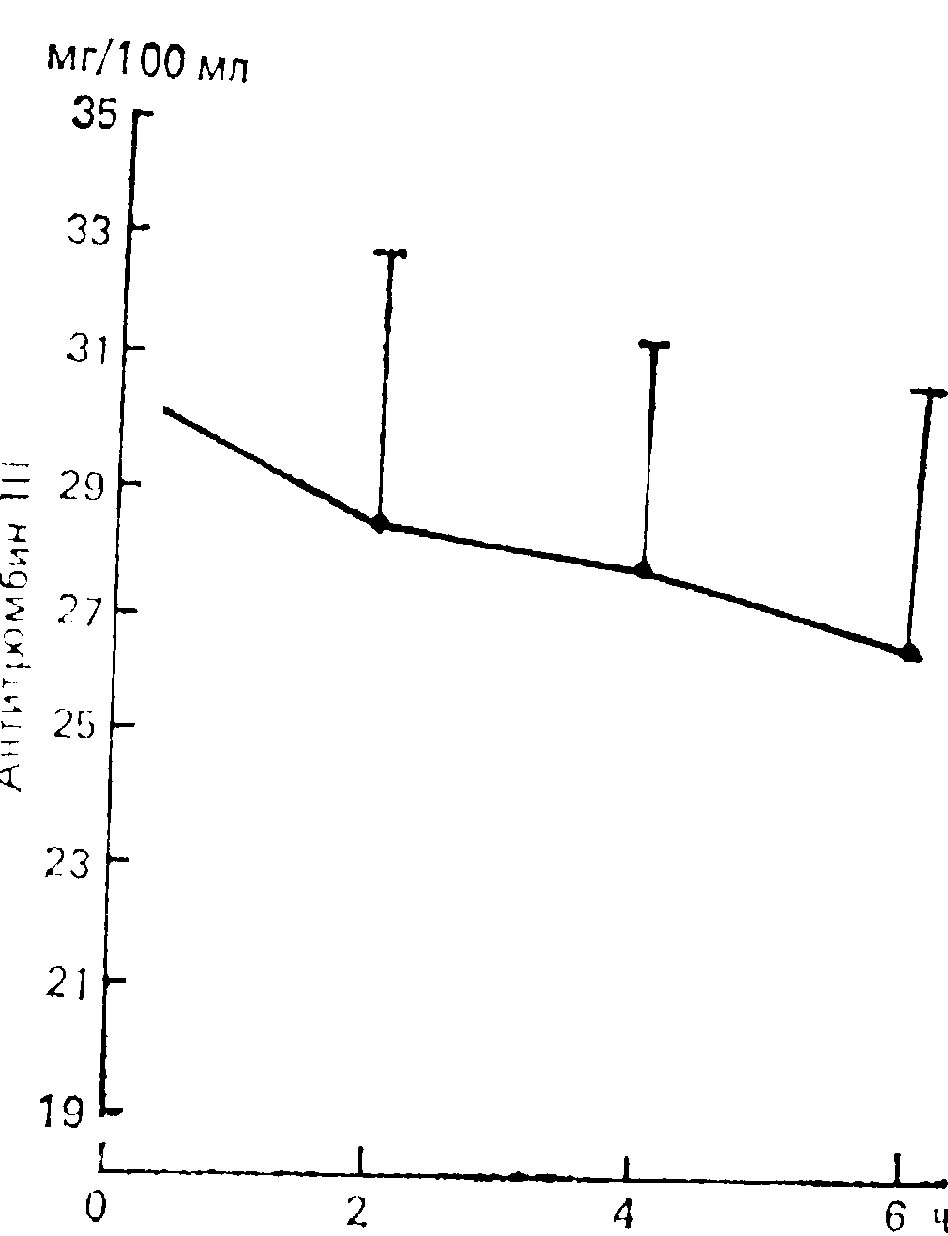
В механизме гиперкоагуляции при стрессе, в том числе вызванном болевым раздражением, определенную роль играет уменьшение содержания в крови физиологических ингибиторов свертывания крови: антитромбина III (AT III), гепарина, протеина С и др. Антитромбин III инактивирует тромбин, факторы Ха, Х1Фа, XI 1а и потребляется в процессе гемокоагуляции. Гепарин повышает антикоагулянтную активность антитромбина III. Установлено, что суммарная антитромбиновая активность крови у собак уменьшалась сразу после болевого воздействия, а через 10—30 мин составляла около 70 % от исходной [Балуда В.П., 1957]. Этот факт можно объяснить потреблением антитромбина III, так как трудно представить, что в течение нескольких минут после кратковременного болевого воздействия нарушается его биосинтез в печени.
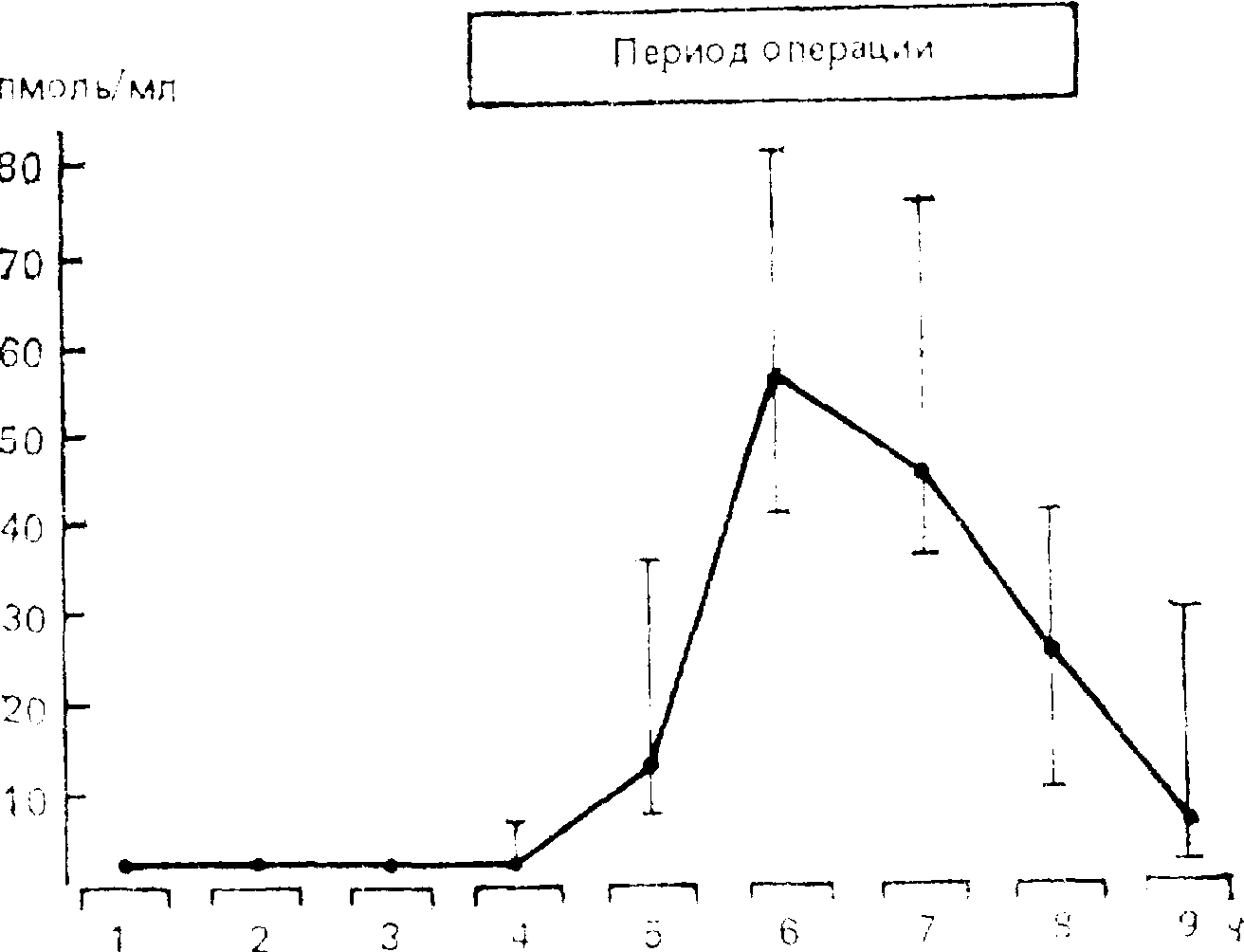
Рис. 23. Изменения концентрации вазопрессина в плазме крови во время абдоминальной операции (по Р. Grant, и соавт., 1986).
По оси абсцисс — время: по оси ординат — концентрация вазопрессина в плазме крови.
Можно с большой долей вероятности предположить (поскольку нет прямых исследований), что и у человека болевое раздражение вызывает уменьшение антитромбина III. Во всяком случае, при патологических процессах и состояниях, сопровождающихся болью (оперативное вмешательство, механическая травма, острый инфаркт миокарда), многие авторы отмечали уменьшение содержания антнтромбина III [Люсов В.А. и др., 1976; Дерябин Н.И. и др., 1984; Gonzales R. et al., 1986; Harbourne Т., Nicolajdes, 1986]. На рис. 24 показана динамика антитромбнна III в течение 6 ч после операции.
При действии на организм ноцицептивных раздражителей весьма существенно изменяется содержание гепарина в крови. Так, например, на высоте болевого приступа при остром инфаркте миокарда наблюдается гипергепаринемия [Чазов Е. И., 1966]. Интересно, что введение гепарина при инфаркте миокарда оказывает обезболивающее действие [Чазов Б.И., Лакин В.К., 1977].
У собак повторное болевое воздействие вызывало гиперкоагуляцию и увеличение гепарина в крови [Ястребцова Н.Л. и др., 1973]. В присутствии гепарина увеличивается потребление антитромбина III [Bonnet В., Towler H., I986]. По-видимому, гипергепарипемия при боли — неспецифическая реакция, связанная с дегрануляцией тканевых тучных клеток и базофилов крови вследствие гиперадреналинемии.
Протеин С — витамин К-зависимый белок, синтезируется в печени и активируется тромбином и кофактором, образующимся в эндотелии. Активный протеин С уменьшая тем самым тромбинегенез. При остром инфаркте миокарда (с грудными болями) содержание протеина С в крови практически не изменялось, так же как во время операций на органах брюшной полости [Gonzales R. и др., I986; Mellissari E. et al., 1986]. Возможно, что при болевом раздражении изменение активности протеина С не имеет существенного значения в мехланизме гиперкоагуляции.
Усиление фибринолиза при боли наблюдали в эксперименте многие исследователи [Ястребцова П.Л. и др., 1973; Киянов В.И. и др., 1978; Кузник Б.И. и др., 1978; Рогато J. et а1., 1985]. Во время операций фибринолитическая активность возрастает. Так, К. Mellissari и соавт. (1986) исследовали изменение времени лизиса эуглобулинов фракции во время анестезии (омнопон + скополамин) в течение операции и после нее. Как видно из рис. 25, активация фибринолиза отмечается еще во время подготовки к операции (т.е. не связана с болью) и является, следовательно, одним из проявлений стресса.
При инфаркте миокарда с первых часов заболевания фибринолитическая активность снижается, но у больных с тяжелым болевым синдромом фибринолиз повышен [Кожевникова Т.Л., 1961; Чазов Е.И., 1966]. При повторном болевом воздействии наблюдается угнетение фибринолиза, сочетающееся с гиперкоагуляцией [Ястребцова Н.Л. и др., 1973]. В механизме активации фибринолитической системы при боли основное значение имеет выделение из сосудистой стенки активатора плазминогена (АП). К факторам, влияющим на выделение сосудистого АП в кровь, относятся гистамин, брадикардин, каллидин, катехоламины, вазопрессин, содержание которых в крови и тканях при боли увеличивается.
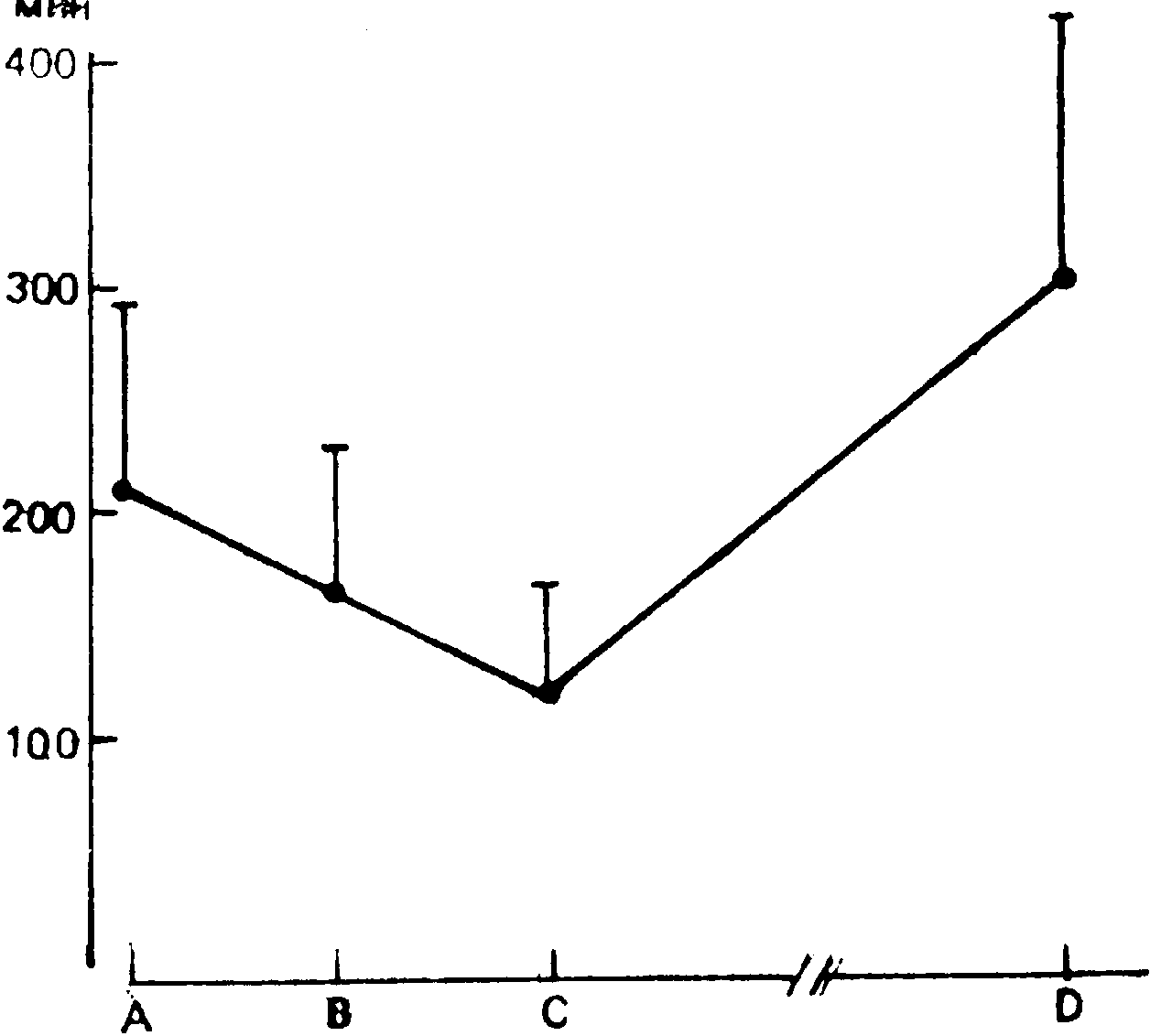
Рис. 25. Фибринолитическая активность (время лизиса глобулинов) до операции (А), после анестезии (В), в течение операции (С) и через 24 ч (Д) (по Е. Mellissari и соавт., 1986).
Одним из характерных изменений в системе гемостаза при острой и хронической боли является изменение числа тромбоцитов в крови и их функциональной активности. Уже через 5—10 мин после болевого раздражения у собак отмечался тромбоцитоз, а через 20—30 мин число тромбоцитов увеличилось в 1,5—2 раза [Джавадян Н.С., 1951, 1954; Балуда В.П., 1957]. Столь быстрое увеличение можно объяснить только поступлением в кровь депонированных зрелых тромбоцитов, в частности из легких. В развитии перераспределительного тромбоцитоза при кратковременном болевом воздействии гиперадреналинемия, по-видимому, решающего значения не имеет, так как введение адреналина не вызывает выраженного тромбоцитоза [Джавадян Н.С., 1954].
В опытах на собаках и кроликах В.В. Кравцов (1961) показал, что при хронической боли количество тромбоцитов увеличивается. Учитывая длительность наблюдения (2—6 мес), можно полагать, что в данном случае усиливается тромбоцитопоэз. Вместе с тем Б.И. Кузник и соавт. (1973), на основании многочисленных экспериментов на различных видах животных, пришли к выводу, что при любой стрессовой ситуации, в том числе при боли, количество тромбоцитов в крови уменьшается и увеличивается число адгезивных тромбоцитов. По-видимому, тромбоцитопения как следствие потребления тромбоцитов развивается только при гиперкоагуляции, сопровождающейся внутрисосудистым свертыванием крови (I стадия синдрома ДВС), и локальном свертывании при повреждении тканей. В реальных условиях боль, как правило, сочетается с повреждением тканей, поэтому во время оперативных вмешательств и в ближайшие сроки после операции наблюдается уменьшение тромбоцитов, а позже — тромбоцитоз [Bennet В., Towler H., 1985].
Данные о влиянии боли на функциональную активность тромбоцитов очень немногочисленны. В остром периоде инфаркта миокарда АДФ-индуцированная агрегация тромбоцитов увеличена [Забелин И.В. и др., 1987]. При оперативных вмешательствах увеличивается степень агрегации тромбоцитов и наблюдается реакция высвобождения [Жуковская Е.С. и др., 1978]. Установлено, что в ходе операции и после нее (холецистэктомия, нейролептическая анестезия) содержание в крови (3-тромбоглобулина, серотонина, ТхВ2 (маркеров реакции высвобождения) увеличивалось [Naesh О. et al., 1985]. Сразу после операции отмечена временная рефрактерность тромбоцитов к АДФ, а в более поздние сроки — их повышенная агрегационная активность. Временную рефрактерность тромбоцитов авторы объясняют тем, что АДФ, выделяющаяся в процессе операции, связывается с рецепторами и блокирует реакцию на экзогенную АДФ.
При инфаркте миокарда, хирургических вмешательствах боль является лишь одним из факторов, влияющих на функциональную активность тромбоцитов и оценить именно ее значение весьма трудно. Экспериментальные исследования также пока не внесли полной ясности в этот вопрос. По данным А.К. Бекболоновой и соавт. (1978), у крыс, подвергшихся воздействию электрического тока в сочетании со световым и звуковым раздражением, АДФ-индуцированная агрегация тромбоцитов зна чительно увеличивалась, а дезагрегация резко замедлялась. По нашим данным, у крыс при эмоционально-болевом стрессе (3-часовая фиксация к станку без наркоза) интенсивность АДФ-индуцированной агрегации несколько уменьшилась, а дезагрегация усилилась (табл. 13).
Т а б л и ц а 13
Агрегация тромбоцитов у крыс при эмоиионально-болевом стрессе, М±т
Группа животных |
Показатели агрегации |
|||
T, % |
T1,c |
T2, с |
T3, с |
|
Контроль (n=9) Опыт (п=16) |
34,6±4,9 22,2±3,5* |
25,0±1,6 27,0±3,1 |
83,0±5,9 86,0±15,9 |
177,0±8,6 140,0±10,2* |
* р < 0,05.
Примечание. Т — изменение оптической плотности: t1 — время максимальной скорости агрегации; Т2 — время максимальной агрегации; Т3— время полудезагрегации.
Генерализованная болевая реакция у крыс, возникающая при электрическом раздражении хвоста, сопровождалась некоторым снижением интенсивности и замедлением АДФ-индуцированной агрегации тромбоцитов. Эти данные согласуются с результатами исследований, показавших уменьшение агрегации тромбоцитов у крыс при раздражении седалищного нерва [Doni М., 1978]. Таким образом, при острой боли изменения в системе гемостаза характеризуются увеличением содержания прокоагулянтов в крови и повышением се свертываемости, активацией фибринолиза, развитием тромбоцитоза и внутрисосудистой активацией тромбоцитов. Однако эти изменения не являются специфическими для боли и отражают реакцию организма на повреждение.
В качестве одного из пусковых механизмов изменения функциональной активности гемостаза при эмоционально-болевом стрессе рассматривается усиление перекисного окисления липидов. Активация системы регулирования агрегатного состояния крови (PACK) осуществляется, в частности, через выделение факторов свертывания крови и фибринолиза из сосудистой стенки, изменение регуляции метаболизма простациклина [Мищенко В.Л., 1987].
В практическом отношении важно знать влияние не только боли, но и анальгетических препаратов на функциональное состояние системы гемостаза. Анальгетики могут как оказывать прямое влияние на систему гемостаза, так и изменять чувствительность эндотелия, тромбоцитов и т.д. к адреналину, вазопрессину и другим гуморальным факторам, играющим большую роль в развитии гиперкоагуляции, активации фибринолиза, тромбоцитоза при боли. Известно, например, что а-блокаторы предотвращают увеличение содержания фактора VIII после введения адреналина [Ingram G., Jones V., 1966; Cash J., Woodfield D., 1969]. Если у ненаркотизироианных кроликов адреналин вызывал повышение свертываемости крови, уменьшение количества тромбоцитов и ускорение ретракции кровяного сгустка, то на фоне эфирного наркоза свертываемость крови и количество тромбоцитов существенно не изменялись, а ретракция сгустка замедлялась [Кочеткова Г.В., 1969]. Ганглиоблокаторы (арфонад, пентамин) предотвращали повышение свертываемости крови при оперативных вмешательствах, но не влияли на изменение фибринолнтической активности [Меркулова Е.В., Файзулла М. Ф., 1966]. По данным R. Mellissari н соавт. (1986), введение в наркоз приводит к повышению фибринолитической активности крови, наблюдающемуся и во время операции. Морфии не препятствует развитию гиперкоагулянии и повышению фибринолиза при введении адреналина [Самойленко И.И., 1969].
На нашей кафедре проведено исследование (С.Б. Ткаченко) влияния морфина на динамику тромбообразования в артериолах и венулах. Крысам, наркотизированным натрия оксибутиратом, производилась лапаротомия, извлекалась петля тонкой кишки и помещалась на столик микроскопа (температура +37 °С). С помощью лазерного облучения (λ-337 нм) производилось повреждение артериол и венул и исследовалась динамика тромбообразования (Петрищев Н.Н. и др., 1988]. У контрольных животных в артериолах время роста тромба до отрыва первого эмбола (Тр), время стабилизации тромба (Тст) были меньше, чем в венулау, т.е. формирование тромба про исходило быстрее R то же время площадь поперечного сечения тромба (S) и его протяженность вдоль сосудистой стенки (I.) в венулах были больше. В некоторых случаях, когда при лазерном облучении сосуда происходил его разрыв, остановка кровотечения в артериолах (время первичного гемостаза) происходила намного быстрее, чем в венулах. У подопытных крыс повреждение сосудов производилось на фоне предварительного введения морфина. Если тромбоз вызывался через 30 мин после введения морфина, показатели тромбообразонания в артериолах и венулах были более близки, причем тромбогенная активность венул повышалагь весьма существенно. Через 60 мин начальная скорость роста тромба в венулах была больше, чем в артериолах, но площадь тромба и общее время ею формирования (как и в контроле) в венулах были больше. Время первичного гемостаза в случае разрыва венул и артериол было одинаковым. Таким обраюм, при введении морфина в дозе 2 мг/кг наблюдается отчетливая тенденция к повышению тромбогенной активности сосудистой стенки.
Иные результаты были получены в опытах с введением большей дозы морфина - 5 мг/кг. Через 30 и через 60 мин временные и геометрические параметры тромбообразования в артериолах и венулах отличались от контроля не столь существенно, но время первичного гемостаза было увеличено, особенно через 60 мин. Приведенные данные свидетельствуют о необходимости учета действия морфина на тромбоцитарносо-судистый гсмостаз, особенно в послеоперационном периоде, когда имеются выраженная гииеркоагуляция, тромбоцитоз, угнетение фпбринолиза.
Хорошей иллюстрацией значения вида обезболивания в профилактике послеоперативного тромбоза могут служить данные J. Dahsgaard-Nielsen, J. Gonnsen (I982). Авторы исследовали содержание норадреналина и время лизиса эуглобулинов у больных, подвергшихся операции (грыжессчению). Больным одной группы операция производилась под общим наркозом, а во второй группе — под эпидуральной анестезией бупивокаином. В случае общего наркоза содержание норадреналина в плазме крови увеличивали до 7,2 ммоль/л, а при эпидуральной анестезии — до 3,7 ммоль/л. Фибринолитическая активность у больных первой группы возрастала сразу после операции, но значительно снижалась в последующие дни. В группе с эпидуральной анестезией фибринолитическая активность практически не изменялась. Авторы считают, что нейрогенная блокада, достигаемая эпидуральной или епинальной анестезией (T4—D5), предотвращает в значительной мере эндокринно-метаболический ответ на хирургическую травму и защищает от послеоперационного истощения активатора плазминогена, уменьшая тем самым риск тромбоза.
Активация системы гемостаза при боли, несомненно, является неспецифичсской реакцией на повреждение. Эта реакция сформировалась в процессе эволюции как защитная (остановка кровотечения), но во многих случаях, если не в большинстве, имеет патогенетическое значение. Гиперкоагуляция и внутрисосудистая агрегация тромбоцитов, наблюдающиеся при острой боли, могут привести к внутрисосудистому свертыванию крови, нарушениям микроциркуляции и т.д. Исходя из этого, во-первых, оправдано сочетание анальгетиков с препаратами, корригирующими отклонения в системе гемостаза при боли, и, во-вторых, следует учитывать особенности действия анальгетиков на свертывание крови, фибринолиз, функциональную активность тромбоцитов.
ВЛИЯНИЕ БОЛИ НА ДЫХАНИЕ
Характер изменений внешнего дыхания у человека при болевом раздражении разной силы и длительности изучен довольно подробно. Умеренная, непродолжительная боль (раздражение кожи электрическим током, наложение зажима на палец и т.п.), как правило, вызывает учащение дыхания, увеличение амплитуды, уменьшение парциального давления углекислого газа в альвеолярном воздухе. Учащению дыхания может предшествовать кратковременная его задержка. После прекращения раздражения дыхание быстро восстанавливается.
Общеизвестно изменение частоты и глубины дыхания (как правило, тахигиперпноэ), наблюдающееся во время операций, проводимых при неглубокой анестезии. У больных с легкой травмой грудной клетки, ожоговой травмой отмечаются учащение дыхания и гипервентиляция, связанные с болевым фактором [Комаров Б.Д. и др., 1975]. Болевое воздействие при зондировании кариозной полости зуба приводит к увеличению частоты дыхания и уменьшению его амплитуды. Сходные изменения наблюдаются при осмотре полости рта (психологическая реакция страха боли). Транквилизаторы, особенно диазепам, эффективно уменьшают эту реакцию [Дмитриев А.В. и др., 1978].
Изменения объемных и временных параметров дыхательного цикла у человека при умеренном болевом раздражении вызывают увеличение легочной вентиляции. Такие сдвиги паттерна дыхания называют стеновентиляторными [Бреслав И.С., 1984]. Учащение дыхания и гипервентиляция являются одним из проявлений реакции ЦНС на болевое раздражение.
Изменения газового состава крови при одышке, вызванной болью, неоднотипны, чаще наблюдается гипокапния при нормальном или слегка сниженном содержании кислорода в артериальной крови. Длительное гиперпноэ при боли может привести к гипокапнии и нарушению КОС, а в случае длительного поверхностного дыхания развиваются гипсркапния и гипоксемия.
При острой сильной боли ритм дыхания становится неправильным, учащение дыхания сменяется урежением, вплоть до временной остановки. Угнетение дыхания не является специфической реакцией на болевое раздражение и наблюдается при выраженном психоэмоциональном стрессе, не сопровождающемся болью. При травмах грудной клетки, невралгии межреберных нервов, плеврите, после оперативных вмешательств на органах грудной и брюшной полостей дыхательные экскурсии грудной клетки, диафрагмы, брюшной стенки сопровождаются болевыми ощущениями, что приводит к рефлекторному ограничению глубины дыхания («щадящее дыхание») и компенсаторному увеличению его частоты (тахигипопноэ). Боль в этих случаях является фактором торможения легочной вентиляции [Ротенфельд М.3., 1948].
Введение анальгетиков наркотического типа в послеоперационном периоде способствует улучшению вентиляции легких в тех случаях, когда дыхательный объем ограничен болями [Дарбинян Т.М. и др., 1973]. На фоне гиповентиляции у больных в послеоперационном периоде периодически наблюдаются глубокие дыхательные движения, что, возможно, способствует предотвращению ателектаза участков легких. Боль является одним из факторов, который, уменьшая растяжимость легких, препятствует периодическому углублению дыхания и тем самым способствует развитию ателектаза и пневмоний, нередко наблюдающихся после операций на грудной клетке и брюшной полости [Bendcxen H. et al., 1964].
Рассматривая боль как один из послеоперационных факторов, вызывающих нарушения дыхания, А.П. Зильберг (1984) выделил основные механизмы нарушения дыхания в послеоперационном периоде: смещение регионарной вентиляции из нижних зон в расположенные выше, снижение растяжимости легких и грудной клетки, рост общего дыхательного сопротивления, увеличение мертвого альвеолярного пространства, увеличение альвеолярного шунта, снижение резерва функциональной остаточной емкости. Нарушения дыхания в послеоперационном периоде связаны не только с ограничением дыхания из-за боли, но и с нарушением микроциркуляции, суспензионной стабильности крови в легочных капиллярах в связи с катехоламинемией и вторичным увеличением других биологически активных веществ.
Болевой синдром при спазме коронарных сосудов, почечной колике нередко сопровождается ограничением дыхания и его задержкой, в том числе и произвольными. При тяжелом ожоговом, травматическом шоке расстройства дыхания, проявляющиеся брадипноэ, уменьшением минутной вентиляции и жизненной емкости легких, связаны не только с болью, но и с циркуляторными нарушениями — уменьшение МОК, ОЦК, прекапиллярное шунтирование [Комаров Б.Д. и др., 1975]. При длительном фантомно-болевом синдроме после ампутации нижних конечностей у больных наблюдалось незначительное ускорение дыхания [Пожидаева Л.М., 1976].
В опытах на животных разных видов выявлена та же закономерность изменений дыхания при боли, что и у человека. Слабое кратковременное болевое раздражение сопровождается учащением и углублением дыхания, сильное — остановкой дыхания, которой иногда предшествуют значительное его учащение и усиление. Сходные изменения паттерна дыхания наблюдаются при электрическом раздражении кожи, бедренного и седалищного нервов, а также висцеральных афферентов тонкой кишки, плевры и т.д. [Prabhakar N.R et al., 1985J. Показано, что активация спланхнических афферентных нервов у наркотизированных кошек вызывала уменьшение дыхательного объема, уменьшение электрической активности диафрагмального нерва и повышение электрической активности наружных межреберных мышц. Эти изменения не были продолжительными, и уже в процессе стимуляции дыхание восстанавливалось [Prabhakar N. et al., 1985]. Известно, что ритмические и координированные сокращения дыхательных мышц обусловлены периодическим характером активности определенных структур продолговатого мозга. В основе центральной импульсной активности лежит нарастающая на протяжении вдоха импульсация инспираторных нейронов дорсального дыхательного ядра. Эти нейроны имеют непосредственную проекцию в диафрагмальные ядра. Активность диафрагмального нерва и величина дыхательного объема являются показателями центральной импульсной активности [Бреслав И.С., 1984].
Следовательно, зафиксированное в опытах N. Prabhakar и соавт. (1985) уменьшение эфферентной активности диафрагмального нерва и уменьшение дыхательного объема при раздражении висцеральных афферентов свидетельствуют о снижении уровня центральной импульсной активности, угнетении инспираторных нейронов.
К.М. Каграмановым (1980) было показано изменение электрической активности инспираторных и экспираторных нейронов продолговатого мозга при болевом раздражении седалищного нерва.
В формировании паттерна дыхания определяющее значение имеет афферентная импульсация от хеморецепторов, рецепторов растяжения легких, ирритантных рецепторов, рецепторов верхних дыхательных путей. Информация от болевых рецепторов приводит к изменениям дыхания еще до развития существенных отклонений Ро2 и Рсо2 в артериальной крови (регуляция «но возмущению»). При болевом раздражении изменяется как активность нейронов дыхательного центра, так и их возбудимость к регулирующим влияниям. Экспериментальными исследованиями убедительно доказано, что болевое раздражение определенной силы вызывает депрессию инспираторных нейронов ствола мозга [Albano J. et al., 1983]. Рефлекторный характер изменений дыхания при боли, вызванной раздражением висцеральных афферентов, доказан в опытах с денервацией [Prabhakar N. et al., 1985]. В механизме изменений дыхания при боли, так же как и сердечной деятельности, артериального давления, мышечного тонуса, большое значение придается активирующему влиянию адренергического субстрата ретикулярной формации ствола мозга на кору больших полушарий [Судаков К.В., 1980].
У наркотизированных животных изменения дыхания при болевом раздражении хотя и имеют место, но менее выражены. Так, у наркотизированных уретаном животных в ответ на болевое раздражение седалищного нерва первой возникает реакция десинхронизации на ЭЭГ, а вслед на ней и параллельно изменяются частота дыхания и уровень артериального давления. Сильное болевое раздражение приводит к одновременному изменению этих показателей. Подпороговый стимул не вызывает заметных изменений дыхания, хотя имеет место подавление вызванного коркового потенциала [Каграманов К.М., 1980].
В механизме изменений дыхания при боли имеют значение не только нейрогенные, но и гуморальные факторы. Катехоламины, серотонин, эндорфины, энкефалины, ГАМК, глицин и другие факторы, метаболизм которых и содержание в крови изменяются при болевом раздражении, участвуют в гуморальной регуляции паттерна дыхания [Бреслав И.С., 1984]. Повышение функциональной активности симпатико-адреналовой системы ведет к повышению возбудимости дыхательного центра, усилению электрической активности инспираторной и экспираторной мускулатуры, усилению газообмена в легких. Избыток серотонина повышает рефлекторную возбудимость дыхательного центра [Базаревич Г.Л. и др., 1979]. Для острой болевой стимуляции характерна активизация обмена ГАМК; содержание ее в головном мозге возрастает при увеличении длительности или тяжести раздражения, что рассматривается как один из механизмов нейромедиаторной и энергетической адаптации [Игнатов Ю.Д. и др., 1985]. ГАМК вызывает уменьшение глубины и частоты дыхания за счет удлинения выдоха [Hedner et al., 1981], угнетается активность дыхательных нейронов дорсального и вентрального ядер моста.
Особый интерес представляют данные о влиянии опиатов на дыхание. Эндогенные морфиноподобные пептиды вызывают угнетение дыхания, оказывая прямое действие на дыхательный центр продолговатого мозга и супрабульбарные структуры, участвующие в регуляции дыхания. Налоксон предупреждает тормозные эффекты опиоидных пептидов на дыхание [Яснецов В.В. и др., 1984].
Помимо центрального действия, опиоидныс пептиды влияют и непосредственно на различные структуры аппарата внешнего дыхания. Так, в частности, энкефалины тормозят рефлекторную бронхоконстрикцию, ингибируя освобождение ацетилхолина из постганглионарных парасимпатических нейронов [Russel J. et al., 1985]. Показано наличие μ- и δ-опиатных рецепторов на нейронах, связанных с генерацией дыхательного ритма. Синтетические агонисты μ-рецепторов уменьшают дыхательный объем, но не влияют на частоту дыхания, а агонисты δ-рецепторов уменьшают частоту дыхания, но значительно менее эффективны в отношении дыхательного объема. Угнетение дыхания наблюдается у больных после введения опиатов [Morin-Surin М. et al., 1984]. Предлагаются различные рецепторные механизмы морфинной аналгезии и угнетения дыхания. Показано большое значение μ2-рецепторов по сравнению с δ-рецепторами в угнетающем действии морфина на дыхание [Ling G. et al., 1985].
Изложенные выше данные, по мнению некоторых авторов, свидетельствуют об участии эндогенных опиатов в регуляции дыхания [Воинов В.А., Чиченков О.Н., 1983; Grunstein M. et al., 1981].
Введение налоксона крысам не изменяло активности дыхательного центра, а на фоне неполного гипервентиляционного угнетения дыхательного центра вызывало постепенное увеличение амплитуды залпов ЭМГ диафрагмы до исходного уровня [Воинов В.А., Чиченков О.Н.,1983].
De Boeck и соавт. (1984) не наблюдали влияния налоксона на паттерн дыхания; у здоровых доношенных детей при ингаляции (во время сна) газовой смеси 15 % О2 в азоте вентиляция уменьшалась на 14 % и появлялось периодическое дыха ние. На фоне налоксона уменьшение вентиляции составляло лишь 4 %, периодическое дыхание сохранялось. Таким образом, снижение вентиляции на фоне гипоксемии у доношенных детей частично связано с эндогенными ониатами. J. Stesson и соавт. (1985), исследуя роль эндогенных опиатов в механизме изменений дыхания при физической нагрузке, не обнаружили влияния налоксона на изменение частоты дыхания и объем вентиляции.
Имеющиеся данные о вовлечении эндогенных опиатов в механизмы центральной импульсной активности дыхательных нейронов при гипсрвентиляции, физической нагрузке, хотя и вполне убедительны, все-таки не дают основания для заключения об их роли в регуляции дыхания в норме и механизме угнетения дыхания при боли. В некоторых случаях рефлекторные изменения дыхания при боли имеют приспособительное значение. Так, активация висцеральных афферентных нервов спланхнической области рефлекторно ограничивает диафрагмальное и увеличивает грудное дыхание.
Такие изменения паттерна дыхания наблюдаются при беременности, патологических ситуациях, связанных с раздражением брюшины, и т.п. При абдоминальных расстройствах это ведет к уменьшению подвижности пораженной части живота. При стимуляции грудных висцеральных спинальных аффсрентов уменьшается активность как диафрагмы, так и межреберных мышц, т.е. наблюдается относительная иммобилизация всех частей грудной клетки [Kostrrva et al., 1978; Prabhakar N. et al., 1985].
В клинике важно не только выяснить роль боли в изменении дыхания, оценить значение этих изменений для организма, но и учесть при проведении обезболивающих мероприятий их возможное влияние на дыхание. При нейролептаналгезии наблюдаются угнетение дыхания, уменьшение минутного объема дыхания, развивается ригидность дыхательных мышц. Общеизвестно, что наркотические анальгетики угнетают дыхание, однако морфин в небольших дозах предотвращает развитие вегетативных сдвигов, в том числе и изменений дыхания, характерных для генерализованной аффективной реакции на боль. В то же время, как показали И. Bendexen и соавт. (1964), при введении после операций морфина (по сравнению с плацебо) в дозах, не угнетающих минутную вентиляцию, устраняется развитие спонтанных «вздохов» и тем самым создаются благоприятные условия для развития послеоперационных ателектазов.
Таким образом, клинические и экспериментальные данные свидетельствуют о том, что изменения дыхания являются одним из характерных проявлений реакции организма на болевое раздражение. Эти изменения не являются специфичными, в некоторых случаях имеют приспособительное значение, но могут играть определенную роль в развитии вторичных нарушений внешнего дыхания, в частности в послеоперационном периоде.
