
- •Теория работы
- •Экспериментальная установка
- •Ход выполнения работы
- •Контрольные вопросы
- •Изучение основ работы совмещенного термического анализатора sdt q 600
- •Теория работы
- •Экспериментальная установка
- •Ход выполнение работы
- •Контрольные вопросы
- •Определение коэффициента теплового расширения образца керамики на основе Al2o3.
- •Теория работы
- •Экспериментальная установка
- •Ход выполнение работы
- •Контрольные вопросы
- •Определение элементного состава стали с использование рентгенофлуоресцентного спектрометра arloptim’X количественным методом.
- •Теория работы
- •Экспериментальная установка
- •Ход выполнение работы
- •Контрольные вопросы
- •Определение элементного состава стали с использование оптико-эмиссионного спектрометра количественным методом.
- •Теория работы
- •Экспериментальная установка
- •Ход выполнения работы
- •Контрольные вопросы
- •Качественный рентгенофазовый анализ
- •Теория работы
- •Экспериментальная установка
- •Ход выполнения работы
- •2. Контрольные вопросы.
- •Электронная микроскопия. Растровый ионно-электронный микроскоп Quanta 200 3d. Исследование морфологии и элементного состава кальций-фосфатного покрытия на поверхности титанового имплантата
- •Теория работы
- •Экспериментальная установка
- •Ход выполнения работы
- •Контрольные вопросы
- •Приготовление несамоподдерживающихся образцов для электронной микроскопии
- •Теория работы
- •Ход выполнение работы
- •I. Порядок работы с вакуумной установкой нанесения покрытий на примере получения углеродной аморфной пленки на кристалле k(Na)Cl.
- •Контрольные вопросы
- •Общая юстировка просвечивающего электронного микроскопа Jeol jem-2100
- •Теория работы
- •Экспериментальная установка
- •Выполнение работы
- •Контрольные вопросы
- •Освоение методики измерения удельной поверхности и пористости по методу вет на автоматическом газо- адсорбционном анализаторе ТriStar II 3020.
- •Теория работы
- •Экспериментальная установка
- •Ход выполнение работы
Контрольные вопросы
1. Из каких основных элементов состоит просвечивающий электронный микроскоп?
2. Что представляют собой магнитные линзы микроскопа?
3. Как работает вакуумная система микроскопа?
4. На что следует обратить внимание при подготовке прибора к работе.
5. Перечислите последовательность операций по юстировке микроскопа.
6. Где расположены основные элементы управления микроскопом?
7. Как влияет величина применяемого ускоряющего напряжения на разрешающую способность электронного микроскопа?
Лабораторная работа №10
Освоение методики измерения удельной поверхности и пористости по методу вет на автоматическом газо- адсорбционном анализаторе ТriStar II 3020.
Цель работы: практическое освоение работы газо-адсорбционного анализатора ТriStar II 3020 с использованием стандартного образца силиката Аl, построение изотермы адсорбции.
Литература:
1. Грег С., Синг К. Адсорбция, удельная поверхность, пористость. М.:Мир, 1984 г., - 310 с.
2. Кельцев Н.В. Основы адсорбционной техники. М.:Химия, 1984 г., - 592с.
3. Черемский П.Г. Методы исследования пористых тел. 1985 г.
4. Плаченов Т.Г., Колосенцев С.Д. Порометрия . Л.:Химия, 1988 г.
5. Киселева А.В., Древинга В.П. Экспериментальные методы в адсорбции и молекулярной хроматографии. 1973 г.
Приборы, оборудование
1. Автоматизированная сорбционная установка TriStar 3020.
2. Станция дегазации для подготовки образцов.
3. Аналитические весы.
4. Исследуемые образцы.
Теория работы
Адсорбция (от латинского ad - на, при и sorbio-поглощаю), – явление изменения концентрации вещества вблизи поверхности раздела фаз (в первоначальном значении - конденсация газов на открытых поверхностях). Абсорбция - проникновение молекул газа в объем твердого тела. Адсорбент (сорбент) – твердая фаза, на границе которой с окружающей средой происходит адсорбция. Адсорбат (сорбат) – газообразное или жидкое вещество, которое сорбируется на границе адсорбента. Процесс, обратный адсорбции, называют десорбцией.
Природа адсорбционных сил может быть различной. Если это ван-дер-ваальсовы силы, то адсорбция называется физической, если валентные (т.е. адсорбция сопровождается образованием устойчивых поверхностных химических соединений), - химической, или хемосорбцией. Отличительные черты хемосорбции - необратимость, высокие тепловые эффекты (сотни кДж/моль), активированный характер.
Количество сорбированного газа (сорбата) поверхностью сорбента зависит от размера этой поверхности и давления газа (т.е. концентрации его молекул) в объеме. Зависимость сорбированного количества от давления газа (пара) при постоянной температуре называется изотермой сорбции. Форма изотермы сорбции характеризует морфологию и физико-химические свойства поверхности сорбента, и характер его взаимодействия с сорбатом.
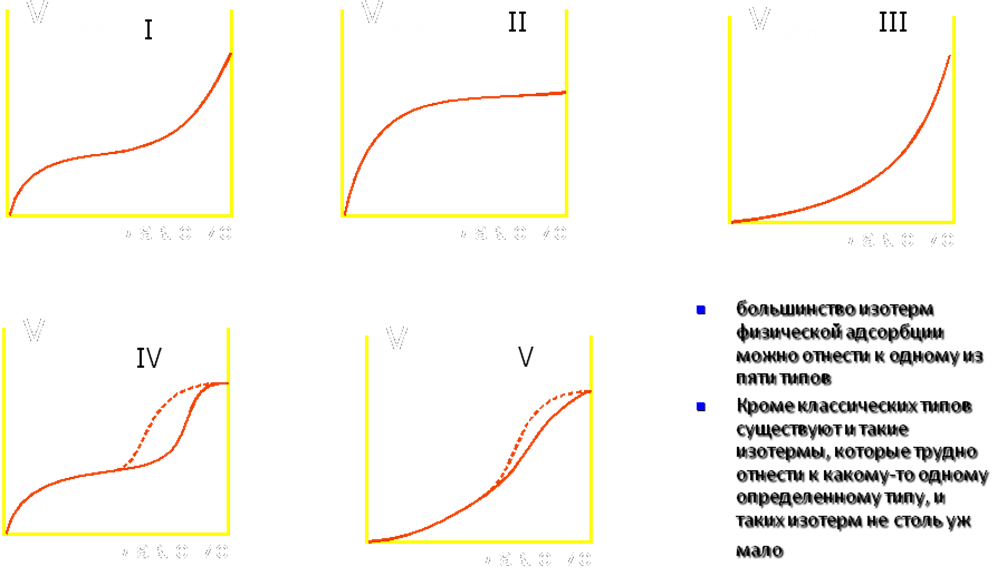
Рис. 72. Основные типы изотерм сорбции по классификации Брунауэра, Деминга, Деминга и Теллера.
Большинство изотерм физической адсорбции можно отнести к одному из пяти типов (рис. 72). Кроме классических типов существуют и такие изотермы, которые трудно отнести к какому-то одному определенному типу, и таких изотерм не столь уж мало.
Принцип измерения количества сорбированного газа объемным методом
Если твердое порошкообразное или пористое вещество помещают в замкнутое пространство, заполненное газом или паром при определенном давлении, твердое вещество начинает адсорбировать газ и его масса возрастает, а давление газа уменьшается. Спустя некоторое время давление становится постоянным, и масса вещества перестает увеличиваться. Если известны объемы сосуда и твердого порошкообразного или пористого вещества, то основываясь на законах идеальных газов, по понижению давления в замкнутом объеме сосуда можно рассчитать количество адсорбированного газа.
Сорбционный метод для изучения степени дисперсности наноматериалов
Удельная поверхность – это общая площадь поверхности раздела между твердой и газообразной фазами в наноматериале, приходящаяся на 1 г твердой фазы. Удельная поверхность образована внешней поверхностью всех частиц наноматериала и внутренней поверхностью открытых пор. Единицы измерения удельной поверхности – м2/г. Чем больше величина удельной поверхности, тем выше степень дисперсности наноматериала.
Изучение адсорбции газов твердыми телами может дать ценную информацию об их удельной поверхности и пористой структуре. Наиболее широко для этой цели в настоящее время используется адсорбция азота при температуре его кипения 77 К (-195.850 оС). Адсорбционным методом можно определять удельные поверхности порошков с частицами размером менее 1 мкм, для которых методы оптической микроскопии непригодны. Если, как это обычно и бывает, размеры частиц порошка соответствуют некоторому интервалу величин, определив удельную поверхность, можно непосредственно оценить средний размер частиц.
Связь удельной поверхности и среднего размера частиц
Удельная поверхность твердого тела данной массы обратно пропорциональна размеру составляющих его частиц. В случае частиц сферической формы и одинакового диаметра d, удельная поверхность Sуд, позволяет рассчитать этот диаметр по формуле (ρ — плотность твердого тела г/см3) :
![]()
Для реальных порошков, составленных из частиц различных размеров и неправильной формы, это соотношение дает возможность оценить среднее значение диаметра частиц.
Например, если Sуд = 20 м2/г, ρ = 3 г/см3, то средний размер составляет d = 100 нм.
Определение удельной поверхности наноматериала
Удельная поверхность Sуд вычисляется из емкости монослоя для данного материала. Емкость монослоя - это количество адсорбата, которое может разместиться в полностью заполненном адсорбционном слое толщиной в 1 молекулу - монослое – на поверхности единицы массы (1г) твердого тела. Из емкости монослоя a∞, выраженной в молях адсорбата в расчете на грамм адсорбента, удельная поверхность как поверхность 1 г твердого тела Sуд вычисляется по уравнению:
Sуд = a∞ ω NA , где
ω – средняя площадь (м2), занимаемая молекулой адсорбата в заполненном монослое, NA - число Авогадро.
Изотермы адсорбции II и IV типа, полученные для данного газа на определенном образце твердого тела, позволяют определить емкость монослоя этого образца. Возможность получения величины емкости монослоя из изотермы адсорбции дает теория адсорбции Брунауэра, Эммета, Теллера. Выведенное авторами уравнение БЭТ привело к замечательному успеху в определении удельной поверхности из изотерм адсорбции.
В большинстве случаев мономолекулярный адсорбционный слой не компенсирует полностью избыточную поверхностную энергию, и влияние поверхностных сил может распространяться на второй, третий и последующие адсорбционные слои. Эта возможность реализуется, когда газы и пары адсорбируются при температурах ниже критической. В этом случае образуются полимолекулярные слои вещества на поверхности адсорбента.
Основные положения теории БЭТ
На поверхности сорбента образуются «последовательных комплексов» адсорбционных центров с одной, двумя, тремя и т. д. молекулами адсорбата. Тогда процесс адсорбции можно представить в виде последовательных квазихимических реакций:
S+A=SA; SA+A=SA2; SA2+A=SA3; и т.д
Константы равновесия этих реакций соответственно равны
![]()
![]()
![]()
где ао — концентрация свободных адсорбционных центров. Авторы теории БЭТ приняли, что во всех слоях, кроме первого, молекулы адсорбата взаимодействуют между собой так же, как и при конденсации. Поэтому было принято, что
![]()
Уравнение БЭТ
Суммарная величина адсорбции (а) компонента А складывается из общего числа комплексов с участием молекул сорбата. С учетом того, что в комплексах участвует разное число молекул компонента, адсорбция равна:
a = [SA]+2[SA2]+3[SA3]+…
При суммировании получается следующее уравнение:
![]()
где используется обозначение С=Кр/ps (Кр – константа связывания в первом адсорбционном слое). При обработке экспериментальных результатов уравнение БЭТ обычно используют в линейной форме:
![]()
Наиболее распространено измерение удельной поверхности по методу БЭТ на основании низкотемпературной сорбции паров азота. В этом случае уравнение БЭТ хорошо описывает экспериментальные изотермы до относительного давления паров азота р/рs=0.35. Площадь молекулы азота в адсорбционном слое составляет 0,162 нм2.
