
- •Теория работы
- •Экспериментальная установка
- •Ход выполнения работы
- •Контрольные вопросы
- •Изучение основ работы совмещенного термического анализатора sdt q 600
- •Теория работы
- •Экспериментальная установка
- •Ход выполнение работы
- •Контрольные вопросы
- •Определение коэффициента теплового расширения образца керамики на основе Al2o3.
- •Теория работы
- •Экспериментальная установка
- •Ход выполнение работы
- •Контрольные вопросы
- •Определение элементного состава стали с использование рентгенофлуоресцентного спектрометра arloptim’X количественным методом.
- •Теория работы
- •Экспериментальная установка
- •Ход выполнение работы
- •Контрольные вопросы
- •Определение элементного состава стали с использование оптико-эмиссионного спектрометра количественным методом.
- •Теория работы
- •Экспериментальная установка
- •Ход выполнения работы
- •Контрольные вопросы
- •Качественный рентгенофазовый анализ
- •Теория работы
- •Экспериментальная установка
- •Ход выполнения работы
- •2. Контрольные вопросы.
- •Электронная микроскопия. Растровый ионно-электронный микроскоп Quanta 200 3d. Исследование морфологии и элементного состава кальций-фосфатного покрытия на поверхности титанового имплантата
- •Теория работы
- •Экспериментальная установка
- •Ход выполнения работы
- •Контрольные вопросы
- •Приготовление несамоподдерживающихся образцов для электронной микроскопии
- •Теория работы
- •Ход выполнение работы
- •I. Порядок работы с вакуумной установкой нанесения покрытий на примере получения углеродной аморфной пленки на кристалле k(Na)Cl.
- •Контрольные вопросы
- •Общая юстировка просвечивающего электронного микроскопа Jeol jem-2100
- •Теория работы
- •Экспериментальная установка
- •Выполнение работы
- •Контрольные вопросы
- •Освоение методики измерения удельной поверхности и пористости по методу вет на автоматическом газо- адсорбционном анализаторе ТriStar II 3020.
- •Теория работы
- •Экспериментальная установка
- •Ход выполнение работы
Контрольные вопросы
В чем заключается принцип действия рентгенофлуоресцентного анализа?
Какие явления происходят при взаимодействии первичного рентгеновского излучения с образцом?
Что называют выходом флюоресценции?
Что называют матричным эффектом?
Какие основные эффекты межэлементных влияний встречаются?
Лабораторная работа № 5
Определение элементного состава стали с использование оптико-эмиссионного спектрометра количественным методом.
Цель работы: определить элементный состав стали.
Литература:
Терек Т., Мика Й., Гелуш Э. Эмиссионный спектральный анализ пер. с англ., ч. 1-2, М., 1982.
Дробышев А.И. Основы спектрального анализа: учеб. пособие/А.И. Дробышев. – С.Пб.: Изд-во СПбГУ, 1997. – 198с.
Зайдель А.Н. основы спектрального анализа /А.Н. Зайдель. -. М.: Наука, 1965. – 322с.
Приборы, оборудование
1. Оптико-эмиссионный спектрометр Foundry-Master 01L0107.
2. Образец стали.
Теория работы
Оптический эмиссионный спектральный анализ (ОЭСА) – один из наиболее распространенных методов анализа элементного состава материалов. Важнейшие достоинства ОЭСА – его быстрота (экспрессность) наряду с высокой точностью и низкими пределами обнаружения, низкая себестоимость, простота пробоподготовки. Основные области применения – анализ состава металлов и сплавов в металлургии и машиностроении.
ОЭСА основан на получении и детектировании линейчатого спектра, испускаемого в процессе излучательной релаксации электронов, которые претерпевают переход между верхними возбужденными уровнями и более низкими и основным уровнями. Эти электроны принадлежат внешним оболочкам атома и называются оптическими электронами. Линейчатый спектр специфичен для данного элемента, поэтому надлежащий выбор данной линии и ее выделение с помощью диспергирующей системы позволяет аналитику проверить присутствие этого элемента и определить его концентрацию. Оптико-эмиссионный спектрометр состоит из источника излучения, системы введения пробы, оптической диспергирующей системы, детектора и электроники для сбора, обработки и представления данных. Каждый элемент периодической системы имеет определенное число электронов, равное его атомному номеру. Электроны с определенной вероятностью расположены на уровнях и подуровнях вокруг ядра в соответствии с квантовой теорией. Квантовая теория была создана Планком, который предположил, что электромагнитная энергия поглощается или испускается дискретно; это означает, что энергия не непрерывна. Энергетическое состояние каждого электрона в свободном атоме характеризуется четырьмя квантовыми числами.
1.
Главное квантовое число ![]() (
(![]() для атомов в основном состоянии)
соответствует уровням, обозначаемым
для атомов в основном состоянии)
соответствует уровням, обозначаемым
![]() .
.
2.
Квантовое число орбитального углового
момента ![]()
![]() соответствует подуровням
соответствует подуровням ![]() (названным по начальным буквам английских
терминов sharp,
principal,
diffuse
и fundamental).
(названным по начальным буквам английских
терминов sharp,
principal,
diffuse
и fundamental).
3.
Орбитальное магнитное квантовое число
![]() (любое целое, удовлетворяющее условию
(любое целое, удовлетворяющее условию
![]() ).
).
4.
Спиновое квантовое число ![]()
![]() .
.
Максимальное
число электронов в подуровне определяется
принципом Паули, согласно которому два
электрона не могут иметь одинаковые
все четыре квантовых числа. Это означает,
что максимальное число электронов в
подуровне и уровне составляет ![]() и
и ![]() соответственно, т. е. для подуровней
соответственно, т. е. для подуровней ![]() максимальное число электронов равно
2, 6, 10 и 14 соответственно. Рассмотрим
некоторые примеры: для А1 и Мо число
электронов равно 13 и 42 соответственно.
Электроны, рассматриваемые в ОЭС
(оптические электроны) расположены на
внешних подуровнях, такие, как электроны
с
максимальное число электронов равно
2, 6, 10 и 14 соответственно. Рассмотрим
некоторые примеры: для А1 и Мо число
электронов равно 13 и 42 соответственно.
Электроны, рассматриваемые в ОЭС
(оптические электроны) расположены на
внешних подуровнях, такие, как электроны
с ![]() и
и ![]() для А1,
для А1, ![]() и
и ![]() для Мo.
Электронная конфигурация AI может быть
записана как Is22s22p63s23p1. Если свободный
атом алюминия не поглощает энергии, его
оптические электроны расположены на
подуровне
.
Это состояние с наименьшей энергией,
или основное состояние. Энергия основного
состояния по договоренности принимается
равной нулю
для Мo.
Электронная конфигурация AI может быть
записана как Is22s22p63s23p1. Если свободный
атом алюминия не поглощает энергии, его
оптические электроны расположены на
подуровне
.
Это состояние с наименьшей энергией,
или основное состояние. Энергия основного
состояния по договоренности принимается
равной нулю ![]() .
Когда свободный атом поглощает энергию,
внешнюю (столкновения) или внутреннюю
(излучение), электрон переходит на более
удаленные от ядра уровни и подуровни,
т. е. квантовые состояния с более высокой
энергией (
.
Когда свободный атом поглощает энергию,
внешнюю (столкновения) или внутреннюю
(излучение), электрон переходит на более
удаленные от ядра уровни и подуровни,
т. е. квантовые состояния с более высокой
энергией (![]() ...).
Это так называемые возбужденные
состояния. Для конкретной электронной
конфигурации атом в целом может быть
охарактеризован квантовым числом
...).
Это так называемые возбужденные
состояния. Для конкретной электронной
конфигурации атом в целом может быть
охарактеризован квантовым числом ![]() .
Значение
.
Значение ![]() обычно находят, используя схему связи
Рассела—Саундерса. Вектор
обычно находят, используя схему связи
Рассела—Саундерса. Вектор ![]() получают суммированием векторов
различных электронов, а вектор
— аналогично суммированием s-векторов.
Получаем:
получают суммированием векторов
различных электронов, а вектор
— аналогично суммированием s-векторов.
Получаем:
![]() , (1)
, (1)
называют полным электронным угловым моментом. Квантовое число для полного электронного углового момента принимает целые или полуцелые значения. Каждому уровню соответствует определенная энергия и квантовое число . Если поглощенная энергия слишком велика, то электрон не принадлежит атому, атом ионизируется. Существует основное состояние для иона, 3s2, и более высокие возбужденные уровни, такие, как 3р.
Когда электрон возвращается в нижнее или основное состояние, то дезактивация может происходить по механизму излучения или столкновения.
В
случае излучательной дезактивации
происходит испускание электромагнитного
излучения. Если переход происходит
между верхним уровнем ![]() и нижним уровнем
и нижним уровнем ![]() ,
частота испускаемого излучения ν
определяется уравнением:
,
частота испускаемого излучения ν
определяется уравнением:
![]() , (2)
, (2)
где
![]() — постоянная Планка. В ОЭС вместо частоты
обычно используют длину волны λ в
соответствии с соотношением
— постоянная Планка. В ОЭС вместо частоты
обычно используют длину волны λ в
соответствии с соотношением
![]() , (3)
, (3)
где
![]() —скорость света (с = 299792458 м/с). Длину
волны привыкли выражать в ангстремах,
хотя ее следует выражать в нм. Соотношение
—скорость света (с = 299792458 м/с). Длину
волны привыкли выражать в ангстремах,
хотя ее следует выражать в нм. Соотношение
![]() является основным уравнением в эмиссионной
спектрометрии и подтверждает связь
между энергией и длиной волны.
является основным уравнением в эмиссионной
спектрометрии и подтверждает связь
между энергией и длиной волны.
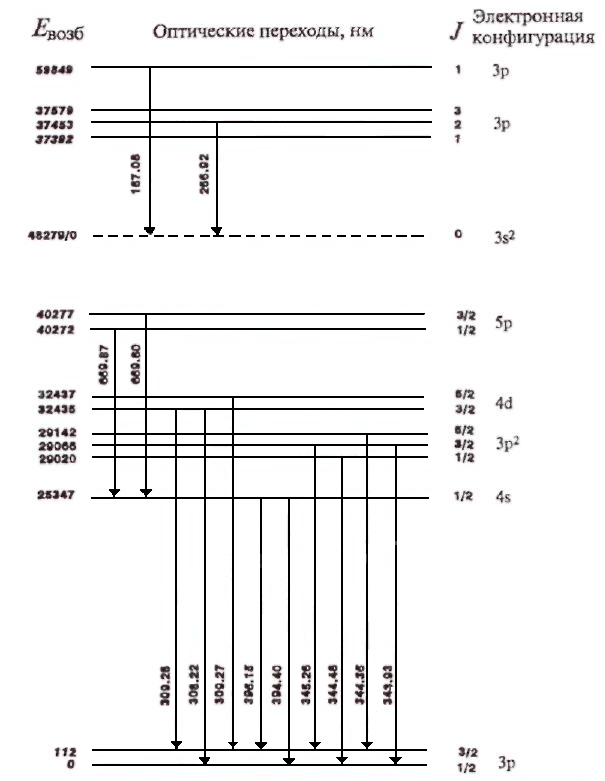
Рис. 29. Примеры основных и возбужденных состояний атома (внизу) и иона (наверху) Al; энергии возбуждения Евозб (см-1) отсчитываются от основного состояния атома либо иона; показаны возможные оптические переходы.
Не каждый переход между любыми возможными уровнями разрешен. Некоторые переходы запрещены. Разрешенные переходы должны удовлетворять правилам отбора; первое из них:
![]() . (4)
. (4)
Следует
заметить, что переход ![]() запрещен. Второе правило — это изменение
четности. Символ I
используют для линий, испускаемых
атомами, символ II
— для линий, испускаемых однократно
ионизированными атомами, символ III
—для линий, испускаемых двукратно
ионизированными атомами и т. д.
запрещен. Второе правило — это изменение
четности. Символ I
используют для линий, испускаемых
атомами, символ II
— для линий, испускаемых однократно
ионизированными атомами, символ III
—для линий, испускаемых двукратно
ионизированными атомами и т. д.
Линия, соответствующая переходу в основное состояние, называется резонансной линией.
Например,
при рассмотрении 3d-
и Зр-уровней
атома алюминия, переходы с
разрешены из-за изменения четности.
Переходы ![]() и
и ![]() разрешены (
соответственно) в отличие от переходов
разрешены (
соответственно) в отличие от переходов
![]() (
(![]() ).
Следует отметить, что переход,
соответствующий возврату электрона в
основное (
).
Следует отметить, что переход,
соответствующий возврату электрона в
основное (![]() )
или квазиосновное
(
)
или квазиосновное
(![]() )
состояния называются резонансными
переходами,
приводящими к резонансным линиям.
Примерами резонансных линий являются
Al I
396,15 нм, Al I
394,40 нм, Al
I
308,22 нм и Al
I
309,27 нм. Аналогично можно описать
разрешенные и запрещенные переходы для
однократно ионизированного атома
алюминия. Примерами разрешенных линий
являются А1 II
167,08 нм и А1 II
266,92 нм. В соответствии с правилами отбора
и возможными возбужденными уровнями
каждый элемент периодической системы
может проявлять набор линий (спектр),
специфичный для этого элемента. Это
объясняет, почему комбинации линий
элемента позволяет провести качественный
анализ.
)
состояния называются резонансными
переходами,
приводящими к резонансным линиям.
Примерами резонансных линий являются
Al I
396,15 нм, Al I
394,40 нм, Al
I
308,22 нм и Al
I
309,27 нм. Аналогично можно описать
разрешенные и запрещенные переходы для
однократно ионизированного атома
алюминия. Примерами разрешенных линий
являются А1 II
167,08 нм и А1 II
266,92 нм. В соответствии с правилами отбора
и возможными возбужденными уровнями
каждый элемент периодической системы
может проявлять набор линий (спектр),
специфичный для этого элемента. Это
объясняет, почему комбинации линий
элемента позволяет провести качественный
анализ.
У атома алюминия 46 электронных уровней ниже потенциала ионизации, соответствующие примерно 118 линиям в диапазоне 176-1000 нм. Для однозарядного иона А1 существует 226 уровней, они дают примерно 318 линий в диапазоне 160-1000 нм. Частицы А1 I и А1 II испускают относительно простые спектры, т. е. с ограниченным числом линий. В таком же диапазоне длин волн уран может испускать несколько десятков тысяч линий, что приводит, вероятно, к наиболее сложному из наблюдаемых спектров. Однако если резонансные линии можно наблюдать в любом источнике излучения, то линии, возникающие из высоковозбужденных состояний, можно наблюдать только с высокотемпературными источниками излучения или при специальных условиях возбуждения.
Излучение, испускаемое пробой, в которой имеются все компоненты за исключением определяемого элемента, называют фоновым излучением. Оно состоит из линий, испускаемых другими (сопутствующими) элементами и континуума, возникающего из неквантуемых переходов.
Количественный анализ возможен, если интенсивность линии можно связать с концентрацией испускающих частиц. Интенсивность линии пропорциональна:
1) разности энергий верхнего ( ) и нижнего ( ) уровней перехода;
2)
электронной заселенности (![]() )
верхнего уровня (
);
)
верхнего уровня (
);
3) числу возможных переходов между энергией и в единицу времени. Эта величина выражается вероятностью перехода А; ее определение дано Эйнштейном.
Таким образом, интенсивность линии можно выразить соотношением
![]() . (5)
. (5)
Интенсивность линии пропорциональна концентрации атомов. В эмиссионной спектрометрии проводят только относительный количественный анализ с использованием образцов сравнения с известной концентрацией определяемого элемента(ов). Когда источник излучения достаточно стабилен и сохраняет постоянную температуру, статистическая сумма по состояниям Z будет оставаться постоянной и число атомов (ионов) N будет пропорционально концентрации с. Для данной линии определяемого элемента , А, X и постоянны. Следовательно, интенсивность линии I пропорциональна с, что позволяет проводить количественное определение. В относительном количественном анализе используют ряд образцов сравнения для построения градуировочного графика, т. е. зависимости интенсивности от концентрации определяемого элемента. Интенсивность линии определяемого элемента в неизвестной пробе используют для нахождения его концентрации по градуировочному графику. Теоретически возможно выполнить также абсолютный количественный анализ, т. е. анализ без использования процедуры градуировки. Однако абсолютный количественный анализ требует знания температуры, телесного угла испускания и т. д. Эти измерения в рутинном анализе осуществить нелегко. Следует отметить, что в случае постоянной концентрации определяемого элемента, любые малые изменения характеристик источника излучения могут приводить к изменениям температуры и последующим изменениям интенсивности линии из-за изменения заселенности возбужденного уровня. Это объясняет, почему для получения хорошей воспроизводимости и сходимости, а также во избежание дрейфа аналитического сигнала, требуется высокая стабильность источника. В атомно-эмиссионной спектрометрии источник фактически играет двоякую роль: первый этап состоит в атомизации анализируемой пробы с целью получить свободные атомы, обычно в основном состоянии; второй — в возбуждении атомов в более высоколежащие энергетические состояния. Идеальный источник для эмиссионной спектрометрии должен проявлять отличные аналитические и инструментальные характеристики. Аналитические характеристики включают число элементов, которые могут быть определены, правильность и воспроизводимость, селективность, отсутствие физических и химических помех, долговременную стабильность, концентрационный динамический диапазон и пределы обнаружения. Более того, эмиссионная система должна быть способна работать с пробами любого типа, независимо от их формы (жидкой, твердой или газообразной), с возможностью использовать ограниченное количество пробы. Инструментальные характеристики, представляющие интерес, включают простоту работы и обслуживания, автоматизацию, производительность, надежность и размеры системы
Принцип действия оптического эмиссионного спектрометра достаточно прост. Он основан на том, что атомы каждого элемента могут испускать свет определенных длин волн - спектральные линии, причем эти длины волн разные для разных элементов. Для того чтобы атомы начали испускать свет, их необходимо возбудить – нагреванием, электрическим разрядом, лазером или каким-либо иным способом. Чем больше атомов данного элемента присутствует в анализируемом образце (пробе), тем ярче будет излучение соответствующей длины волны.
Интенсивность спектральной линии анализируемого элемента, помимо концентрации анализируемого элемента, зависит от большого числа различных факторов. По этой причине рассчитать теоретически связь между интенсивностью линии и концентрацией соответствующего элемента невозможно. Вот почему для проведения анализа необходимы стандартные образцы, близкие по составу к анализируемой пробе. Предварительно эти стандартные образцы экспонируются (прожигаются) на приборе. По результатам этих прожогов для каждого анализируемого элемента строится градуировочный график, т.е. зависимость интенсивности спектральной линии элемента от его концентрации. Впоследствии, при проведении анализа проб, по этим градуировочным графикам и производится пересчет измеренных интенсивностей в концентрации.
