
- •1. Види науково обґрунтованих класифікацій та номенклатури, що враховують як будову карбонового ланцюга, так і наявність у молекулі певних функціональних груп.
- •2. Ізомерія в органічних сполуках. Просторова будова органічних
- •2)Положения
- •3)Взаємного положення в кільці
- •1. Геометрична :
- •2. Оптична (дзеркальна)
- •3. Поворотна ізомерія ( конформація)
- •4. Динамічна ізомерія
- •4. Загальна характеристика хімічних реакцій біоорганічних сполук.
- •5. Характеристика нуклеофілів та електрофілів.
- •6. Багатоатомні спирти. Будова, номенклатура та ізомерія фенолів, амінів.
- •1. Радикальні заміщення біля насиченого атома Карбону (sr).
- •2. Електрофільне приєднання до ненасичених сполук (ae).
- •3. Електрофільне заміщення в ароматичних сполуках (se).
- •4. Вплив замісників на реакційну здатність аренів.
- •5. Вуглеводні . Алкани, алкени, арени .
- •6. Багатоатомні спирти. Будова, номенклатура та ізомерія фенолів, амінів. ( спрс ).
- •1.Феноли.
- •1.Реакції нуклеофільного приєднання (an) до оксосполук.
- •2.Вплив нуклеофілу на утворення з альдегідами і кетонами нових зв'язків: c-о, с-с, с- н, с- n.
- •3.Альдольна конденсація та її значення для подовження карбонового ланцюга.
- •4.Окиснення альдегідів і кетонів.
- •5. Медико-біологічне значення альдегідів і кетонів. ( спрс).
- •1.Класифікація карбонових кислот, окремі представники монокарбонових кислот.
- •2. Реакції нуклеофільного заміщення (sn) біля sp2- гібридизованого
- •3. Вищі жирні кислоти (вжк) як складові нейтральних ліпідів. Будова
- •5. Функціональні похідні карбонових кислот. ( спрс)
- •1. Хімічні властивості та біологічне значення гідрокси- та амінокислот.
- •1. Класифікація гідроксикислот:
- •2. Біологічне значення кетокислот та їх похідних. Кетонові тіла, діагностичне значення, їх визначення при цукровому діабеті.
- •3. Фенолокислоти та їх похідні. Використання саліцилової кислоти та її похідних у медицині (метилсаліцилат, салол, аспірин, саліцилати натрію) у вигляді лікарських засобів.
- •1. Класифікація амінокислот за будовою карбонового ланцюга, здатністю до синтезу в організмі та полярністю радикала.
- •2. Хімічні властивості а-амінокислот. Реакції поліконденсації з утворенням пептидів. Якісні реакції на α-амінокислоти, пептиди, білки.
- •1. Аліфатичні сполуки зі змішаними функціями
- •1. Класифікація вуглеводів. Таутомерні форми моносахаридів.
- •2. Утворення глікозидів, їхня роль у побудові оліго- та полісахаридів, нуклеозидів. Нуклеотидів та нуклеїнових кислот. Аскорбінова кислота як похідне гексоз, біологічна роль вітаміну с.
- •3. Класифікація дисахаридів за здатністю до окисно-відновних реакцій. Два типи зв'язків між залишками моносахаридів та їх вплив на реакційну здатність дисахаридів.
- •4. Будова, біологічна роль та застосування крохмалю, його складові.
- •5. Структура вуглеводів. (спрс).
- •1. Класифікація гетероциклів за розмірами циклу, кількістю та
- •2. Пятичленні гетероцикли з одним та двома гетероатомами та їхні
- •3. Бензпірол (індол) як складова триптофану та продуктів його перетворення — біологічно активних сполук (триптамін, серотонін) та токсичних речовин (скатол, індол) і продукти їхньою знешкодження.
- •4 Шестичленні гетероцикли з одним та двома гетероатомами -основа
- •5. Лікарські засоби на основі гетероциклічних сполук.( спрс).
- •1. П’ятічленні гетероциклічні сполуки з одним гетероатомом.
- •2. П’ятічленні гетероциклічні сполуки з двома гетероатомами.
- •3. Шестичленні гетероцикли з двома гетероатомами.
- •1. Нуклеозиди та нуклеотиди — продукти неповного гідролізу нуклеїнових кислот. ( спрс)
- •2. Нуклеїнові кислоти — полінуклеотиди, біополімери, що зберігають, передають спадкову інформацію та беруть участь у біосинтезі білка.
- •3. Вільні нуклеотидів (коферменти)— амф, адф, атф, над . Н. Будова та значення 3’,5'-ц-амф, його роль у дії гормонів на клітини.
1.Класифікація карбонових кислот, окремі представники монокарбонових кислот.
Карбонові кислоти - похідні ВВ, в яких один або декілька атомів водню заміщено на карбоксильну групу. Загальна формула : R – (COOH)n .
Карбонові кислоти

За будовою радикала (R) За кількістю функційних груп (-СООН)
Насичені: СН3СООН Монокарбонові: Н – СООН Мурашина
Уксусна (етанова) (метанова) кислота
СН3 – СН2 – СООН СН3 – СН2 – СН2 - СООН
Пропановая Масляна (бутанова) кислота
СООН
Ненасичені : Н2С = СН – СООН Дикарбонові : |
Акриловая (пропеновая) СООН СН2
| |
А роматичні:
- СООН
СООН СООН
роматичні:
- СООН
СООН СООН
Щавелева малонова
(етандіова) (пропандіова)
Бензойна кислота Трикарбонові : СООН
|
СН2
|
НО – С – СООН Лимонна кислота
|
СН2
|
СООН
Для карбонових кислот не характерні ні альдегідні, ні спиртові властивості.
Особливістю електронної будови є те, що зв'язок О - Н в гідроксогрупі
Ослаблений і атом водню легко відщеплюється у вигляді іона Н+. Тому саме гідроксогрупа бере участь майже у всіх реакціях : вона або заміщається, або дисоціює за кислотним типом. А карбонільній ( - С= О ) активність не характерна. Вся карбоксильна група впливає на радикал, особливо на атоми водню сусіднього з функціональною групою і атоми водню в ній особливо рухомі.
Номенклатура : додавання до ВВ закінчення -ова кислота, якщо « -СООН» дві, закінчення - «-діова», якщо три, то - «-тріова» .
Окремі представники монокарбонових кислот і їх значення.
Мурашина ( метанова) кислота НСООН - рідина з різким запахом і температурою кипіння 100,80С, добре розчина у воді. Мурашина ( метанова) кислота отруйна, при попаданні на шкіру викликає опіки! Жаляча рідина виділяєма мурашками, містить цю кислоту. Кислота володіє дезинфікуючою властивістю і тому знаходить застосування в харчовій, шкірній, фармацевтичній промисловості і в медицині. Оскільки в мурашиній кислоті немає ВВ радикала то вона є найбільш сильною серед своїх гомологів.
У молекулі мурашиної ( метановою) кислоти можна виділити альдегідну групу:
О
║
Н – С – ОН поэтому она вступает в реакции характерные и альдегидам:
легко окисляется , пример, реакция «серебрянного зеркала» :
тому вона вступає в реакції характерні і альдегідам:
легко окислюється, приклад, реакція «срібного дзеркала» :
О
║ NH4OH
Н - С - ОН + Ag2О → CO2↑ + H2O + 2Ag↓
t
Оцтова (етанова) кислота СН3СООН - безбарвна рідина з різким запахом
змішується з водою. Водні розчини поступають в продаж під назвою оцту (3-5%-ний розчину) і оцтової есенції ( 70-80%). Широко застосовується в промисловості - при фарбуванні, в шкіряній, в харчовій ; на її основі отримують - гербіциди – речовини для боротьби з бур'янами.
Найважливішими представниками є пальмітинова С15Н31СООН і стеаринова С17Н35СООН вищі кислоти (ВЖК). Вони тверді, погано розчині у воді. Проте їх солі з Na та K - стеарати і пальмітати- добре розчині і володіють миючою дією, тому їх часто називають милом. Їх проводять у величезних масштабах.
З ненасичених (ВЖК) найбільше значення має олеїнова кислота С17Н33СООН
або СН3 – (СН2)7 – СН = СН – (СН2)7 – СООН. Олієподібна рідина без смаку і запаху.
- СООН
Бензойна кислота - широко використовується як консервант
у харчовій промисловості і як антисептичний засіб
у медицині.
Будова та властивості дикарбонових кислот.
Двуосновні карбонові кислоты (дикарбонові). Загальна формула R – (COOH)2.
НАСИЧЕНІ кислоти:
СООН Етандіова
| ( Щавелева )
СООН
СООН Пропандіова
| (малонова)
СН2
|
СООН
СООН Бутандіова
| (Бурштинна)
СН2
|
СН2
|
СООН
СООН Пентандіова
| (Глутарова)
СН2
|
СН2
|
СН2
|
СООН
СООН Гександіова
| (Адипінова)
( СН2 )4
|
СООН
НЕНАСИЧЕНІ кислоти :
НООС-С-Н Н-С-СООН
║ ║
Н-С-СООН Н-С-СООН
Транс-бутен 2- діова Цис-бутен 2- діова
(фумарова) (малеінова)
АРОМАТИЧНІ кислоти :
- СООН
- СООН
о- фенілендікарбонова кислота
(фталіева)
Фізичні і хімічні властивості дикарбонових кислот
Всі дикарбонові кислоти є тверді кристалічні речовини, розчинні у воді.
Двоосновні карбонові кислоти сильніші, ніж одноосновні з тим же числом атомів вуглецю. Кислотність двоосновних кислот тим вище, чим коротше ланцюг атомів вуглецю, що зв'язують карбоксильні групи. Відповідно до цього щавлева кислота найсильніша з двоосновних кислот.
Двоосновні кислоти вступають в ті ж реакції, які властиві і одноосновним кислотам. Володіючи двома карбоксильними групами, двоосновні кислоти дають два ряди похідних, в утворенні яких беруть участь один карбоксил або два. Так, двоосновні кислоти дають солі :
1) Соли
 О
О
О
О
 С
С
С
С
ОNa ONa
| кислі | основні
 O
O
O
O
C C
OH ONa
2) Эфіри
О О
С С
ОСН3 OСН3
| кислі | повні
O O
C C
OH OСН3
3) Аміди
О О
С С
NH2 NH2
| неповні | повні
O O
C C
OH NH2
Крім того існують реакції, характерні тільки для двоосновних кислот:
А) виділення з одного карбоксилу СО2 і перетворенням на одноосновну
 О О
О
О О
О
С - С → СО2↑ + Н - С
Н О О Н ОН
Щавелева мурашина
Б) Утворення з дикарбонових їх циклічних похідних
О О

 Н2С - С
Н2С – С
Н2С - С
Н2С – С
ОН
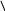 Н2С → Н2О
+ Н2С О
Н2С → Н2О
+ Н2С О
О
Н2С С Н2С – С
ОН О-
Глутарова Ангидрід глутарової
Біологічне значення карбонових кислот
Низькомолекулярні карбонові кислоти (їх активовані форми) є проміжними продуктами розпаду білків, жирів і вуглеводів в організмі людини. Так, наприклад, оцтова кислота - у вигляді ацетил - КоА - є проміжним продуктом розпаду жирів і вуглеводів. Монокарбонові кислоти з різною довжиною вуглецевого ланцюга утворюються в організмі людини в процесі β -окиснення. Через стадії Ди- і три- карбонових кислот (цикл Кребса) йде розпад білків, жирів, вуглеводів до кінцевих продуктів (СО2+Н2О) з виділенням енергії.
Вищі жирні кислоти(пальмітинова, стеаринова, олеїнова, лінолева, ліноленова, арахідонова) є структурними компонентами жирів і фосфоліпідів, причому жирні кислоти, які не можуть бути біологічно синтезовані в необхідних кількостях в організмі людини, але які потрібні для нормального зростання, розвитку і функціонування, отримали назву «есенціальних» або незамінних, жирних кислот. До них відносяться ненасичені жирні кислоти; їх часто об'єднують під назвою «вітамін F». Есенціальні жирні кислоти С20 йдуть на побудову важливих, біологічно активних речовин в нашому організмі -простагландінов (РG), тромбоксанів, лейкотрієнів, що грають важливу роль в процесах життєдіяльності організму людини. Заготівка крові про запас здійснюється за допомогою лимонної кислоти, яка зв'язує іони кальцію в розчинну сіль і запобігає згортанню крові («цитратна кров» на станціях переливання крові ).
