
- •Рецензент:
- •Лабораторная работа № 1 Тема: методы очистки и выделения органических соединений
- •1.1 Общая характеристика методов очистки и выделения органических соединений
- •1.2 Кристаллизация
- •1.2.1 Теоретическая часть
- •1.2.2 Экспериментальная часть
- •1.3 Возгонка (сублимация)
- •1.3.1 Теоретическая часть
- •1.3.2 Экспериментальная часть
- •1.4 Перегонка
- •1.4.1 Теоретическая часть
- •1.4.2 Экспериментальная часть
- •1.5 Экстракция
- •1.5.1 Теоретическая часть
- •1.5.2 Экспериментальная часть
- •1.6 Контрольные вопросы
- •Лабораторная работа № 2 Тема: алканы Цель работы: изучение методов получения и химических свойств алканов.
- •2.1 Теоретическая часть
- •2.1.1 Методы получения
- •2.1.2 Химические свойства
- •2.2 Экспериментальная часть
- •2.2.1 Получение метана и изучение его свойств
- •2.2.2 Бромирование предельных углеводородов
- •2.2.3 Окисление предельных углеводородов
- •2.2.4 Действие концентрированной серной кислоты на предельные углеводороды
- •2.2.5 Действие концентрированной азотной кислоты на предельные углеводороды
- •2.3 Контрольные вопросы
- •Лабораторная работа № 3 Тема: алкены
- •3.1 Теоретическая часть
- •3.1.1 Методы получения
- •3.1.2 Химические свойства
- •5. Окисление перманганатом калия в нейтральной или слабощелочной среде приводит к образованию гликолей.
- •Реакция часто применяется для определения положения двойной связи в молекуле, так как по образующимся карбонильным соединениям можно представить себе и строение исходного алкена.
- •3.2 Экспериментальная часть
- •3.2.1 Получение этилена и его горение
- •3.2.2 Присоединение к этилену брома
- •3.2.3 Отношение этилена к окислителям
- •3.2.4 Бромирование непредельных углеводородов
- •3.2.6 Действие концентрированной серной кислоты на непредельные углеводороды
- •3.2.7 Действие концентрированной азотной кислоты на непредельные углеводороды
- •3.3 Контрольные вопросы
- •Лабораторная работа № 4 Тема: алкины
- •4.1 Теоретическая часть
- •4.1.1 Методы получения
- •4.1.2 Химические свойства
- •А. Реакции присоединения
- •5. Присоединение спиртов. В присутствии едкого кали под давлением ацетилен присоединяет спирты с образованием алкилвиниловых эфиров:
- •4.2 Экспериментальная часть
- •4.3 Контрольные вопросы
- •Лабораторная работа № 5 Тема: ароматические углеводороды (арены)
- •5.1 Теоретическая часть
- •5.1.1 Методы получения
- •5.1.2 Химические свойства
- •Классификация реакций замещения. При замещении в бензольном кольце возможны три типа реакций в зависимости от природы атакующей частицы.
- •3. Электрофильное замещение.
- •5.2 Экспериментальная часть
- •5.2.1 Окисление ароматических углеводородов
- •5.2.2 Бромирование ароматических углеводородов
- •5.2.3 Нитрование ароматических углеводородов
- •5.2.4 Сульфирование ароматических углеводородов
- •5.2.5 Алкилирование бензола.
- •5.3 Контрольные вопрсы
- •Лабораторная работа №6 Тема: спирты
- •6.1 Теоретическая часть
- •6.1.1 Методы получения
- •6.1.2 Химические свойства спиртов
- •1. Взаимодействие с щелочными металлами:
- •6.2 Экспериментальная часть
- •6.2.1 Определение строения спиртов
- •6.2.2 Обнаружение воды в спирте и обезвоживание спирта
- •6.2.3 Свойства изоамилового спирта
- •6.2.4 Отношение спиртов к индикаторам
- •6.2.5 Образование и гидролиз алкоголятов
- •6.2.6 Взаимодействие глицерина с гидроксидом меди (II)
- •6.2.7 Окисление этилового спирта окисью меди
- •6.2.8 Окисление спиртов хромовой смесью
- •6.2.9 Окисление этилового спирта раствором перманганата калия
- •6.2.10 Взаимодействие изоамилового спирта с серной кислотой
- •6.2.11. Получение диэтилового эфира
- •6.3 Контрольные вопросы
- •Лабораторная работа №7 Тема: фенолы
- •7.1 Теоретическая часть
- •7.1.1 Методы получения
- •Кумольный способ:
- •Сплавление солей сульфокислот с гидроксидом натрия:
- •7.1.2 Химические свойства
- •9. При сульфировании фенолов получаются о- и п-фенолсульфокислоты:
- •10. Фенолы легко конденсируются с альдегидами:
- •7.2 Экспериментальная часть
- •7.2.1 Растворение фенола в воде
- •7.2.2 Получение фенолята натрия
- •7.2.3 Разложение фенолята натрия кислотами
- •7.2.4 Реакция фенола с хлорным железом
- •7.2.5 Получение трибромфенола
- •7.2.6 Сульфирование фенола
- •7.2.7 Нитрование фенола
- •7.2.8 Нитрозореакция фенолов
- •7.2.9 Цветные реакции многоатомных фенолов с хлорным железом
- •7.2.10 Цветные реакции многоатомных фенолов на фильтровальной бумаге
- •7.2.11 Окисление фенолов кислородом воздуха в щелочной среде
- •7.2.12 Окисление фенолов нитратом серебра
- •7.3 Контрольные вопросы
- •Лабораторная работа №8 Тема: альдегиды и кетоны
- •8.1 Теоретическая часть
- •Медленно
- •4. Присоединение спиртов:
- •6. Взаимодействие с аммиаком:
- •7. Образование оксимов с гидроксиламином:
- •8.2 Экспериментальная часть
- •8.2.1 Открытие альдегидов с фуксинсернистой кислотой (Реакция Шиффа)
- •8.2.2 Цветная реакция на ацетон с нитропруссидом натрия (Проба Легаля)
- •8.2.3 Окисление формальдегида аммиачным раствором оксида серебра (реакция Толленса)
- •8.2.4 Окисление формальдегида гидроксидом меди (II) в щелочной среде
- •8.2.5 Реакция дисмутации водных растворов формальдегида
- •8.3 Контрольные вопросы
- •Лабораторная работа №9 Тема: карбоновые кислоты
- •9.1 Теоретическая часть
- •9.1.1 Методы получения
- •2. Оксосинтез:
- •4. Гидролиз тригалогенпроизводных:
- •9.1.2 Физические свойства карбоновых кислот
- •Однако, эти две группы настолько сильно влияют друг на друга, что их химические свойства лишь в незначительной степени сходны со свойствами спиртов и карбонильных соединений.
- •9.2 Экспериментальная часть
- •9.2.1 Растворимость карбоновых кислот в воде и органических растворителях
- •9.2.2 Получение и свойства муравьиной кислоты
- •9.2.3 Получение и свойства уксусной кислоты
- •9.2.4 Свойства непредельных одноосновных кислот
- •9.3 Контрольные вопросы
- •Лабораторная работа №10 Тема: Решение экспериментальных задач по идентификации пластмасс и волокон
- •10.2.1 Свойства пластмасс.
- •10.2.2 Свойства каучука и резины.
- •10.2.3 Свойства волокон.
- •Лабораторная работа №11
- •Образцов поливинилхлорида
- •11.1 Теоретическая часть
- •Содержание
- •Винникова Ольга Станиславна
- •Органическая
- •Методические указания
- •241037. Г. Брянск, пр. Станке Димитрова, 3, редакционно-издательский
Реакция часто применяется для определения положения двойной связи в молекуле, так как по образующимся карбонильным соединениям можно представить себе и строение исходного алкена.
7. Полимеризация алкенов. Большое значение получила полимеризация этилена и пропилена в полимеры с молекулярной массой около 105. До 1953 г. в основном применялась радикальная (инициируемая свободными радикалами) полимеризация, однако после, работ Циглера и Натта используют ионную полимеризацию (инициируемую ионами). Процесс полимеризации проводят в присутствии катализатора (триэтилалюминия или тетрахлортитана):
n
CH2=CH2
![]() -(СН2-СН2
)n-
-(СН2-СН2
)n-
Полиэтилен, получаемый этим способом, представляет coбoй предельный углеводород с неразветвленной цепью. Благодаря сочетанию многих ценных свойств полиэтилен имеет очень широкое применение. Он является одним из лучших материалов для изоляции кабелей, применяется в радарной технике, радиотехнике, сельском хозяйстве и др. Из него изготавливают трубы, шланги, сосуды, тару для сельскохозяйственных продуктов и удобрений, пленки различной толщины и многие бытовые предметы.
3.2 Экспериментальная часть
3.2.1 Получение этилена и его горение
В сухую пробирку помещают несколько крупинок песка, 2 капли этилового спирта и 4 капли концентрированной серной кислоты. Закрывают пробирку пробкой с газоотводной трубкой и осторожно нагревают смесь на пламени горелки. Выделяющийся газ поджигают у конца газоотводной трубки — он горит светящимся пламенем.
Химизм процесса:
CНз-СН2ОН + НОSОзН СНз-СН2-OSОзН + Н2О
этилсерная кислота
Этилсерная кислота — моноэфир неорганической двухосновной кислоты — при нагревании разлагается:
СНз-СН2-OSOзН СН2=СН2 + H2SO4
Таким образом, при взаимодействии этилового спирта с серной кислотой происходит дегидратация спирта:
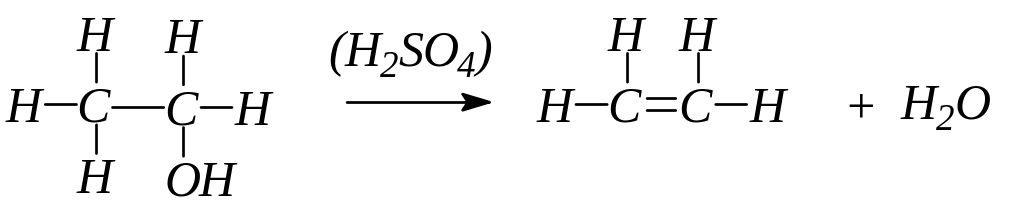
Выделяющийся этилен горит светящимся пламенем:
C2H4 + ЗO2 2СO2 + 2Н2О
Концентрированная серная кислота является окислителем. При нагревании смеси спирта с концентрированной серной кислотой образуется, кроме этилена и следов диэтилового эфира (СзН5)2О, ряд продуктов окисления органических соединений, например СО2, уголь С (обычно смесь в пробирке чернеет). Серная кислота при этом восстанавливается углеродом до сернистого ангидрида:
2H2SO4 + С СО2 + 2SO2 + 2H2O
Сернистый ангидрид также может обесцвечивать растворы брома и марганцевокислого калия подобно этилену. Поэтому образующийся этилен промывают раствором щелочи для очистки от SO2. Если реакцию вести в присутствии песка, сульфата алюминия (катализаторы, ускоряющие дегидратацию спирта), почернения смеси не происходит, следовательно, сернистый ангидрид не образуется.
Дегидратация спиртов является общим способом получения непредельных углеводородов.
3.2.2 Присоединение к этилену брома
Не прекращая нагревания пробирки со смесью спирта и серной кислоты (см. опыт 1), опускают конец газоотводной трубки в пробирку с 5 каплями бромной воды. Бромная вода быстро обесцвечивается вследствие присоединения атомов брома по месту двойной связи.
Химизм процесса:
СН2=СН2 + Вг2 СН2-СН2
│ │
Br Br
1,2-дибромэтан
Для алкенов характерны реакции присоединения по месту двойной связи.
Реакция обесцвечивания водного раствора брома служит качественной реакцией на двойную связь.
