- •Рецензент:
- •Лабораторная работа № 1 Тема: методы очистки и выделения органических соединений
- •1.1 Общая характеристика методов очистки и выделения органических соединений
- •1.2 Кристаллизация
- •1.2.1 Теоретическая часть
- •1.2.2 Экспериментальная часть
- •1.3 Возгонка (сублимация)
- •1.3.1 Теоретическая часть
- •1.3.2 Экспериментальная часть
- •1.4 Перегонка
- •1.4.1 Теоретическая часть
- •1.4.2 Экспериментальная часть
- •1.5 Экстракция
- •1.5.1 Теоретическая часть
- •1.5.2 Экспериментальная часть
- •1.6 Контрольные вопросы
- •Лабораторная работа № 2 Тема: алканы Цель работы: изучение методов получения и химических свойств алканов.
- •2.1 Теоретическая часть
- •2.1.1 Методы получения
- •2.1.2 Химические свойства
- •2.2 Экспериментальная часть
- •2.2.1 Получение метана и изучение его свойств
- •2.2.2 Бромирование предельных углеводородов
- •2.2.3 Окисление предельных углеводородов
- •2.2.4 Действие концентрированной серной кислоты на предельные углеводороды
- •2.2.5 Действие концентрированной азотной кислоты на предельные углеводороды
- •2.3 Контрольные вопросы
- •Лабораторная работа № 3 Тема: алкены
- •3.1 Теоретическая часть
- •3.1.1 Методы получения
- •3.1.2 Химические свойства
- •5. Окисление перманганатом калия в нейтральной или слабощелочной среде приводит к образованию гликолей.
- •Реакция часто применяется для определения положения двойной связи в молекуле, так как по образующимся карбонильным соединениям можно представить себе и строение исходного алкена.
- •3.2 Экспериментальная часть
- •3.2.1 Получение этилена и его горение
- •3.2.2 Присоединение к этилену брома
- •3.2.3 Отношение этилена к окислителям
- •3.2.4 Бромирование непредельных углеводородов
- •3.2.6 Действие концентрированной серной кислоты на непредельные углеводороды
- •3.2.7 Действие концентрированной азотной кислоты на непредельные углеводороды
- •3.3 Контрольные вопросы
- •Лабораторная работа № 4 Тема: алкины
- •4.1 Теоретическая часть
- •4.1.1 Методы получения
- •4.1.2 Химические свойства
- •А. Реакции присоединения
- •5. Присоединение спиртов. В присутствии едкого кали под давлением ацетилен присоединяет спирты с образованием алкилвиниловых эфиров:
- •4.2 Экспериментальная часть
- •4.3 Контрольные вопросы
- •Лабораторная работа № 5 Тема: ароматические углеводороды (арены)
- •5.1 Теоретическая часть
- •5.1.1 Методы получения
- •5.1.2 Химические свойства
- •Классификация реакций замещения. При замещении в бензольном кольце возможны три типа реакций в зависимости от природы атакующей частицы.
- •3. Электрофильное замещение.
- •5.2 Экспериментальная часть
- •5.2.1 Окисление ароматических углеводородов
- •5.2.2 Бромирование ароматических углеводородов
- •5.2.3 Нитрование ароматических углеводородов
- •5.2.4 Сульфирование ароматических углеводородов
- •5.2.5 Алкилирование бензола.
- •5.3 Контрольные вопрсы
- •Лабораторная работа №6 Тема: спирты
- •6.1 Теоретическая часть
- •6.1.1 Методы получения
- •6.1.2 Химические свойства спиртов
- •1. Взаимодействие с щелочными металлами:
- •6.2 Экспериментальная часть
- •6.2.1 Определение строения спиртов
- •6.2.2 Обнаружение воды в спирте и обезвоживание спирта
- •6.2.3 Свойства изоамилового спирта
- •6.2.4 Отношение спиртов к индикаторам
- •6.2.5 Образование и гидролиз алкоголятов
- •6.2.6 Взаимодействие глицерина с гидроксидом меди (II)
- •6.2.7 Окисление этилового спирта окисью меди
- •6.2.8 Окисление спиртов хромовой смесью
- •6.2.9 Окисление этилового спирта раствором перманганата калия
- •6.2.10 Взаимодействие изоамилового спирта с серной кислотой
- •6.2.11. Получение диэтилового эфира
- •6.3 Контрольные вопросы
- •Лабораторная работа №7 Тема: фенолы
- •7.1 Теоретическая часть
- •7.1.1 Методы получения
- •Кумольный способ:
- •Сплавление солей сульфокислот с гидроксидом натрия:
- •7.1.2 Химические свойства
- •9. При сульфировании фенолов получаются о- и п-фенолсульфокислоты:
- •10. Фенолы легко конденсируются с альдегидами:
- •7.2 Экспериментальная часть
- •7.2.1 Растворение фенола в воде
- •7.2.2 Получение фенолята натрия
- •7.2.3 Разложение фенолята натрия кислотами
- •7.2.4 Реакция фенола с хлорным железом
- •7.2.5 Получение трибромфенола
- •7.2.6 Сульфирование фенола
- •7.2.7 Нитрование фенола
- •7.2.8 Нитрозореакция фенолов
- •7.2.9 Цветные реакции многоатомных фенолов с хлорным железом
- •7.2.10 Цветные реакции многоатомных фенолов на фильтровальной бумаге
- •7.2.11 Окисление фенолов кислородом воздуха в щелочной среде
- •7.2.12 Окисление фенолов нитратом серебра
- •7.3 Контрольные вопросы
- •Лабораторная работа №8 Тема: альдегиды и кетоны
- •8.1 Теоретическая часть
- •Медленно
- •4. Присоединение спиртов:
- •6. Взаимодействие с аммиаком:
- •7. Образование оксимов с гидроксиламином:
- •8.2 Экспериментальная часть
- •8.2.1 Открытие альдегидов с фуксинсернистой кислотой (Реакция Шиффа)
- •8.2.2 Цветная реакция на ацетон с нитропруссидом натрия (Проба Легаля)
- •8.2.3 Окисление формальдегида аммиачным раствором оксида серебра (реакция Толленса)
- •8.2.4 Окисление формальдегида гидроксидом меди (II) в щелочной среде
- •8.2.5 Реакция дисмутации водных растворов формальдегида
- •8.3 Контрольные вопросы
- •Лабораторная работа №9 Тема: карбоновые кислоты
- •9.1 Теоретическая часть
- •9.1.1 Методы получения
- •2. Оксосинтез:
- •4. Гидролиз тригалогенпроизводных:
- •9.1.2 Физические свойства карбоновых кислот
- •Однако, эти две группы настолько сильно влияют друг на друга, что их химические свойства лишь в незначительной степени сходны со свойствами спиртов и карбонильных соединений.
- •9.2 Экспериментальная часть
- •9.2.1 Растворимость карбоновых кислот в воде и органических растворителях
- •9.2.2 Получение и свойства муравьиной кислоты
- •9.2.3 Получение и свойства уксусной кислоты
- •9.2.4 Свойства непредельных одноосновных кислот
- •9.3 Контрольные вопросы
- •Лабораторная работа №10 Тема: Решение экспериментальных задач по идентификации пластмасс и волокон
- •10.2.1 Свойства пластмасс.
- •10.2.2 Свойства каучука и резины.
- •10.2.3 Свойства волокон.
- •Лабораторная работа №11
- •Образцов поливинилхлорида
- •11.1 Теоретическая часть
- •Содержание
- •Винникова Ольга Станиславна
- •Органическая
- •Методические указания
- •241037. Г. Брянск, пр. Станке Димитрова, 3, редакционно-издательский
Лабораторная работа №7 Тема: фенолы
Цель работы: Практическое освоение характерных свойств фенолов и их отличительных особенностей.
Оборудование и реактивы: фенол кристаллический; насыщенный раствор фенола; едкий натр, 2н раствор; раствор фенолята натрия; соляная кислота, 2н раствор; углекислый кальций; хлорное железо, 0,1н раствор; бромная вода, насыщенный раствор; серная кислота (d=1,84 г/мл); азотная кислота (d=1,4 г/мл); нитрит натрия, 0,02н раствор; пирокатехин, 1% раствор; резорцин, 1% раствор; гидрохинон, 1% раствор; пирогаллол, 1% раствор, водяная баня; пробирки; стеклянные трубки с оттянутым концом; газоотводные трубки; капельная воронка.
7.1 Теоретическая часть
Органические соединения, у которых гидроксильная группа связана непосредственно с бензольным кольцом, называют фенолами (Ar-OH).
В зависимости от числа гидроксильных групп в ядре различают одно-, двух- и трехатомные фенолы.
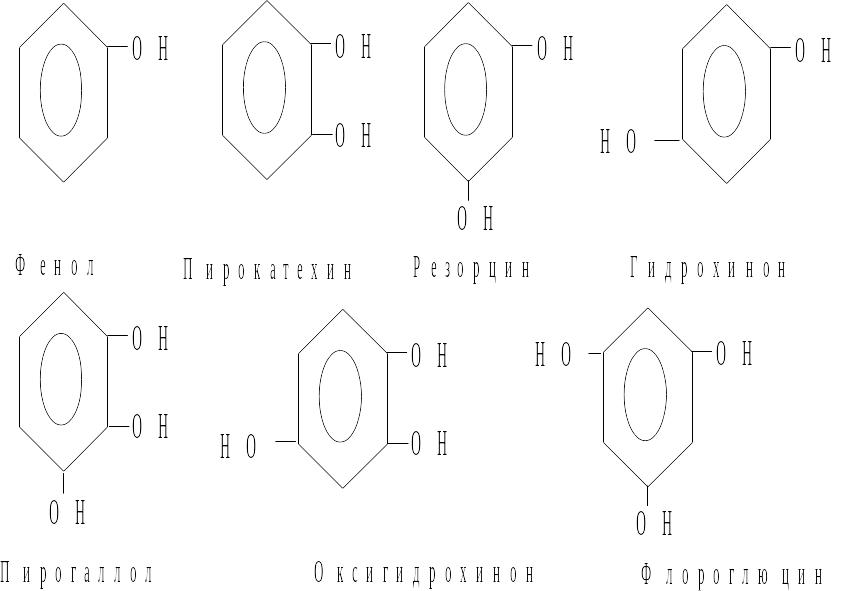
7.1.1 Методы получения
Фенол является одним из важных продуктов нефтехимии. Источником фенола и его метильных гомологов служит каменноугольная смола, кроме того в значительных количествах его получают синтетическими способами.
Кумольный способ:
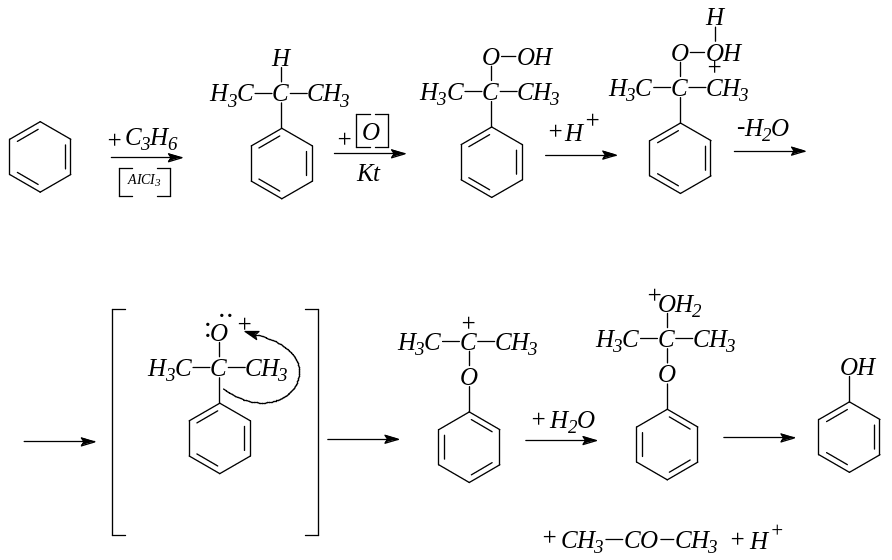
Сплавление солей сульфокислот с гидроксидом натрия:
С6Н5SO3Na + 2NaOH C6H5ONa + Na2SO3 + H2O
2C6H5ONa + CO2 + H2O 2C6H5OH + Na2CO3
3. Гидроксилирование ароматических производных в жестких условиях при 300-350оС и 150-200 ат:
С6Н5CI + NaOH C6H5OH + NaCI
Двух- и трехатомные фенолы получают аналогичными способами.
4. В лаборатории фенолы получают гидролизом солей диазония путем нагревания подкисленных растворов:
C6H5 – N+=N + H2O C6H5OH + N2 + H+
7.1.2 Химические свойства
Большинство фенолов – бесцветные твердые вещества. Простейший фенол C6H5OH обладает характерным запахом, плавится при 42оС. Температура плавления фенола сильно понижается от примеси небольших количеств воды (кристаллогидрат C6H5OH•H2O плавится при 16оС). Фенол гигроскопичен, кристаллы его при стоянии на воздухе расплываются. Раствор фенола в воде обладает антисептическими свойствами. Пары фенола токсичны, а сам он вызывает ожоги кожи.
Химические свойства фенола определяются наличием гидроксигруппы и бензольного кольца, взаимно влияющих друг на друга
Сопряжение неподеленной электронной пары атома кислорода гидроксильной группы приводит к смещению электронной плотности в сторону бензольного кольца, что усиливает подвижность атома водорода. Фенолы являются более сильными кислотами, чем предельные одноатомные спирты (pКа =10). Кислотность фенолов зависит также от характера заместителей в ядре. Введение в ядро электроноакцепторных заместителей (нитрогруппы, атомов галогенов) приводит к увеличению кислотных свойств.
С другой стороны, являясь заместителем I рода, гидроксигруппа приводит к повышению электронной плотности в о- и п-положениях бензольного кольца, что облегчает реакции электрофильного замещения.
Двух- и трехатомные фенолы во многих химических реакциях обнаруживают сходство с одноатомными фенолами, участвуя одной, двумя или тремя гидроксигруппами. Двухатомные фенолы более сильные кислоты, чем одноатомный фенол. Они легко окисляются и являются сильными восстановителями. Пирокатехин при окислении образует о-бензохинон:
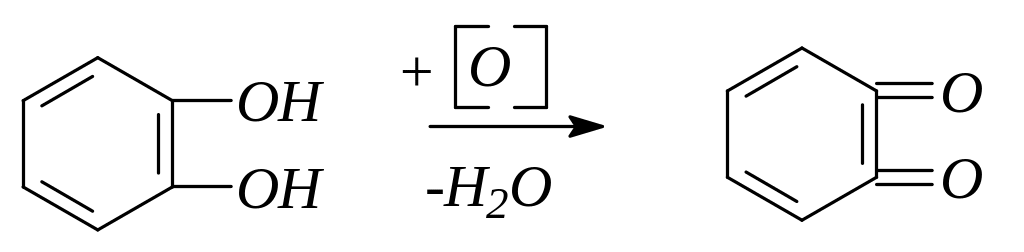
Две структуры – бензоидная и хиноидная – легко переходят друг в друга. Хиноидные группировки относятся к важным хромофорным системам в молекулах красителей.
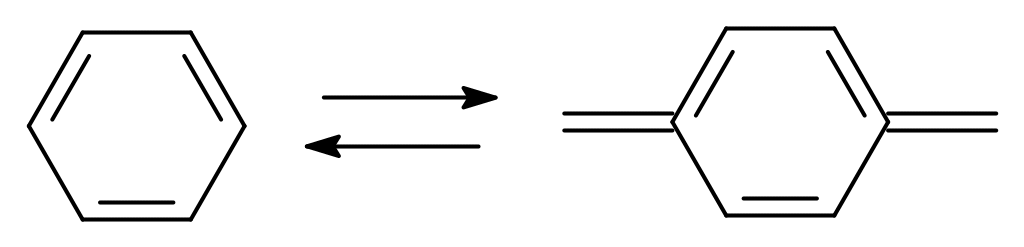
К наиболее характерным химическим свойствам можно отнести следующие.
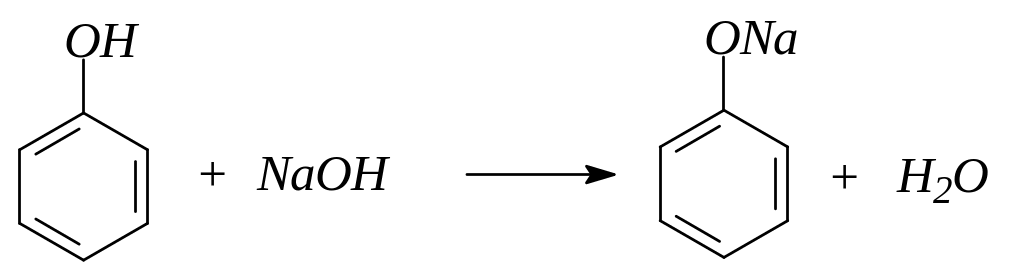
1. Проявляя кислотные свойства, фенол реагирует с гидроксидом натрия, образуя феноляты:
2. Фенолы легко алкилируются при действии на феноляты галогенпроизводных, особенно в присутствии порошка меди, а также при действии на фенол алкилсульфатов, эфиров сульфокислот или диазометана:

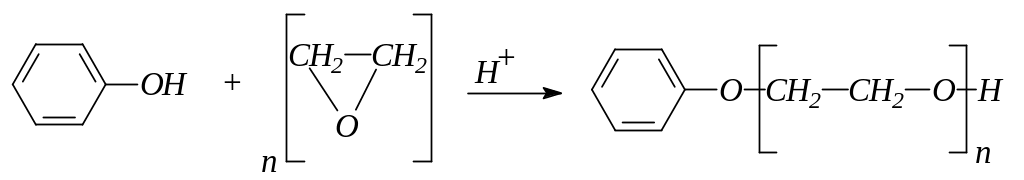
3. Фенол конденсируется с окисью этилена с образованием фенилового эфира полиэтиленгликоля:
4. фенолы не этерифицируются непосредственно карбоновыми кислотами. Эфиры фенолов могут быть получены действием ангидридов или галогенангидридов кислот на феноляты или растворы фенолов в пиридине:
![]()
5. Гидроксильная группа в фенолах с большим трудом замещается на галоген:
![]()
6. При перегонке фенолов с цинковой пылью гидроксильная группа замещается на водород:
![]()
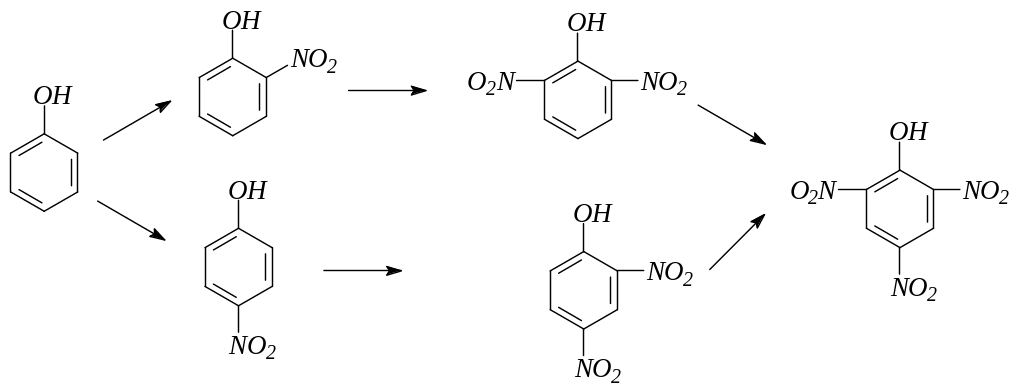
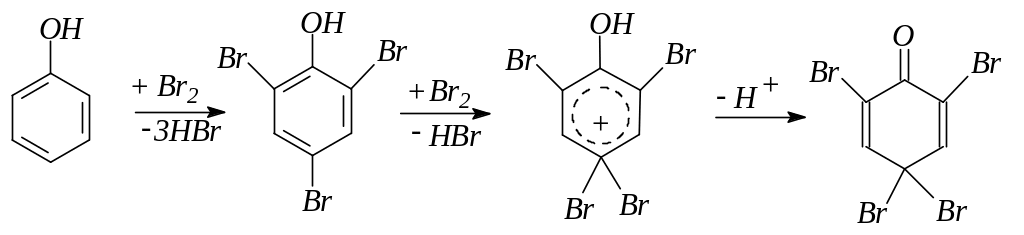
7. Галогенирование фенола действием растворов галогенов или галогенирующих средств идет с большой скоростью и преимущественно в пара-положение. Конечным продуктом галогенирования в ядро являются тригалогенофенолы. Возможно дальнейшее галогенирование:
8. Нитрование фенола идет уже при действии разбавленной азотной кислоты. При дальнейшем нитровании концентрированной азотной кислотой получается тринитрофенол – пикриновая кислота: