- •Рецензент:
- •Лабораторная работа № 1 Тема: методы очистки и выделения органических соединений
- •1.1 Общая характеристика методов очистки и выделения органических соединений
- •1.2 Кристаллизация
- •1.2.1 Теоретическая часть
- •1.2.2 Экспериментальная часть
- •1.3 Возгонка (сублимация)
- •1.3.1 Теоретическая часть
- •1.3.2 Экспериментальная часть
- •1.4 Перегонка
- •1.4.1 Теоретическая часть
- •1.4.2 Экспериментальная часть
- •1.5 Экстракция
- •1.5.1 Теоретическая часть
- •1.5.2 Экспериментальная часть
- •1.6 Контрольные вопросы
- •Лабораторная работа № 2 Тема: алканы Цель работы: изучение методов получения и химических свойств алканов.
- •2.1 Теоретическая часть
- •2.1.1 Методы получения
- •2.1.2 Химические свойства
- •2.2 Экспериментальная часть
- •2.2.1 Получение метана и изучение его свойств
- •2.2.2 Бромирование предельных углеводородов
- •2.2.3 Окисление предельных углеводородов
- •2.2.4 Действие концентрированной серной кислоты на предельные углеводороды
- •2.2.5 Действие концентрированной азотной кислоты на предельные углеводороды
- •2.3 Контрольные вопросы
- •Лабораторная работа № 3 Тема: алкены
- •3.1 Теоретическая часть
- •3.1.1 Методы получения
- •3.1.2 Химические свойства
- •5. Окисление перманганатом калия в нейтральной или слабощелочной среде приводит к образованию гликолей.
- •Реакция часто применяется для определения положения двойной связи в молекуле, так как по образующимся карбонильным соединениям можно представить себе и строение исходного алкена.
- •3.2 Экспериментальная часть
- •3.2.1 Получение этилена и его горение
- •3.2.2 Присоединение к этилену брома
- •3.2.3 Отношение этилена к окислителям
- •3.2.4 Бромирование непредельных углеводородов
- •3.2.6 Действие концентрированной серной кислоты на непредельные углеводороды
- •3.2.7 Действие концентрированной азотной кислоты на непредельные углеводороды
- •3.3 Контрольные вопросы
- •Лабораторная работа № 4 Тема: алкины
- •4.1 Теоретическая часть
- •4.1.1 Методы получения
- •4.1.2 Химические свойства
- •А. Реакции присоединения
- •5. Присоединение спиртов. В присутствии едкого кали под давлением ацетилен присоединяет спирты с образованием алкилвиниловых эфиров:
- •4.2 Экспериментальная часть
- •4.3 Контрольные вопросы
- •Лабораторная работа № 5 Тема: ароматические углеводороды (арены)
- •5.1 Теоретическая часть
- •5.1.1 Методы получения
- •5.1.2 Химические свойства
- •Классификация реакций замещения. При замещении в бензольном кольце возможны три типа реакций в зависимости от природы атакующей частицы.
- •3. Электрофильное замещение.
- •5.2 Экспериментальная часть
- •5.2.1 Окисление ароматических углеводородов
- •5.2.2 Бромирование ароматических углеводородов
- •5.2.3 Нитрование ароматических углеводородов
- •5.2.4 Сульфирование ароматических углеводородов
- •5.2.5 Алкилирование бензола.
- •5.3 Контрольные вопрсы
- •Лабораторная работа №6 Тема: спирты
- •6.1 Теоретическая часть
- •6.1.1 Методы получения
- •6.1.2 Химические свойства спиртов
- •1. Взаимодействие с щелочными металлами:
- •6.2 Экспериментальная часть
- •6.2.1 Определение строения спиртов
- •6.2.2 Обнаружение воды в спирте и обезвоживание спирта
- •6.2.3 Свойства изоамилового спирта
- •6.2.4 Отношение спиртов к индикаторам
- •6.2.5 Образование и гидролиз алкоголятов
- •6.2.6 Взаимодействие глицерина с гидроксидом меди (II)
- •6.2.7 Окисление этилового спирта окисью меди
- •6.2.8 Окисление спиртов хромовой смесью
- •6.2.9 Окисление этилового спирта раствором перманганата калия
- •6.2.10 Взаимодействие изоамилового спирта с серной кислотой
- •6.2.11. Получение диэтилового эфира
- •6.3 Контрольные вопросы
- •Лабораторная работа №7 Тема: фенолы
- •7.1 Теоретическая часть
- •7.1.1 Методы получения
- •Кумольный способ:
- •Сплавление солей сульфокислот с гидроксидом натрия:
- •7.1.2 Химические свойства
- •9. При сульфировании фенолов получаются о- и п-фенолсульфокислоты:
- •10. Фенолы легко конденсируются с альдегидами:
- •7.2 Экспериментальная часть
- •7.2.1 Растворение фенола в воде
- •7.2.2 Получение фенолята натрия
- •7.2.3 Разложение фенолята натрия кислотами
- •7.2.4 Реакция фенола с хлорным железом
- •7.2.5 Получение трибромфенола
- •7.2.6 Сульфирование фенола
- •7.2.7 Нитрование фенола
- •7.2.8 Нитрозореакция фенолов
- •7.2.9 Цветные реакции многоатомных фенолов с хлорным железом
- •7.2.10 Цветные реакции многоатомных фенолов на фильтровальной бумаге
- •7.2.11 Окисление фенолов кислородом воздуха в щелочной среде
- •7.2.12 Окисление фенолов нитратом серебра
- •7.3 Контрольные вопросы
- •Лабораторная работа №8 Тема: альдегиды и кетоны
- •8.1 Теоретическая часть
- •Медленно
- •4. Присоединение спиртов:
- •6. Взаимодействие с аммиаком:
- •7. Образование оксимов с гидроксиламином:
- •8.2 Экспериментальная часть
- •8.2.1 Открытие альдегидов с фуксинсернистой кислотой (Реакция Шиффа)
- •8.2.2 Цветная реакция на ацетон с нитропруссидом натрия (Проба Легаля)
- •8.2.3 Окисление формальдегида аммиачным раствором оксида серебра (реакция Толленса)
- •8.2.4 Окисление формальдегида гидроксидом меди (II) в щелочной среде
- •8.2.5 Реакция дисмутации водных растворов формальдегида
- •8.3 Контрольные вопросы
- •Лабораторная работа №9 Тема: карбоновые кислоты
- •9.1 Теоретическая часть
- •9.1.1 Методы получения
- •2. Оксосинтез:
- •4. Гидролиз тригалогенпроизводных:
- •9.1.2 Физические свойства карбоновых кислот
- •Однако, эти две группы настолько сильно влияют друг на друга, что их химические свойства лишь в незначительной степени сходны со свойствами спиртов и карбонильных соединений.
- •9.2 Экспериментальная часть
- •9.2.1 Растворимость карбоновых кислот в воде и органических растворителях
- •9.2.2 Получение и свойства муравьиной кислоты
- •9.2.3 Получение и свойства уксусной кислоты
- •9.2.4 Свойства непредельных одноосновных кислот
- •9.3 Контрольные вопросы
- •Лабораторная работа №10 Тема: Решение экспериментальных задач по идентификации пластмасс и волокон
- •10.2.1 Свойства пластмасс.
- •10.2.2 Свойства каучука и резины.
- •10.2.3 Свойства волокон.
- •Лабораторная работа №11
- •Образцов поливинилхлорида
- •11.1 Теоретическая часть
- •Содержание
- •Винникова Ольга Станиславна
- •Органическая
- •Методические указания
- •241037. Г. Брянск, пр. Станке Димитрова, 3, редакционно-издательский
3.1.2 Химические свойства
Наличие
в молекулах алкенов двойной связи,
состоящей из
![]() -
и
-
связей, предопределяет их повышенную
реакционную способность в реакциях
присоединения, так как
-связь
прочнее чем
связь.
-
и
-
связей, предопределяет их повышенную
реакционную способность в реакциях
присоединения, так как
-связь
прочнее чем
связь.
Естественно ожидать, что реакции алкенов будут проходить по двойной связи, а следовательно, будут реакциями присоединения, а не реакциями замещения, характерными для ранее рассмотренных алканов.
1. Присоединение водорода. Присоединение водорода к алкенам приводит к образованию предельных углеводородов:
СН3-СН=CH2
+ Н2
![]() СН3-СН2-CH3
СН3-СН2-CH3
2. Присоединение галогенов. Галогены присоединяются к алкенам с образованием вицинальных дигалогенпроизводных, т. е. содержащих атомы галогена у соседних атомов углерода.
На первой стадии этой реакции происходит взаимодействие между -электронами двойной связи и электрофильной частицей галогена с образованием так называемого -комплекса I, который через стадию образования карбкатиона II распадается на продукт реакции III.
[R-CH=CH-R
--- Cl![]() +-
Cl
-]
[R-CHCl-CH-R]•Cl-]
R-CHCl-CHCl-R
+-
Cl
-]
[R-CHCl-CH-R]•Cl-]
R-CHCl-CHCl-R
I II III
3. Присоединение галогенводородов. Галогенводороды присоединяются к алкенам с образованием галогеналкилов. Присоединение в случае несимметричных молекул идет по правилу Марковникова, т. е. водород присоединяется к наиболее гидрогенизированному атому углерода (с наибольшим числом водородных атомов):
R-CH=CR2 + HBr R-CH2-CR2Br
Эта реакция, как и присоединение брома к этилену, идет после образования -комплекса через стадию образования соответствующего карбкатиона.
[R-CH=CR2 --- Н +- Cl -] [R-CH2-CR2]+•Cl- R-CH2-CR2Cl
В присутствии перекисей бромистый водород присоединяется не по правилу Марковникова (эффект Хараша).
В присутствии перекисей реакция идет не по механизму электрофильного присоединения, как выше, а по радикальному механизму (Xapaш). Первой стадией является атака перекисного радикала на молекулу HBr:
RCOO• + HBr RCOOH + Br•
Возникший радикал брома может присоединяться к алкену с образованием новых радикалов I и II, в связи с чем, реакция должна протекать по двум направлениям:
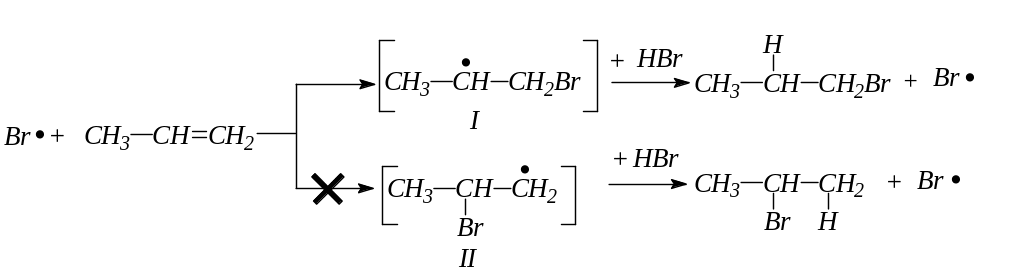
Но направление процесса определяется устойчивостью промежуточных образований-радикалов I и II. Не спаренный электрон более стабилен у вторичного углерода (индукционный эффект), поэтому реакция протекает через промежуточный радикал I.
4. Присоединение воды и серной кислоты. В присутствии кислот вода присоединяется по двойной связи в соответствии с правилом Марковникова:
R-CH=CН2
+ H2О
![]() R-CH-CН3
R-CH-CН3
│
ОН
Так же идет и реакция с серной кислотой:
R-CH=CН2 + H2SО4 R-CH-CН3
│
OSО3H
5. Окисление перманганатом калия в нейтральной или слабощелочной среде приводит к образованию гликолей.
3R-CH=CH-R + 2KMnO4 + 4H2O 3R-CH – CH–R+ 2KOH + 2MnO2
│ │
OH OH
Кислые растворы перманганата окисляют алкены с разрывом цепи по С=С связи с образованием кислот или кетонов:
(СН3)2С=СН-СН3
![]() (СН3)2С=O
+ СН3COOH
(СН3)2С=O
+ СН3COOH
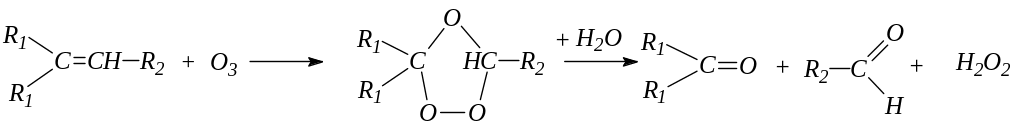
6. Действие озона на алкены. Действие озона на алкены приводит к образованию кристаллических сильно взрывчатых озонидов, которые при гидролизе образуют альдегиды или кетоны: