
- •Рецензент:
- •Лабораторная работа № 1 Тема: методы очистки и выделения органических соединений
- •1.1 Общая характеристика методов очистки и выделения органических соединений
- •1.2 Кристаллизация
- •1.2.1 Теоретическая часть
- •1.2.2 Экспериментальная часть
- •1.3 Возгонка (сублимация)
- •1.3.1 Теоретическая часть
- •1.3.2 Экспериментальная часть
- •1.4 Перегонка
- •1.4.1 Теоретическая часть
- •1.4.2 Экспериментальная часть
- •1.5 Экстракция
- •1.5.1 Теоретическая часть
- •1.5.2 Экспериментальная часть
- •1.6 Контрольные вопросы
- •Лабораторная работа № 2 Тема: алканы Цель работы: изучение методов получения и химических свойств алканов.
- •2.1 Теоретическая часть
- •2.1.1 Методы получения
- •2.1.2 Химические свойства
- •2.2 Экспериментальная часть
- •2.2.1 Получение метана и изучение его свойств
- •2.2.2 Бромирование предельных углеводородов
- •2.2.3 Окисление предельных углеводородов
- •2.2.4 Действие концентрированной серной кислоты на предельные углеводороды
- •2.2.5 Действие концентрированной азотной кислоты на предельные углеводороды
- •2.3 Контрольные вопросы
- •Лабораторная работа № 3 Тема: алкены
- •3.1 Теоретическая часть
- •3.1.1 Методы получения
- •3.1.2 Химические свойства
- •5. Окисление перманганатом калия в нейтральной или слабощелочной среде приводит к образованию гликолей.
- •Реакция часто применяется для определения положения двойной связи в молекуле, так как по образующимся карбонильным соединениям можно представить себе и строение исходного алкена.
- •3.2 Экспериментальная часть
- •3.2.1 Получение этилена и его горение
- •3.2.2 Присоединение к этилену брома
- •3.2.3 Отношение этилена к окислителям
- •3.2.4 Бромирование непредельных углеводородов
- •3.2.6 Действие концентрированной серной кислоты на непредельные углеводороды
- •3.2.7 Действие концентрированной азотной кислоты на непредельные углеводороды
- •3.3 Контрольные вопросы
- •Лабораторная работа № 4 Тема: алкины
- •4.1 Теоретическая часть
- •4.1.1 Методы получения
- •4.1.2 Химические свойства
- •А. Реакции присоединения
- •5. Присоединение спиртов. В присутствии едкого кали под давлением ацетилен присоединяет спирты с образованием алкилвиниловых эфиров:
- •4.2 Экспериментальная часть
- •4.3 Контрольные вопросы
- •Лабораторная работа № 5 Тема: ароматические углеводороды (арены)
- •5.1 Теоретическая часть
- •5.1.1 Методы получения
- •5.1.2 Химические свойства
- •Классификация реакций замещения. При замещении в бензольном кольце возможны три типа реакций в зависимости от природы атакующей частицы.
- •3. Электрофильное замещение.
- •5.2 Экспериментальная часть
- •5.2.1 Окисление ароматических углеводородов
- •5.2.2 Бромирование ароматических углеводородов
- •5.2.3 Нитрование ароматических углеводородов
- •5.2.4 Сульфирование ароматических углеводородов
- •5.2.5 Алкилирование бензола.
- •5.3 Контрольные вопрсы
- •Лабораторная работа №6 Тема: спирты
- •6.1 Теоретическая часть
- •6.1.1 Методы получения
- •6.1.2 Химические свойства спиртов
- •1. Взаимодействие с щелочными металлами:
- •6.2 Экспериментальная часть
- •6.2.1 Определение строения спиртов
- •6.2.2 Обнаружение воды в спирте и обезвоживание спирта
- •6.2.3 Свойства изоамилового спирта
- •6.2.4 Отношение спиртов к индикаторам
- •6.2.5 Образование и гидролиз алкоголятов
- •6.2.6 Взаимодействие глицерина с гидроксидом меди (II)
- •6.2.7 Окисление этилового спирта окисью меди
- •6.2.8 Окисление спиртов хромовой смесью
- •6.2.9 Окисление этилового спирта раствором перманганата калия
- •6.2.10 Взаимодействие изоамилового спирта с серной кислотой
- •6.2.11. Получение диэтилового эфира
- •6.3 Контрольные вопросы
- •Лабораторная работа №7 Тема: фенолы
- •7.1 Теоретическая часть
- •7.1.1 Методы получения
- •Кумольный способ:
- •Сплавление солей сульфокислот с гидроксидом натрия:
- •7.1.2 Химические свойства
- •9. При сульфировании фенолов получаются о- и п-фенолсульфокислоты:
- •10. Фенолы легко конденсируются с альдегидами:
- •7.2 Экспериментальная часть
- •7.2.1 Растворение фенола в воде
- •7.2.2 Получение фенолята натрия
- •7.2.3 Разложение фенолята натрия кислотами
- •7.2.4 Реакция фенола с хлорным железом
- •7.2.5 Получение трибромфенола
- •7.2.6 Сульфирование фенола
- •7.2.7 Нитрование фенола
- •7.2.8 Нитрозореакция фенолов
- •7.2.9 Цветные реакции многоатомных фенолов с хлорным железом
- •7.2.10 Цветные реакции многоатомных фенолов на фильтровальной бумаге
- •7.2.11 Окисление фенолов кислородом воздуха в щелочной среде
- •7.2.12 Окисление фенолов нитратом серебра
- •7.3 Контрольные вопросы
- •Лабораторная работа №8 Тема: альдегиды и кетоны
- •8.1 Теоретическая часть
- •Медленно
- •4. Присоединение спиртов:
- •6. Взаимодействие с аммиаком:
- •7. Образование оксимов с гидроксиламином:
- •8.2 Экспериментальная часть
- •8.2.1 Открытие альдегидов с фуксинсернистой кислотой (Реакция Шиффа)
- •8.2.2 Цветная реакция на ацетон с нитропруссидом натрия (Проба Легаля)
- •8.2.3 Окисление формальдегида аммиачным раствором оксида серебра (реакция Толленса)
- •8.2.4 Окисление формальдегида гидроксидом меди (II) в щелочной среде
- •8.2.5 Реакция дисмутации водных растворов формальдегида
- •8.3 Контрольные вопросы
- •Лабораторная работа №9 Тема: карбоновые кислоты
- •9.1 Теоретическая часть
- •9.1.1 Методы получения
- •2. Оксосинтез:
- •4. Гидролиз тригалогенпроизводных:
- •9.1.2 Физические свойства карбоновых кислот
- •Однако, эти две группы настолько сильно влияют друг на друга, что их химические свойства лишь в незначительной степени сходны со свойствами спиртов и карбонильных соединений.
- •9.2 Экспериментальная часть
- •9.2.1 Растворимость карбоновых кислот в воде и органических растворителях
- •9.2.2 Получение и свойства муравьиной кислоты
- •9.2.3 Получение и свойства уксусной кислоты
- •9.2.4 Свойства непредельных одноосновных кислот
- •9.3 Контрольные вопросы
- •Лабораторная работа №10 Тема: Решение экспериментальных задач по идентификации пластмасс и волокон
- •10.2.1 Свойства пластмасс.
- •10.2.2 Свойства каучука и резины.
- •10.2.3 Свойства волокон.
- •Лабораторная работа №11
- •Образцов поливинилхлорида
- •11.1 Теоретическая часть
- •Содержание
- •Винникова Ольга Станиславна
- •Органическая
- •Методические указания
- •241037. Г. Брянск, пр. Станке Димитрова, 3, редакционно-издательский
9. При сульфировании фенолов получаются о- и п-фенолсульфокислоты:
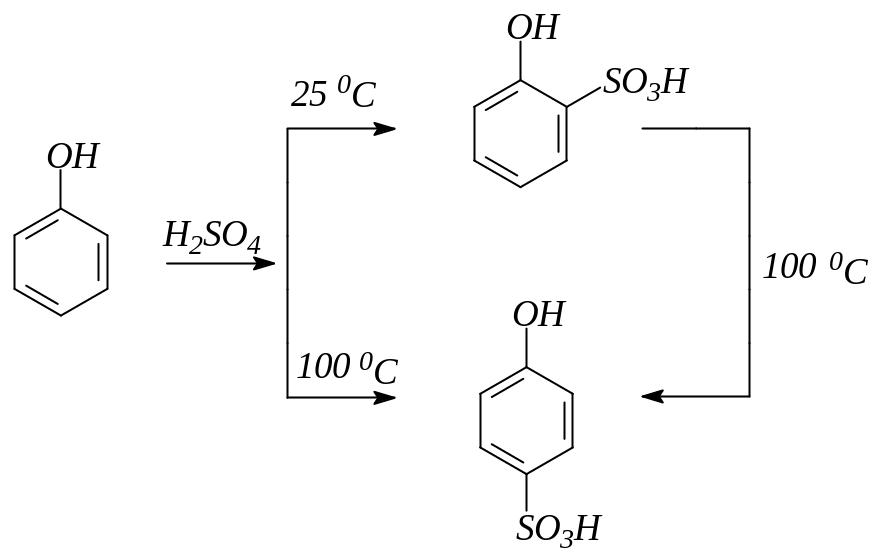
10. Фенолы легко конденсируются с альдегидами:
а) при действии щелочных или кислых катализаторов на смесь фенола и какого-либо альдегида жирного ряда происходит конденсация в о- и п-положениях при обычной температуре рост молекулы за счет конденсации фенола с альдегидом идет в линейном направлении:

11. При действии на фенол перекиси водорода в присутствии железного катализатора получается с небольшим выходом пирокатехин:

При действии на фенол хромовой смесью образуется п-бензохинон и продукты его дальнейших изменений:

12. При гидрировании водородом в присутствии катализатора фенолы превращаются в спирты ряда циклогексана:

7.2 Экспериментальная часть
7.2.1 Растворение фенола в воде
В пробирку помещают 2 капли жидкого фенола, прибавляют 2 капли воды и взбалтывают. Образуется мутная жидкость – эмульсия фенола. Дают содержимому пробирки отстояться. После отстаивания эмульсия постепенно расслаивается: верхний слой – раствор фенола в воде, нижний – раствор воды в феноле. Фенол плохо растворим в холодной воде.
Осторожно нагревают содержимое пробирки – получается однородный раствор. При охлаждении вновь образуется мутная жидкость. При повышении температуры увеличивается как растворимость фенола в воде, так и растворимость воды в феноле, и при 68оС они смешиваются друг с другом в любых соотношениях.
7.2.2 Получение фенолята натрия
В пробирку помещают 4 капли эмульсии фенола в воде и добавляют 2 капли раствора едкого натра. Немедленно образуется прозрачный раствор фенолята натрия. Раствор оставляют для следующего опыта.
Написать уравнение реакции получения фенолята натрия.
Фенолы обладают кислотными свойствами, они легко вступают в реакцию с водными растворами щелочей, образуя аналогичные алкоголятам феноляты. По этой причине простейший фенол называют “карболовой кислотой”. Более сильный кислотный характер фенолов по сравнению со спиртами объясняется влиянием бензольного кольца.
7.2.3 Разложение фенолята натрия кислотами
К половине прозрачного раствора фенолята натрия (из опыта 2) добавляют 1 каплю фенолфталеина (отметить наблюдаемый эффект), а затем 1 каплю раствора соляной кислоты до исчезновения окраски раствора. Выделяется свободный фенол в виде эмульсии.
Феноляты щелочных металлов подвергаются гидролизу по типу солей, образованных слабыми кислотами и сильными основаниями. Действие сильных кислот приводит к вытеснению фенола как слабой кислоты.
Написать уравнения соответствующих реакций.
Фенолы можно вытеснить из растворов фенолятов даже такой слабой кислотой как угольная.
В пробирку со второй половиной раствора фенолята натрия (из опыта 2) опускают стеклянную трубку с оттянутым концом и пропускают через нее ток двуокиси углерода, получаемой при действии раствора соляной кислоты на углекислый кальций. Через некоторое время раствор фенолята натрия мутнеет.
Написать уравнение реакций и сделать вывод о сравнительной силе угольной кислоты и фенола.
Однако, в случае избытка щелочи в растворе фенолята выделение свободного фенола при пропускании двуокиси углерода может начаться только после того, как весь едкий натр перейдет в бикарбонат натрия. Поэтому разложение фенолята – появление мути – наблюдается только в концентрированных растворах фенолята натрия; в слабых растворах выделившийся фенол может раствориться в воде и помутнение раствора не отмечается.
