
- •Л.С.Сухорукова, т.І.Курова, н.І.Мальцева, в.І.Григор’єва,
- •Основи загальної хімії Навчальний посібник
- •Атомно-молекулярне вчення
- •Основні закономірності перебігу хімічних реакцій
- •Розчини. Дисперсні системи
- •Молярна концентрація еквівалента або нормальність (сн) визначається
- •Основи дисоціюють з утворенням катіонів металу і гідроксид-іонів он-:
- •Наприклад, дисоціацію такого індикатора як лакмус, можна описати рівнянням
- •Властивості деяких кислотно-основних індикаторів
- •Ступінь гідролізу визначається співвідношенням:
- •Класифікація дисперсних систем за агрегатним станом дисперсної фази та дисперсійного середовища
- •Зміна механічних властивостей гелю кремнієвої кислоти h2SiO3 при обезводненні
- •Будова речовини
- •Головна підгрупа Побічна група
- •Двох періодів
- •Відносні електронегативності елементів(за шкалою Полінга)
- •2 Відштовхування rзв. Е, кДж/моль
- •Окисно-відновні реакції. Основи електрохімії
- •5.3. Корозія металів. Методи захисту металів від корозії
- •1. Якщо в розчині присутні аніони безкисневих кислот s2-,I-,Br-,Cl- (крім f-) або іони , то відбувається окиснення цих аніонів у послідовності:
- •Неметали
- •Неорганічні в'яжучі речовини
- •Приблизний мінералогічний склад портландцементного клінкеру
- •Характеристики процесів гідратації та продуктів твердіння складових портландцементу
- •Органічні сполуки
- •Найважливіші класи органічних сполук
- •Органічні полімерні матеріали в будівництві
- •Xімія та екологія
Ступінь гідролізу визначається співвідношенням:
![]()
де Сг — число молів гідролізованої солі;
С — загальне число молів солі.
Для рівноважної системи
А- + HOH <=> HA + OH-
аA- = Cc(1-), аНА = аОН- = Сс∙, де Сс — концентрація солі. Тоді
![]()
О скільки
1-1,
то ступінь гідролізу за аніоном можна
розрахувати через іонний добуток води,
константу дисоціації відповідної
слабкої кислоти та концентрацію солі
за формулою:
скільки
1-1,
то ступінь гідролізу за аніоном можна
розрахувати через іонний добуток води,
константу дисоціації відповідної
слабкої кислоти та концентрацію солі
за формулою:
Аналогічні формули можна вивести і для солі, утвореної слабкою основою та сильною кислотою, тобто при гідролізі за катіоном:
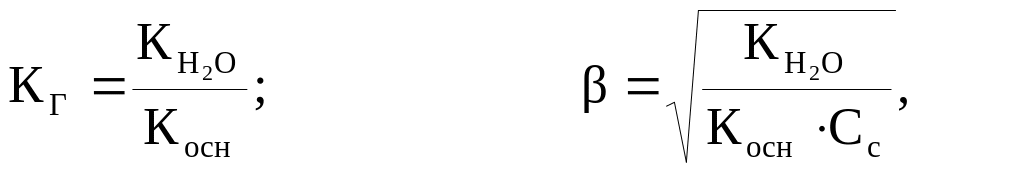
де Косн – константа дисоціації слабкої основи, що утворюється при гідролізі.
Д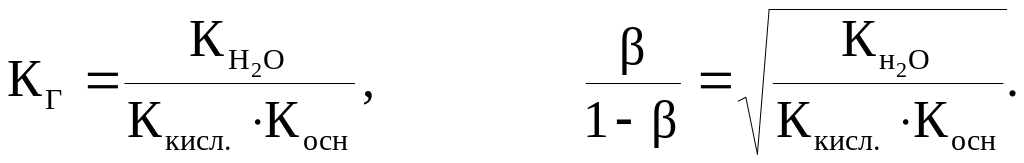 ля
солі, утвореної слабкою основою та
слабкою кислотою, відповідні формули
мають вигляд:
ля
солі, утвореної слабкою основою та
слабкою кислотою, відповідні формули
мають вигляд:
3.5. ДИСПЕРСНІ СИСТЕМИ
До дисперсних систем належать мікрогетерогенні системи з дуже роз-виненою міжфазовою поверхнею, в яких одна фаза (дисперсна) більш-менш рівномірно розподілена в іншій фазі (дисперсійне середовище).
Властивості речовин у міжфазній поверхні товщиною в декілька діаметрів атомів або молекул відрізняються від властивостей всередині об’єму фази. Всередині об’єму чистої речовини сили міжмолекулярної взаємодії повністю скомпенсовані, тоді як в поверхневому шарі має місце тільки часткова компенсація (Рис.9).

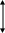

Рис.9. Стан молекули всередині речовини і в поверхневому шарі
Цей факт зумовлює наявність певної потенціальної енергії міжфазової поверхні, яку називають поверхневою енергією. Вона спричиняє до концент-рації речовини однієї фази на поверхні іншої фази. Цей процес називається адсорбцією. Оскільки поверхнева енергія при цьому зменшується, процес адсорбції відбувається самочинно. Адсорбція – оборотний процес і в системі через деякий час встановлюється рівновага: адсорбція <=> десорбція.
Речовина, на поверхні якої адсорбується інша речовина, називається адсорбентом, а речовина, що адсорбується – адсорбтивом. Кількість адсор-бованої речовини залежить від величини поверхні адсорбента, концентрації адсорбтива та температури.
Чим більші поверхня адсорбента та концентрація адсорбтива, тим більша кількість речовини адсорбується. Але така залежність кількості адсорбованої речовини (Г) від концентрації (С) існує до певної межі, після чого збільшення концентрації адсорбтива вже не впливає на кількість адсорбованої речовини. (Рис.10)
Г, моль/г

С,
моль/л
Рис.10. Залежність кількості адсорбованої речовини від концентрації адсорбтива
Залежність кількості адсорбованої речовини від температури для оборот-ного процесу адсорбції підпорядкована принципу Ле Шательє. Оскільки адсор-бція – процес екзотермічний, підвищення температури зміщує адсорбційну рівновагу в бік десорбції, тобто зі збільшенням температури адсорбція змен-шується.
Адсорбційні процеси відіграють суттєву роль при утворенні дисперсних систем.
Класифікація дисперсних систем. Дисперсні системи класифікують за розміром часточок дисперсної фази та за агрегатним станом дисперсної фази та дисперсійного середовища.
Найважливішою
характеристикою дисперсних систем є
ступінь дисперс-ності Д — величина,
обернена розміру часточок дисперсної
фази
![]() :
:
D
=
![]()
У залежності від розмірів часточок дисперсної фази дисперсні системи поділяють на грубодисперсні — розмір часточок дисперсної фази 10-5 — 10-7 м (емульсії, суспензії) та колоїдні розчини або золі — розмір часточок дисперсної фази 10-7 — 10-9 м.
Якщо розмір часточок дисперсної фази менший ніж 10-9 м, утворюются істинні розчини, або просто розчини.
Класифікація дисперсних систем за агрегатним станом дисперсної фази та дисперсійного середовища наведена в табл.3.
Таблиця 3
